PPARδ 激动剂对非酒精性脂肪肝大鼠胰岛素抵抗作用的研究
2014-12-31鲁晓岚马惠辉史海涛谢丹红
李 进,鲁晓岚,马惠辉,史海涛,李 红,谢丹红,董 蕾
1.西安交通大学第二附属医院消化内科,陕西 西安710004;2.西安交通大学附属西安市中心医院消化内科
近年来,非酒精性脂肪肝(non-alcoholic liver disease,NAFLD)的患病率不仅在欧美等发达国家逐年上升,在我国也有超越病毒性肝炎成为第一大肝病的趋势。NAFLD 发病机制复杂,目前大多认可由Day 和James 提出的以胰岛素抵抗(insulin resistance,IR)、氧化应激、脂质过氧化为主的“二次打击”学说[1]。以此为切入点,研发新的治疗药物成为首要问题。过氧化物酶增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)属于核受体超家族,是配体激活的转录因子,其包括3 个亚型,即PPARα、PPARγ、PPARδ。吡格列酮为PPARγ 高选择性激动剂,能明显改善机体IR,调节脂质代谢、抑制炎症反应等。由于该类药物有水肿、体质量增加、心力衰竭、肝毒性等不良反应,临床上在NAFLD 治疗应用中受到一定限制[2]。GW501516 为PPARδ 高选择性激动剂。目前有研究报道,PPARδ 激动剂具有调节糖代谢、改善IR的作用,研究领域涉及2 型糖尿病、代谢综合征及冠状动脉粥样硬化症等,涉及NAFLD 的研究报道较少[3-6]。本研究以PPARγ 激动剂吡格列酮为阳性对照药物,研究PPARδ 激动剂GW501516 对NAFLD 大鼠糖代谢及脂代谢的作用,并初步阐释激活PPARδ 后可能通过哪些信号途径对糖代谢及脂代谢起作用。
1 材料与方法
1.1 材料与试剂 SD 雄性大鼠购自西安交通大学医学院动物实验中心,GW501516 购自美国Santa Cruz 公司,盐酸吡格列酮片购自杭州中美华东制药有限公司,兔抗大鼠固醇调节元件结合蛋白(SREBPs-1c)多克隆抗体及兔抗大鼠葡萄糖转运蛋白-2(glucose transporter -2,GLUT-2)多克隆抗体购自美国Santa Cruz 公司,兔二步法免疫组化检测试剂盒及DAB 显色试剂盒购自北京中杉金桥生物技术有限公司。大鼠胰岛素放免分析试剂盒及大鼠胰岛素样生长因子-1(IGF-1)酶联免疫分析试剂盒购自上海源叶生物科技有限公司。1.2 实验动物及分组 SD 雄性大鼠共47 只,体质量150 g,随机分为造模组(n =37)与正常对照组(n =10)。造模组及正常对照组分别给予高脂饲料及普通饲料喂养12 周。于12 周末从造模组中随机取3 只大鼠,行肝组织HE 染色,光镜下观察造模成功。将造模成功剩余的SD 大鼠(n =34)随机分为:模型组(n =10),GW501516 治疗组(n =12),吡格列酮治疗组(n=12)。GW501516 组及吡格列酮组于每天分别给予治疗药物灌胃,剂量均为10 mg·kg-1·d-1。正常对照组和模型组每天给予等体积生理盐水灌胃。各组于喂养2 周、4 周后分别处死半数大鼠,称体质量、肝湿重,量体长,采集血清,留取肝组织。
1.3 肝指数及体质量指数计算 肝指数= 肝湿重(g)/体质量(g)。体质量指数(BMI)=体质量(kg)/体长(m)2。
1.4 血清生化指标检测 全自动生化分析仪检测:空腹血糖、甘油三酯、总胆固醇、低密度脂蛋白、高密度脂蛋白、血清转氨酶、谷酰转肽酶、碱性磷酸酶。
1.5 血清FINS 放免法检测 采用空腹胰岛素试剂盒检测,严格按照试剂盒操作说明进行。胰岛素敏感性稳态模型(HOMA-IR)=空腹血糖(mmol/L)×空腹胰岛素(mIU/L)/22.5。
1. 6 血清IGF-1 ELISA 检测 采用大鼠IGF-1-ELISA 试剂盒,严格按照试剂盒操作说明书执行。
1.7 肝组织油红O 染色及HE 染色 取肝左叶1 cm×1 cm ×0.5 cm 组织置于含有0.9%氯化钠溶液50 ml 的广口标本瓶,以备行肝组织冰冻切片,油红O 染色,镜下观察:脂滴呈红色,细胞核呈蓝紫色。另取肝左叶1 cm×1 cm×0.5 cm 置于含有10%中性甲醛溶液50 ml 的广口标本瓶中固定,以备肝组织HE 染色,镜下观察:细胞核呈蓝紫色,胞浆及纤维组织呈深浅不一的红色。
1.8 免疫组化检测肝组织SREBP-1c 及GLUT-2 表达 采用二步法试剂盒进行检测。SERBP-1c 表达以细胞胞浆呈棕黄色为阳性,GLUT-2 表达以细胞膜呈棕黄色为阳性。免疫组化显色程度分:弱、中、强(+、++、+ + +)3 种(记为1、2、3 分);随机选取5 个视野(400 ×),按显色范围分为:+、+ +、+ + +、+ + ++4 级(记为1、2、3、4 分)。显色指数=显色程度×显色范围,取其均数作为检测指标的最终显色指数。
1.9 统计学处理 使用SPSS 13.0 软件包进行数据分析,数据采用x±s 表示。多样本均数比较采用方差分析,组间均数两两比较采用LSD-t 检验。非正态分布的计量资料,采用秩和检验。P <0.05 为差异有统计学意义。
2 结果
2.1 肝湿重、体质量、肝指数及BMI 与正常对照组相比,模型组、GW501516 组、吡格列酮治疗组大鼠的肝湿重、体质量、肝指数及BMI 明显增加(P <0.05),但GW501516 治疗4 周时差异无统计学意义(P >0.05);与模型组相比,GW501516 治疗组肝湿重、体质量、肝指数及BMI 均下降,在治疗4 周后更为明显(P<0.05),吡格列酮治疗组的肝湿重及肝指数也下降(P <0.05),但体质量及BMI 无明显变化;在治疗4 周后,GW501516 治疗组大鼠的体质量和BMI 较吡格列酮治疗组低(P <0.05);各组大鼠的体长均无明显变化,差异无统计学意义(P >0.05)(见表1)。

表1 各组大鼠肝湿重、体质量、体长、肝指数、BMI(x±s)Tab 1 The liver wet weight,body mass,body length,liver index and BMI of rats in each group (x±s)
2.2 肝组织油红O 染色及HE 染色 正常对照组肝细胞呈条索状排列,围绕中央静脉呈放射状,小叶内无炎症细胞浸润,未见明显脂滴。模型组肝细胞排列紊乱,存在大量脂肪空泡,以大泡性脂滴为主,伴有大量炎性细胞浸润及点片状坏死。药物治疗4 周后,GW501516 组肝细胞排列较为规整,少量炎性细胞浸润,脂滴密集度减少;吡格列酮组肝细胞排列较为规整,有少量炎性细胞浸润、脂滴分布减少,但比GW501516 组多(见图1 ~2)。
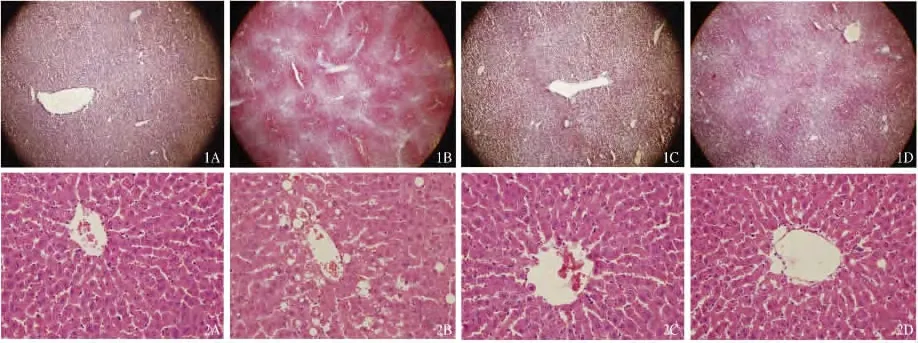
图1 各组大鼠肝组织油红O 染色(40 ×) A:正常对照组;B:模型组;C:GW501516 组治疗4 周;D:吡格列酮组治疗4 周;图2各组大鼠肝组织HE 染色(400 ×) A:正常对照组;B:模型组;C:GW501516 组治疗4 周;D:吡格列酮组治疗4 周Fig 1 Oil red O staining of rats in each group (40 ×) A:normal control group;B:model group;C:GW501516 group after treatment for 4 weeks;D:Pioglitazone group after treatment for 4 weeks;Fig 2 HE staining of rats in each group (400 ×) A:normal control group;B:model group;C:GW501516 group after treatment for 4 weeks;D:pioglitazone group after treatment for 4 weeks
2.3 糖代谢指标 与正常对照组相比,模型组、GW501516 治疗组、吡格列酮治疗组大鼠的空腹血糖、空腹胰岛素及HOMA-IR 均升高,而血清IGF-1 水平下降(P <0.05),但GW501516 治疗4 周后差异无统计学意义(P >0.05);与模型组相比,GW501516 治疗组及吡格列酮组的空腹血糖、空腹胰岛素及HOMA-IR均下降,血清IGF-1 水平升高,在治疗4 周后更为明显(P <0.05);治疗4 周后,GW501516 治疗组大鼠的空腹血糖、空腹胰岛素及HOMA-IR 较吡格列酮治疗组低,而血IGF-1 水平较吡格列酮治疗组高(P <0.05,见表2)。

表2 各组大鼠空腹血糖、空腹胰岛素、HOMA-IR 及IGF-1 表达情况(x±s)Tab 2 Expression of fasting blood glucose,fasting insulin,HOMA-IR and IGF-1 of rats in each group (x±s)
2.4 脂代谢指标 与正常对照组相比,模型组、GW501516 治疗组、吡格列酮治疗组大鼠的甘油三酯、总胆固醇及低密度脂蛋白均升高,而高密度脂蛋白下降(P <0.05),GW501516 治疗4 周后差异无统计学意义(P >0.05);与模型组相比,GW501516 治疗组及吡格列酮治疗组的甘油三酯、总胆固醇及低密度脂蛋白均下降,高密度脂蛋白升高,在治疗4 周后更为明显(P <0.05);在治疗2 周及4 周后,GW501516 治疗组大鼠的空腹血糖、空腹胰岛素及HOMA-IR 均较吡格列酮治疗组低,而高密度脂蛋白较吡格列酮治疗组高(P <0.05,见表3)。

表3 各组大鼠甘油三酯、总胆固醇、低密度脂蛋白及高密度脂蛋白表达情况(x±s)Tab 3 Expression of serum triglyceride,total cholesterol,low-density lipoprotein and high-density lipoprotein of rats in each group (x±s)
2.5 肝功能指标 与正常对照组相比,模型组、GW501516 治疗组、吡格列酮治疗组大鼠的谷丙转氨酶、谷草转氨酶、谷酰转肽酶及碱性磷酸酶均升高(P<0.05),但GW501516 治疗4 周后差异无统计学意义(P >0.05);与模型组相比,GW501516 治疗组及吡格列酮治疗组的谷丙转氨酶、谷草转氨酶、谷酰转肽酶及碱性磷酸酶均下降,在治疗4 周后更为明显(P <0.05);在治疗2 周及4 周后,GW501516 治疗组大鼠的谷丙转氨酶、谷草转氨酶、谷酰转肽酶及碱性磷酸酶均较吡格列酮治疗组低(P <0.05,见表4)。
2.6 免疫组化测定SREBP-1c 及GLUT-2 的表达与分布 肝脏SREBP-1c 表达于肝细胞胞浆,呈棕黄色为阳性。GLUT-2 主要表达于肝细胞膜,呈棕黄色为阳性。与正常对照组相比,模型组SREBP-1c 表达明显增高(P <0.05),GLUT-2 表达明显降低(P <0.05);与模型组相比,GW501516 组治疗2 周及4 周后SREBP-1c 表达均降低(P <0.05),GLUT-2 表达均升高(P <0.05),吡格列酮组在2 周时差异无统计学意义(P >0.05),在治疗4 周后则SREBP-1c 表达降低(P <0.05),GLUT-2 表达升高(P <0.05)。与吡格列酮组比较,GW501516 组的SREBP-1 表达更低(P <0.05),GLUT-2 表达更高(P <0.05,见表5、图3 ~4)。
3 讨论
PPARs 是上世纪90 年代发现的核激素受体,由于PPARs 所显现出的重要作用,使得PPARs 受体和配体的研究成为生物医学和药理学研究的热点。大量研究表明,PPARs 与肥胖、心血管病、糖尿病、高血压及肿瘤等疾病的转归有密切的关联,PPARδ 是PPARs 的亚型之一,广泛表达于多种器官和组织中[7]。PPARδ 的配体分为天然配体和合成配体。天然配体包括多不饱和脂肪酸和一些类花生酸类物质,合成配体主要为一些小分子化合物,如白三烯拮抗剂L-165041、苯氧乙酸衍生物GW0742 和GW501516,其中GW501516 对PPARδ 的激活能力达到纳摩尔级,且对δ 亚型的选择性高于α 和γ 亚型1 000 倍[8]。PPARδ 与GW501516结合后,活化的PPARδ 与9-顺视黄酸类受体形成异二聚体,然后识别并于靶基因启动子上游的过氧化物酶体增殖物反应元件结合,调节下游靶基因的转录、翻译及生物学效应。目前的研究证实PPARδ 激活后参与调节脂质代谢,提高脂肪酸氧化,增加高密度脂蛋白和降低低密度脂蛋白,抑制肥胖,增强身体耐力,提高胰岛素敏感,改善动脉粥样硬化和改善心肌重塑[3-6]。国内外对于PPARδ 及其激动剂的研究主要集中在糖尿病、冠状动脉粥样硬化、代谢综合征等领域,涉及NAFLD 相对较少。PPARs 的各类激动剂均对糖、脂代谢有影响,而NAFLD 与代谢综合症和糖、脂代谢密切相关。本研究主要探讨PPARδ 激动剂对NAFLD 大鼠糖脂代谢的影响,并初步探讨其可能的机制。
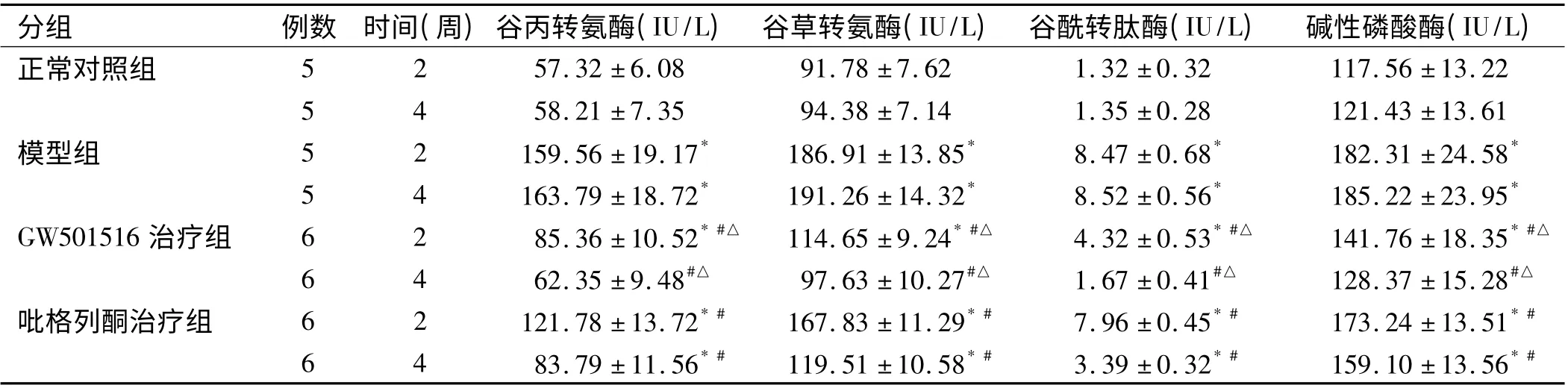
表4 各组大鼠谷丙转氨酶、谷草转氨酶、谷酰转肽酶及碱性磷酸酶表达水平(x±s)Tab 4 Expression of ALT,AST,GGT and ALP of rats in each group (x±s)

图3 各组大鼠肝脏SREBP-1c 的表达(HE 400 ×) A:正常对照组;B:模型组;C:GW501516 组治疗4 周;D:吡格列酮组治疗4周;图4 各组大鼠肝脏GLUT-2 的表达(HE 400 ×) A:正常对照组;B:模型组;C:GW501516 组治疗4 周;D:吡格列酮组治疗4 周Fig 3 Expression of SREBP-1c of rats in each group(HE 400 ×)A:normal control group;B:model group;C:GW501516 group after treatment for 4 weeks;D:Pioglitazone group after treatment for 4 weeks;Fig 4 The expression of GLUT-2 of rats in each group(HE 400 ×) A:normal control group;B:model group;C:GW501516 group after treatment for 4 weeks;D:pioglitazone group after 4 weeks treatment
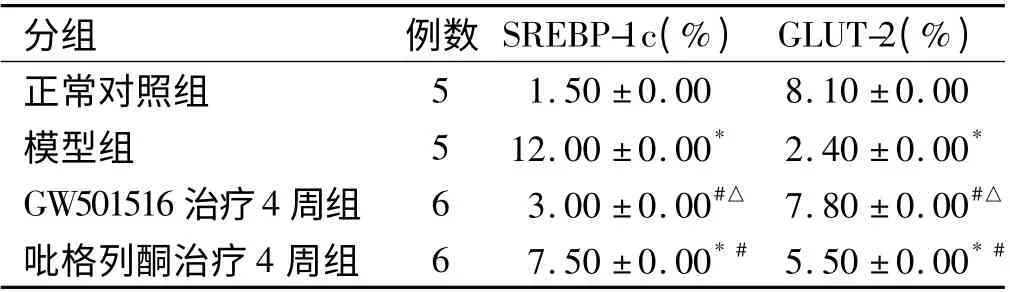
表5 各组肝脏SREBP-1c 及GLUT-2 显色指数(x±s)Tab 5 The rendering index of SREBP-1c and GLUT-2 of rats in each group (x±s)
本实验以高脂饮食诱导NAFLD 模型,观察PPARδ 激 动 剂 GW501516 的 作 用。发 现 给 予GW501516 后大鼠体质量减轻、肝湿重降低,并由此计算的肝指数也明显降低,在大鼠体长无变化的情况下,体质量的减轻引起了BMI 的降低。由实验结果还可以看出,高脂饮食可造成明显的肝功损害并导致肝细胞脂肪变性,同时伴随有明显的糖、脂代谢紊乱,而给予GW501516 治疗后,肝功转氨酶降低、肝组织得到一定的恢复,糖脂代谢紊乱也明显得以纠正,由空腹血糖及空腹胰岛素计算的反映胰岛素抵抗的HOMA-IR 也明显降低,提示胰岛素抵抗也得到改善。由此,GW501516 对高脂饮食诱导的NAFLD 有明显的治疗作用,除能改善肝脏脂肪变性外,对全身的糖脂代谢也有明显的改善作用。
研究发现,IGF-1 为肝脏依赖生长激素刺激合成的同化激素,其可在全身各处表达,血液中的IGF-1 主要来源于肝脏生物合成。Sesti 等[9]研究表明,IGF-1浓度与HOMA-IR 呈独立正相关,可作为胰岛素抵抗综合征的指标。SREBPs 是一类含有“碱性螺旋-环-螺旋-亮氨酸拉链”结构的核转录因子。哺乳动物中分为3 个亚型:SREBP-1a、SREBP-1c、SREBP-2。动物体内90%的SREBP-1 为SREBP-1c。Kohjima 等[10]研究表明,NAFLD 组SREBP-1c 表达量显著高于正常对照组。Frederico 等[11]研究认为,饮食诱导的NAFLD小鼠,通过抑制SREBP-1c,减少脂肪合成相关蛋白,如乙酰辅酶A 羧化酶(ACC)、脂肪酸合成酶(FAS)、硬脂酰辅酶A 去饱和酶-1(SCD-1)的表达,降低甘油三酯积累,可逆转肝脂肪变性。GLUT-2 主要介导葡萄糖的转运及代谢。GLUT-2 可作为葡萄糖的细胞膜受体,监测细胞外葡萄糖水平,调节肝细胞糖原合成与分解,胰岛β 细胞胰岛素分泌,肠道葡萄糖吸收等功能[12]。增加肝细胞、胰岛细胞及肠道上皮细胞GLUT-2 膜转位(由细胞内膜转到外膜)可增加葡萄糖的摄取和利用,上调胰岛素信号传导,进而提高胰岛素敏感性,改善机体糖代谢紊乱。综上可知,IGF-1 及GLUT-2 属于糖代谢指标范畴,但也有调节脂代谢的作用;SREBP-1c 属于脂代谢范畴,但也有调节糖代谢的作用。Ronis等[13]认为激活PPAR 信号通路与抑制SREBP-1c 信号通路可改善IR。Smith 等[14]研究表明,IGF-1 可增加SREBP-1c 的表达,进而调节脂质合成。GLUT-2 为PPARγ 下游调节基因,其表达增强可改善肝脏的葡萄糖代谢。
本实验采用ELISA 实验检测大鼠血清中IGF-1 水平,采用免疫组化检测大鼠肝脏SREBP-1c 及GLUT-2的表达,发现GW501516 可上调血中IGF-1 水平及肝脏GLUT-2、下调SREBP-1c,提示激活PPARδ 后可能通过GLUT-2、SREBP-1c 及IGF-1 相关信号途径调节糖、脂代谢,提高胰岛素敏感性,减轻肝脏脂肪变性。但上述各基因上、下游关系及调控的机制有待于进一步研究。本研究以PPARγ 激动剂吡格列酮作为阳性对照,发现GW501516 在对BMI、糖代谢、脂代谢、IGF-1、GLUT-2、SREBP-1c 等方面的影响均优于吡格列酮,提示PPARδ 激动剂在治疗NAFLD 方面可能优于PPARγ 激动剂。综上所述,PPARδ 激动剂在大鼠NAFLD 的改善上显示出了明显的优势,为其临床应用提供了实验依据,但其影响糖脂代谢的具体信号途径还需进一步深入的研究和探讨。
[1] Day CP. Non-alcoholic fatty liver disease:current concepts and management strategies[J]. Clin Med,2006,6(1):19-25.
[2] Liu XY,Liu C. Reevaluation on the adverse effects of thiazolidinediones[J]. Intern J Endocrinol Metab,2009,28(6):369-373.刘晓云,刘超. 噻唑烷二酮类药物不良反应的再认识[J]. 国际内分泌代谢杂志,2009,28(6):369-373.
[3] Lee J,Chung WY. The role played by the peroxisome proliferator-activated receptor-β/δ (PPARβ/δ)activator,GW501516,in control of fatty acid metabolism:a new potential therapeutic target for treating metabolic syndrome[J]. Endocrinology,2011,152(5):1742-1744.
[4] Barroso E,Rodríguez-Calvo R,Serrano-Marco L,et al. The PPARβ/δ activator GW501516 prevents the down-regulation of AMPK caused by a high-fat diet in liver and amplifies the PGC-1α-lipin 1-PPARα pathway leading to increased fatty acid oxidation [J]. Endocrinology,2011,152(5):1848-1859.
[5] Serrano-Marco L,Barroso E,EI Kochairi I,et al. The peroxisome proliferator-activated receptor (PPAR)β/δ agonist GW501516 inhibits IL-6-induced signal transducer and activator of transcription 3(STAT3)activation and insulin resistance in human liver cells[J].Diabetologia,2012,55 (3):743-751.
[6] Nagasawa T,Inada Y,Nakano S,et al. Effects of bezafibrate,PPAR pan-agonist,and GW501516,PPAR delta agonist,on development of steatohepatitis in mice fed a methionine-and choline-deficient diet[J].Eur J Pharmacol,2006,536(1-2):182-191.
[7] Braissant O,Foufelle F,Scotto C,et al. Differential expression of peroxisome proliferator activated receptors (PPARs):tissue distribution of PPAR-alpha,-beta,and -gamma in the adult rat[J]. Endocrinology,1996,137(1):354-366.
[8] Sznaidman ML,Haffner CD,Maloney PR,et al. Novel selective small molecule agonists for peroxisome proliferatoractivated receptor delta(PPARdelta)--synthesis and biological activity[J]. Bioorg Med Chem Lett,2003,13(9):1517-1521.
[9] Sesti G,Sciacqua A,Cardellini M,et al. Plasma concentration of IGF-I is independently associated with insulin sensitivity in subjects with different degrees of glucose tolerance[J]. Diabetes Care,2005,28(1):120-125.
[10] Kohjima M,Higuchi N,Kato M,et al. SREBP-1c,regulated by the insulin and AMPK signaling pathways,plays a role in nonalcoholic fatty liver disease[J]. Intern J Mol Med,2008,21(4):507-511.
[11] Frederico MJ,Vitto MF,Cesconetto PA,et al. Short-term inhibition of SREBP-1c expression reverses diet-induced non-alcoholic fatty liver disease in mice [J]. Scand J Gastroenterol,2011,46 (11):1381-1388.
[12] Leturque A,Brot-Laroche E,Le Gall M. GLUT2 mutations,translocation,and receptor function in diet sugar managing[J]. Am J Physiol Endocrinol Metab,2009,296(5):E985-E992.
[13] Ronis MJ,Chen Y,Badeaux J,et al. Dietary soy protein isolate attenuates metabolic syndrome in rats via effects on PPAR,LXR,and SREBP signaling[J]. J Nutr,2009,139(8):1431-1438.
[14] Smith TM,Gilliland K,Clawson GA,et al. IGF-1 induces SREBP-1 expression and lipogenesis in SEB-1 sebocytes via activation of the phosphoinositide 3-kinase/Akt pathway [J]. J Invest Dermatol,2008,128(5):1286-1293.
