aFGF、HGF 体外诱导小鼠ESC 向肝细胞定向分化及标志物研究
2014-12-31应佳丽王雪玲范丽娇张少艳
应佳丽,王雪玲,范丽娇,张少艳
台州学院医学院护理系,浙江 台州318000
胚胎干细胞(embryonic stem cell,ESC)可发育成完整个体,具有分化为各种细胞的潜能,理论上ESC 可无限增殖并进行全能分化。ESC 可在体外培养发育成拟胚体(embryonic body,EB),拟胚体具有外、中、内胚层,三胚层结构之间分泌细胞因子相互作用,进而向各组织类型细胞分化。中胚层心肌细胞产生成纤维细胞生长因子(fibroblast growth factor,FGF),诱导内胚层细胞发育,并由同步分化的内皮细胞支持肝细胞发育形成肝样组织[1]。利用三胚层结构分化成肝细胞,模拟体内肝脏的发育过程,分化所得肝细胞具有体内正常肝细胞的特征和功能[2],小鼠体内实验表明,ESC 分化所得肝细胞前体细胞可使小鼠肝脏再生[3]。因此,ESC 体外分化衍生的肝组织在肝脏发育研究、药物代谢、肝脏衰竭细胞治疗和组织工程应用研究中具有重要意义。也可以为开展肝组织工程、肝细胞移植等研究提供有效的组织细胞来源,由此可见,体外诱导ESC 分化成肝细胞的研究具有重要的基础研究及临床应用价值[2]。本研究利用酸性成纤维细胞生长因子(acid fibroblast growth factor,aFGF)、肝细胞生长因子(hepatocyte growth factor,HGF)对小鼠ESC 体外定向诱导,使其定向分化成肝细胞,检测培养上清液中甲胎蛋白(alpha fetoprotein,AFP)、白蛋白(albumin,ALB)浓度以及细胞角蛋白8(cytokeratin,CK8)、细胞角蛋白18(CK18)在细胞内mRNA 和蛋白表达水平。为ESC 体外的定向诱导建立合理的诱导体系,提高肝细胞分化率,同时也为体外生产肝细胞用于肝细胞移植奠定基础。
1 材料与方法
1.1 实验材料 ESC 由中山大学实验动物中心建系,并保存为Balb/c 系小鼠ESC。细胞培养试剂:ESC 培养基:DMEM (美国Gibico 公司),胎牛血清(杭州四季清公司),巯基乙醇(美国Gibico 公司),HEPES、青霉素和链霉素(美国Gibco-BRL 公司),重组小鼠白血病抑制因子(leukemia inhibitory factor,LIF)(美国Gibico-l Bra公司)。EB 培养基:除LIF 外,其余成分同ESC 培养基,白明胶(美国Sigma 公司)。细胞生长因子:aFGF、HGF(美国Sigma 公司)。CK8、CK18 一抗(丹麦DAKO 公司),抗小鼠ALB 一抗(美国Biodesign 公司)。放射免疫法(RIA)试剂盒(北京中国原子能研究院)。
1.2 研究方法
1.2. 1 ESC 培养:将保存在液氮中的Balb/c 小鼠ESC 取出,立即置于37 ℃解冻复温,离心弃上清后加入ESC 培养基吹散,以2 ×104个/ml 的密度将细胞转至一次性塑料培养瓶中。每天换液1 次,每2 ~3 d 传代1 次。
1.2.2 ESC 发育成为EB:换用EB 培养基,将细胞转至玻璃培养瓶中用摇动培养法培养,每1 h 摇动细胞1 次,使其悬浮生长发育成为EB,第2 天开始2 ~3 h摇动1 次。期间每1 ~2 d 换液1 次,培养5 d。
1.2.3 肝细胞定向诱导分化:EB 培养5 d 后,转至0.1%白明胶处理过的24 孔板上,使其充分贴壁生长,胚体贴壁并向四周分化出多种形态的细胞;第7 ~11 天,加入aFGF,浓度分别为20、40、60、80 ng/ml;第11 ~15 天,加入HGF,浓度分别为10、20、30、40 ng/ml。设立对照组,不加aFGF、HGF,使其自然分化。1.2.4 上清中AFP 和ALB 测定:EB 加入不同浓度aFGF 继续培养5 d 后,收集诱导组和对照组培养上清液2 ml,EB 加入HGF 继续诱导,5 d 后,再次收集培养上清液,RIA 法测定AFP、ALB 浓度。
1.2.5 ALB、CK8、CK18 的mRNA 和蛋白表达水平:EB 先后经aFGF、HGF 诱导后,收集细胞,对分化细胞进行PCR 和Western blotting 检测,观察肝细胞标志物ALB、CK8、CK18 在细胞内表达水平。
(1)RT-PCR:离心收集细胞,Trizol 裂解法提取细胞RNA,进行RT-PCR。逆转录体系总体积为25 μl:取RNA 2 μg,DEPC 水补足至16 μl,10 μmol/L Oligo-(dT)18 1 μl,5 ×RT buffer 5 μl,dNTP 1.5 μl,Rnase Inhibitor 0.5 μl,M-MLV 1 μl,4 ℃离心混匀,37 ℃反应1 h,95 ℃10 min 终止反应。所得cDNA 置于20 ℃保存。
(2)PCR:取cDNA 2 μl,加入灭菌水15 μl,10 ×buffer 2.5 μl,MgCl2,dNTP 1 μl,引物2 μl(上海生工公司合成,引物序列见表1)。Taq DNA 聚合酶0.5 μl,混匀,离心,放入PCR 仪器扩增。PCR 反应条件为:首先94 ℃变性5 min;然后进入循环条件:94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸40 s,循环周期为30个,最后72 ℃延伸10 min,4 ℃暂存。取9 μl PCR 产物,与1 μl 10 × loading buffer 混匀,于2%琼脂糖凝胶,1 ×TBE 缓冲液中电泳。电泳条带经Gel Doc EQ图像分析仪拍照,并用ipp6.0 分析电泳条带灰度值。

表1 PCR 扩增引物序列Tab 1 The sequence of primers
(3)Western blotting:收集细胞,提取蛋白后测定蛋白浓度,经SDS-PAGE 电泳后转膜,转膜后置入5%脱脂奶粉中,37 ℃封闭1 h,加入一抗(1∶1 000),4 ℃过夜,清洗后加入二抗孵育(1∶300),37 ℃孵育1 h,清洗后滴加ECL 工作液使其将膜完全覆盖,与膜共孵育5 min,吸干表面水分后曝光,曝光胶片经扫描为图片后经ipp6.0 分析。
1.3 统计学处理 所得数据经SPSS 19.0 统计学软件处理。实验数据用平均值表示。组间比较采用t 检验,方差分析,P <0.05 为差异有统计学意义,P <0.01为差异有显著统计学意义。
2 结果
2.1 上清液中AFP 和ALB 水平测定 不同浓度aFGF 诱导5 d 后,测定上清液中AFP 和ALB 浓度。上清液中AFP 浓度降低,aFGF 浓度为40 ng/ml 时,与对照组相比,差异有统计学意义(P <0.05),aFGF 浓度为60 ng/m 和80 ng/ml 时,与对照组相比,差异有显著统计学意义(P <0.01),呈浓度依赖性。ALB 浓度升高,aFGF 浓度为60 ng/m 和80 ng/ml,与对照组比较,差异有统计学意义(P <0.05,见图1)。5 d 后加入不同浓度HGF 继续诱导,上清液中AFP 浓度降低,20 ng/ml、30 ng/ml、40 ng/ml 时与对照组相比,差异有统计学意义(P <0.05),ALB 浓度升高,浓度为20 ng/
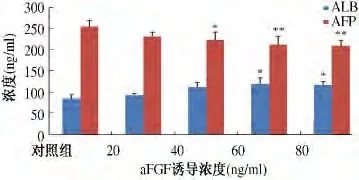
图1 aFGF 诱导ESC 后上清液中AFP 和ALB 水平Fig 1 The concentration of AFP and ALB in the supernatants after the induction of ESC with aFGF
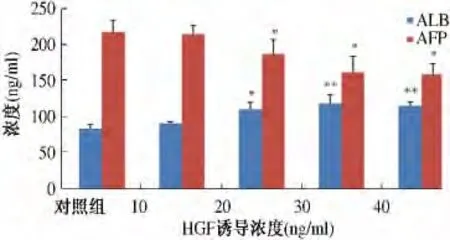
图2 HGF 诱导ESC 后上清液中AFP 和ALB 水平Fig 2 The concentration of AFP and ALB in the supernatants after the induction of ESC with HGF
ml 时与对照组相比,差异有统计学意义(P <0.05);浓度为30 ng/ml、40 ng/ml,与对照组相比,差异有显著统计学意义(P <0.01),呈浓度依赖性(见图2)。2.2 ALB、CK8、CK18 的mRNA 表达水平 PCR 结果经ipp6.0 分析,mRNA 表达水平用实验组和对照组比值表示。加入不同浓度aFGF 继续培养5 d 后,细胞中ALB、CK8、CK18 的mRNA 表达水平升高,与对照组相比,差异有统计学意义(P <0.05),呈浓度依赖性(见图3A)。浓度为60 ng/ml 的aFGF 诱导5 d 后加入不同浓度HGF 继续诱导,细胞中ALB、CK8、CK18的mRNA 表达水平升高,与对照组相比,差异有统计学意义(P <0.05),呈浓度依赖性(见图3B)。

图3 诱导后ESC 细胞中ALB、CK8、CK18 的mRNA 表达水平 A:不同浓度aFGF 诱导5 d 后细胞中ALB、CK8、CK18 的mRNA表达水平;B:浓度为60 ng/ml 的aFGF 诱导5 d 后加入不同浓度HGF,继续培养5 d 后细胞中ALB、CK8、CK18 的mRNA 表达水平Fig 3 The mRNA expression of ALB,CK8 and CK18 in ESC after induction A:The mRNA expression of ALB,CK8 and CK18 in ESC after induction with aFGF for 5 days. B:After distribution with aFGF (60 ng/ml)for 5 days,ESC was induced with different concentration of HGF for another 5 days. The mRNA expression of ALB,CK8 and CK18 in ESC was detected after induction
2.3 ALB、CK8、CK18 的蛋白表达水平 Western blotting 测定结果经ipp6.0 分析,加入不同浓度aFGF 后继续培养5 d 后,细胞中ALB、CK8、CK18 的蛋白表达水平升高,与对照组相比,差异有统计学意义(P <0.05,见图4A)。浓度为60 ng/ml 的aFGF 诱导5 d 后加入不同浓度HGF 继续诱导,细胞中ALB、CK8 的蛋白表达水平升高,与对照组相比,差异有统计学意义(P <0.05,见图4B),CK18 的蛋白表达水平和对照组相比,差异有显著统计学意义(P <0.01),呈浓度依赖性。

图4 诱导后ESC 细胞中ALB、CK8、CK18 的蛋白表达水平 A:不同浓度aFGF 诱导5 d 后细胞中ALB、CK8、CK18 的蛋白表达水平;B:浓度为60ng/ml 的aFGF 诱导5 d 后加入不同浓度HGF,继续培养5 d 后细胞中ALB、CK8、CK18 的蛋白表达水平Fig 4 The protein expression of ALB,CK8 and CK18 in ESC after induction A:The protein expression of ALB,CK8 and CK18 in ESC after induction with aFGF for 5 days. B:After distribution with aFGF (60 ng/ml)for 5 days,ESC was induced with different concentration of HGF for another 5 days. The protein expression of ALB,CK8 and CK18 in ESC was detected after induction
3 讨论
ESC 体外发育过程很难模拟。已有研究表明通过EB 实现ESC 向肝细胞的分化,细胞之间的相互作用可启动肝细胞的早期分化[4],但分化得到的细胞种类较多,分化率较低,因此有必要进行更有效的定向诱导分化。此外,也可通过成体干细胞诱导生成肝细胞[5],已有研究证实,体外诱导骨髓间充质干细胞等诱导可生成肝细胞[5-6],两种方法在取材和肝细胞分化率中各有优缺点,都具有重要研究价值。
在胚胎发育过程中,FGF 由中胚层细胞分泌,参与诱导内胚层细胞向肝细胞方向分化,对于早期ESC 分化为肝细胞具有重要作用[7]。本实验通过EB 培养后加入aFGF 和HGF 诱导ESC 向肝细胞方向分化。EB培养5 d 后依次加入不同浓度aFGF、HGF,继续培养后,细胞上清液中AFP 浓度降低,ALB 浓度升高,细胞中ALB、CK8、CK18 的mRNA 和蛋白表达水平升高,相比较而言,CK8、CK18 的mRNA 和蛋白表达水平在aFGF 诱导后升高更为显著;而ALB 在HGF 诱导后升高更显著。AFP 为早期肝细胞标志,肝细胞成熟过程中表达量逐渐降低,ALB 及CK18 为成熟肝细胞标志物[8]。结果提示,aFGF 更多参与早期肝细胞诱导分化过程,HGF 对于后期肝细胞诱导分化具有重要作用。已有研究发现,FGF4 可促进小鼠ESC 向肝细胞方向分化[9],肝细胞分化标志AFP、HNF4 表达升高,ALB、HNF1 表达未出现明显变化。本研究表明,aFGF 诱导后细胞中AFP 表达降低,ALB、CK8、CK18 表达升高。不同细胞因子诱导ESC 分化后肝细胞标志物表达不同,提示其诱导作用机制存在差异,也有可能因诱导时间不同,肝细胞处于不同分化阶段,进而表达的肝细胞标志物有所不同。
ESC 诱导向肝细胞方向分化是近年来研究热点[10],如何优化诱导体系的相关研究众多[11]。本实验从模拟体内ESC 发育为基础,利用ESC 发育成肝细胞所需细胞因子进行诱导,避免使用DMSO 等外源因素[8],防止对细胞造成可能的毒性作用[12],更有利于进一步研究及临床应用。ESC 向肝细胞方向分化是一个复杂而缜密的过程[13],aFGF 和HGF 的诱导作用机制尚不明确,其涉及的信号通路有待进一步研究。
[1] Ruhnke M,Ungefroren H,Zehle G,et al. Long-term culture and differentiation of rat embryonic stem cell-like cells into neuronal,glial,endothelial,and hepatic lineages[J]. Stem Cells,2003,21(4):428-436.
[2] Kakinuma S,Nakauchi H,Watanabe M. Hepatic stem/progenitor cells and stem-cell transplantation for the treatment of liver disease[J]. J Gastroenterol,2009,44(3):167-172.
[3] Li F,Liu P,Liu C,et al. Hepatoblast-like progenitor cells derived from embryonic stem cells can repopulate livers of mice[J]. Gastroenterology,2010,139(6):2158-2169.
[4] Chan KM,Fu YH,Wu TJ,et al. Hepatic stellate cells promote the differentiation of embryonic stem cell-derived definitive endodermal cells into hepatic progenitor cells[J]. Hepatol Res,2013,43(6):648-657.
[5] Duan FL,Sun Y. The research progression and application outlook multisource derived stem cell differentiating into hepatocyte lineage[J]. Chin J Gastroenterol Hepatol,2003,12(1):1-4.段芳龄,孙嫣. 不同来源干细胞向肝系细胞转化的研究进展及应用前景[J]. 胃肠病学和肝病学杂志,2003,12(1):1-4.
[6] Sun Y,Duan FL,Chen XY,et al. The differentiation of human bone marrow mesenchymal stem cells into hepatocyte-like cells in vitro[J].Chin J Gastroenterol Hepatol,2004,13(3):244-248.孙嫣,段芳龄,陈香宇,等. 人骨髓间充质干细胞体外分化为肝细胞样细胞[J]. 胃肠病学和肝病学杂志,2004,13(3):244-248.
[7] Jung J,Zheng M,Goldfarb M,et al. Initiation of mammalian liver development from endoderm by fibroblast growth factors[J]. Science,1999,284(5422):1998-2003.
[8] Gao ZQ,Tao KS,Li R,et al. Effect of different inducing conditions on rat fetal liver stem cells differentiation in vitro[J]. Chin J Gastroenterol Hepatol,2010,19(6):513-516.高植泉,陶开山,李韧,等. 体外不同诱导条件下对大鼠胚胎肝干细胞分化影响的实验研究[J]. 胃肠病学和肝病学杂志,2010,19(6):513-516.
[9] Duncan AW,Dorrell C,Grompe M. Stem cells and liver regeneration[J].Gastroenterology,2009,137(2):466-481.
[10] Sivertsson L,Synnergren J,Jensen J,et al. Hepatic differentiation and maturation of human embryonic stem cells cultured in a perfused three-dimensional bioreactor[J]. Stem Cells Dev,2013,22(4):581-594.
[11] Ishii T,Yasuchika K,Ikai I. Hepatic differentiation of embryonic stem cells by murine fetal liver mesenchymal cells[J].MethodsMol Biol,2013,946:469-478.
[12] Kang SJ,Jeong SH,Kim EJ,et al. Evaluation of hepatotoxicity of chemicals using hepatic progenitor and hepatocyte-like cells derived from mouse embryonic stem cells:effect of chemicals on esc-derived hepatocyte differentiation [J]. Cell Biol Toxicol,2013,29(1):1-11.
[13] Heo J,Ahn EK,Jeong HG,et al. Transcriptional characterization of wnt pathway during sequential hepatic differentiation of human embryonic stem cells and adipose tissue-derived stem cells[J]. Biochem Biophys Res Commun,2013,434(2):235-240.
