野生小果油茶ISSR-PCR反应体系的建立与优化
2014-12-29李国帅曹福祥彭继庆胡双喜彭滟钞
李国帅,曹福祥,彭继庆,胥 文,胡双喜,彭滟钞
(中南林业科技大学,湖南 长沙410004)
野生小果油茶ISSR-PCR反应体系的建立与优化
李国帅,曹福祥,彭继庆,胥 文,胡双喜,彭滟钞
(中南林业科技大学,湖南 长沙410004)
为建立一个具有良好稳定性和可重复性的野生小果油茶ISSR-PCR反应体系,以提取的野生小果油茶总DNA为供试材料,利用单因素试验,正交试验设计L16(45)和方差分析对DNA模板的量,引物浓度,dNTPs浓度,Mg2+浓度,TaqDNA聚合酶的量5个影响ISSR-PCR反应体系的因素进行优化研究。确定野生小果油茶ISSRPCR最优反应体系为:在20 μL的反应体系中,DNA模板为30 ng,引物浓度为0.7 μmol/L,dNTPs浓度为0.25 mmol/L,Mg2+浓度为2.0 mmol/L,Taq DNA聚合酶的量为1.75 U。方差分析结果表明,5个因素对体系的影响均未达到显著水平,其中引物浓度对反应体系影响最大。应用建立的体系对5份野生小果油茶样品进行扩增,证明了该体系具有稳定性和可重复性。
野生小果油茶;ISSR-PCR;单因素实验;正交试验设计
小果油茶Camellia meiocarpa又名江西子,小茶,鸡心子等[1],是山茶科山茶属小乔木。果实可以榨油,油中含不饱和脂肪酸可达90%,是一种优质食用油。小果油茶野生种群主要分布于中亚热带海拔600 m以下的地区[2]。
ISSR(inter simple sequence repeat,ISSR)分子标记,即简单重复序列区间扩增多态性,是在SSR分子标记技术的基础上发展的一种微卫星分子标记技术[3]。ISSR分子标记以PCR反应为基础,具有操作简便、灵敏、快速,所需DNA模板量少,成本低等优点。目前,ISSR分子标记技术已经在物种遗传多样性,生物种质资源鉴定,基因定位,遗传图谱构建等方面研究获得广泛应用[4]。不同植物的反应体系不仅受到植物材料的影响,还受到dNTPs 浓度、Mg2+浓度、引物浓度、Taq DNA聚合酶浓度等因素影响。本研究拟以野生小果油茶叶片为实验材料,通过单因素试验和正交试验设计对ISSR-PCR反应体系的各个因素进行优化,建立野生小果油茶ISSR-PCR最佳的反应体系,为下一步的野生小果油茶遗传多样性研究和遗传图谱的构建提供基础。
1 材料与方法
1.1 植物材料
野生小果油茶叶片样品采自湖南省浏阳市文家 市 镇(28°04′01.85″N,113°58′27.72″E, 海 拔184 m)。采集的叶片要选择完整、没有病虫害的新鲜叶片,用湿纱布擦拭干净后放入自封袋中,并加入适量的硅胶。用冰盒保存带回实验室,置于-70℃超低温冰箱中保存备用。
1.2 主要试剂
Tris碱、乙二胺四乙酸二钠(EDTA ,Ethylene Diamine Tetraacetic Acid) 、Taq DNA聚合酶(Taq plus DNA Polymerase)、三磷酸碱基脱氧核苷酸(dNTPs,deoxyribonucleosde triphosphate)、植物基因组DNA提取试剂盒(天根生化科技(北京)有限公司)、200 bp DNA Marker(天根生化科技(北京)有限公司)、ISSR随机引物(由南京金斯瑞生物科技有限公司合成)。
1.3 主要仪器
超净工作台、GILSON移液枪一套、恒温水浴锅、高速冷冻离心机、电泳仪、紫外分光光度计、凝胶成像系统、超低温冰箱、电子天平、涡旋振动仪。
1.4 基因组总DNA的提取与检测
1.4.1 基因组总DNA的提取
采用天根生化科技(北京)有限公司购买的植物基因组提取试剂盒提取野生小果油茶叶片的基因组DNA,操作步骤按照使用说明书进行。
1.4.2 基因组总DNA的检测
用1.0%的琼脂糖凝胶(加入EB的终浓度为0.5 μg/mL)电泳检测提取的野生小果油茶总基因组DNA的质量,用紫外分光光度计测定DNA样品的纯度和浓度。把提取的DNA样品统一稀释至一定浓度后,-20℃保存备用。
1.5 ISSR-PCR反应体系的优化
1.5.1 引物的筛选
经查阅文献资料后[5],ISSR-PCR反应体系确定为(20 μL):模板DNA 20 ng,Mg2+2.5 mmol/L,dNTPs 0.25 mmol/L, 引 物 0.6 μmol/L,10×PCR Buffer 2.0 μL,Taq DNA聚合酶1.75 U。扩增反应程序为94℃预变性4 min;94℃变性30 s,52℃退火45 s,72℃延伸90 s,35个循环;72℃延伸7 min;4℃保存。
本实验所用的ISSR引物序列按照加拿大哥伦比亚大学(UBC)公布的第9套ISSR引物序列,由南京金斯瑞生物科技有限公司进行合成。参照刘本英等[5]和范海艳等[6]筛选出的多态性高,重复性好的10条引物,用同一个DNA模板进行引物初筛,然后再用2个DNA模板进行复筛。筛选出一条扩增条带清晰,重复性好的引物用于后续优化实验。

表1 10条引物碱基序列及Tm值Table 1 Base sequences of 10 primers and theirs annealingtemperatures (Tm)
1.5.2 引物退火温度的确定
参考不同引物的Tm值,利用梯度PCR确定相应引物的最佳退火温度,梯度设置为Tm-4,Tm-3,Tm-2,Tm-1,Tm,Tm+1,Tm+2,Tm+3,Tm+4,Tm+5共10个梯度。
1.5.3 ISSR-PCR反应体系单因素筛选
PCR扩增体系为20 μL,利用梯度实验的方法对反应体系中DNA模板浓度,引物浓度,dNTPs浓度,Mg2+浓度,TaqDNA聚合酶的量等5个因素进行筛选优化(见表2)。

表2 ISSR-PCR体系单因素筛选设计Table 2 Single factor optimal design of ISSR-PCR reaction system
1.5.4 ISSR-PCR正交试验设计
根据单因素实验优化的结果用于正交试验设计,对DNA模板的量,引物浓度,dNTPs浓度,Mg2+浓度,TaqDNA聚合酶的量这5个影响ISSRPCR反应体系的因素做L16(45)正交设计表[7](见表3),即在5个因素4个水平上做正交优化。每个处理做3个重复。通过统计琼脂糖凝胶电泳图上扩增出来的条带数,从而确定最佳的野生小果油茶ISSR-PCR反应体系。

表3 正交试验设计因素及水平Table 3 Factors and levels of orthogonal experimental design
2 结果与分析
2.1 野生小果油茶基因组DNA的纯度和浓度
利用植物基因组提取试剂盒提取的野生小果油茶基因组总DNA,通过琼脂糖凝胶电泳检测结果如图1所示,电泳条带清晰明亮,没有拖带现象,进样孔内干净,没有蛋白质杂质。前端也没有RNA 的条带;通过紫外分光光度计测定OD260和OD280,结果如下表4,它们的OD260/OD280值在1.7~1.9之间,浓度在30~80 ng/μL之间。这表明试剂盒提取的DNA质量和纯度都比较高,DNA的浓度也比较高,可以继续进行后续试验。

图1 5个样品的基因组DNA电泳Fig. 1 Electrophoresis pattern of genomic DNA from 5 samples
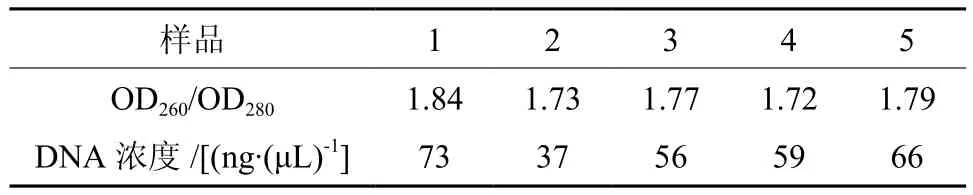
表4 DNA紫外检测结果Table 4 Ultraviolet absorption test of DNA
2.2 ISSR-PCR引物的初筛
根据参考文献挑选的10条引物中除引物UBC807外均能扩增出比较清晰的多态性条带(见图2)。但是引物UBC825扩增出的条带清晰明亮,多态性高,效果最好。所以选择引物UBC825进行后续的条件优化实验。

图2 10条引物的ISSR-PCR扩增Fig.2 Ten ISSR-PCR amplif i cation of primers
2.3 引物UBC825退火温度的确定
退火温度对扩增的条带稳定性和数目有重要的作用,当退火温度过高时,引物和模板DNA 之间配对就比较困难,扩增出来的条带减少甚至扩增不出条带;当退火温度过低时,引物和模板之间错配率增加,扩增出来的条带增加,影响试验结果的准确性。引物UBC825的退火温度梯度实验如下图3所示,在53℃时扩增出来的条带稳定,明亮,试验确定引物UBC825的最佳退火温度为53℃。

图3 引物UBC825的退火温度对ISSR-PCR扩增体系的影响Fig.3 Effects of UBC825 primer’s annealing temperature on ISSR-PCR amplif i cation system
2.4 ISSR-PCR反应体系的优化
2.4.1 模板DNA的量对ISSR-PCR反应体系的影响
模板DNA的量对PCR扩增有比较大的影响,量太少造成分子的碰撞几率降低,导致偶然性增大,扩增产物出现不稳定性;量太大会增加非特异性的产物扩增。如图4所示,当模板DNA的量小于20 ng时,扩增出来的条带比较模糊;当模板DNA的量大于 60 ng时,扩增条带清晰明亮。但有拖尾现象;当模板DNA的量为 30~40 ng时,扩增条带比较清晰明亮,且扩增带型基本一致。所以在20 μL的体系中,模板DNA的用量为30~40 ng对ISSR-PCR扩增是比较合适的。

图4 DNA模板对ISSR-PCR反应体系扩增的影响Fig.4 Effects of template DNA on ISSR-PCR amplif i cation system
2.4.2 ISSR引物浓度对ISSR-PCR反应体系的影响
PCR能否扩增出特异性产物取决于引物和DNA模板的互补程度,ISSR引物浓度过低,会导致扩增的量不足,条带较少;浓度过高会导致产生新的位点。如图5所示,当ISSR引物浓度小于0.3 μmol/L时,扩增条带数少,条带模糊;当ISSR引物浓度为0.4~0.7 μmol/L时,扩增条带清新明亮,且扩增的条带较多;当ISSR引物浓度大于0.8 μmol/L时,扩增条带模糊。所以,比较适合的ISSR引物浓度为0.6~0.7 μmol/L。
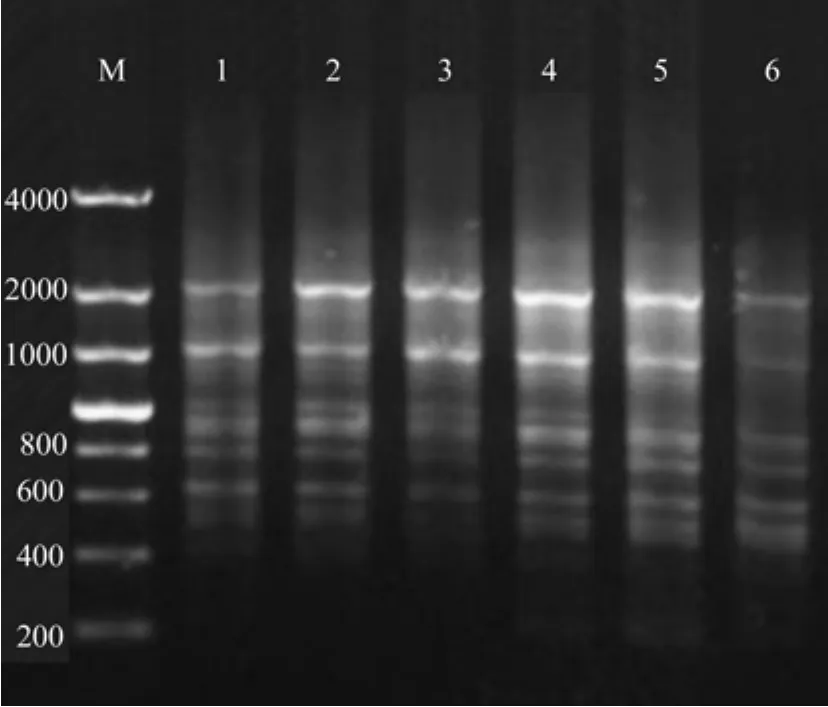
图5 ISSR引物浓度对ISSR-PCR扩增体系的影响Fig.5 Effects of ISSR primer on ISSR-PCR amplif i cation system
2.4.3 Mg2+浓度对ISSR-PCR反应体系的影响
Mg2+是TaqDNA聚合酶是否具有活性的关键因素。同时,Mg2+的浓度大小会影响PCR的扩增效率,特异性以及退火温度。如图6所示,当Mg2+浓度为2.0~3.0 mmol/L时,扩增出来的条带清晰明亮,带型基本一致;当Mg2+浓度大于3.5 mmol/L时,扩增的条带开始变模糊。故较适合的Mg2+浓度为2.0~3.0 mmol/L。
2.4.4 dNTPs浓度对ISSR-PCR反应体系的影响
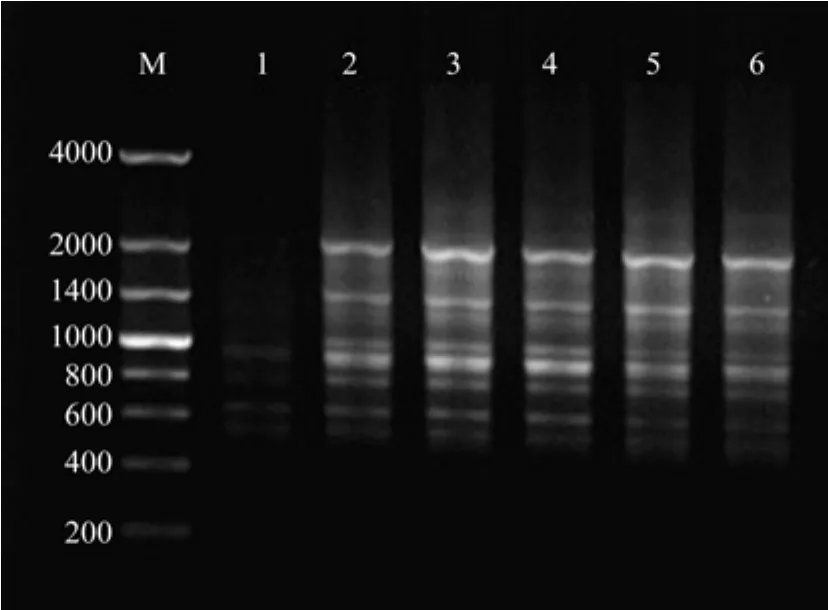
图6 Mg2+浓度对ISSR-PCR反应体系的影响Fig.6 Effects of Mg2+ concentration on ISSR-PCR amplif i cation system
底物的浓度会影响到酶促反应的效率。dNTPs是Taq DNA聚合酶作用的底物,dNTPs浓度太低会影响合成的效率,甚至可能由于过早的消耗导致产物单链化;dNTPs浓度过高又会导致Taq DNA聚合酶错误的掺入。故其浓度大小会对ISSR-PCR反应产生直接的影响。如图7所示,dNTPs在6个不同浓度条件下均能扩增出清晰明亮的特异性条带,但当dNTPs的浓度小于0.15 mmol/L时或大于0.35 mmol/L时,扩增出来的特异性条带较少,而dNTPs的浓度在0.20~0.30 mmol/L时,扩增出来的特异性条带多,带型也基本一致。所以,比较适合的dNTPs的浓度在0.20~0.30 mmol/L之间。

图7 dNTPs浓度对ISSR-PCR反应体系的影响Fig.7 Effects of dNTPs concentration on ISSR-PCR amplif i cation system
2.4.5TaqDNA聚合酶的量对ISSR-PCR反应体系的影响
在由酶催化的反应中,酶存在的量对反应有直接影响。ISSR-PCR反应是由Taq DNA聚合酶催化的反应,当Taq DNA聚合酶用量过少时,酶与底物结合减少,降低反应效率;Taq DNA聚合酶用量过高,不但增加实验成本,而且容易产生非特异性的产物。所以应该对Taq DNA聚合酶的用量进行优化。 如图8所示,Taq DNA聚合酶在1.25~2.50 U时均能扩增出产物,但当Taq DNA聚合酶用量小于1.25 U时条带不够清晰;Taq DNA聚合酶用量在1.50~2.50 U之间时,扩增条带比较清晰,带型也基本一致,故Taq DNA聚合酶用量可以选择在1.50~2.50 U之间。
2.4.6 ISSR-PCR反应体系正交试验设计优化结果直观分析

图8 Taq DNA聚合酶的量对ISSR-PCR反应体系的影响Fig.8 Effects of amount of Taq DNA polymerase on ISSRPCR amplif i cation system
根据上文单因素实验筛选出的各因素的浓度(20 μL的ISSR-PCR反应体系)分别为:DNA模板20~50 ng,引物0.4~0.7 μmol/L,dNTPs 0.15~0.30 mmol/L,Mg2+2.0~3.5 mmol/L,Taq DNA聚合酶1.5~2.25 U。据此在5因素4水平上进行正交试验设计(见表2)对ISSR-PCR反应的最佳体系进行摸索筛选。实验结果如下图9所示。正交试验的16组中除3号组外均扩增出特异性条带,其中7、8、15组合扩增出来的条带比较清晰,特异性也很丰富,尤以组合7(DNA模板30 ng,引 物 0.7 μmol/L,dNTPs 0.25 mmol/L,Mg2+2.0 mmol/L,Taq DNA聚合酶1.75U)扩增的效果最好。
2.4.7 ISSR-PCR反应体系正交试验设计优化结果数据分析
数据统计的原则为,在琼脂糖凝胶电泳图中,条带清晰可辨的计为1,模糊不清或缺失的计为0。统计琼脂糖凝胶电泳图中每个组合扩增出的条带数,然后对所得数据进行极差分析。结果见下表5。其中,Ki(i=1、2、3、4)代表同一个因素在同一水平下的不同组合之间的总条带数,R表示同一因素在不同水平之间的极差值。极差值可以反映每个因素对体系的影响程度,值越大,表明该因素对体系的影响越大。通过表5中R值可以看出,引物的极差值最大,为3.25,说明在野生小果油茶ISSR-PCR反应体系中,引物对该体系的影响最大;dNTPS和TaqDNA 聚合酶的极差值为1.75,DNA模板和Mg2+的极差值为1.50,这4个因素对反映体系影响的差别不大。

图9 正交试验设计结果Fig.9 Results of orthogonal experimental design
对各因素的数据进行方差分析,结果见表6。实验结果表明,这5个因素对野生小果油茶ISSRPCR反应体系的影响差异均不显著,其中引物浓度对反应体系的影响最大。通过做各因素的效应曲线图(图10)可以看出,DNA模板30 ng、40 ng时对体系的效应最高,其次是50 ng,效应最低的是20 ng。dNTPs效应与DNA模板的恰好相反,低浓度和高浓度时效应较高。引物的最佳效应浓度为0.7 mmol/L。Mg2+的效应随着浓度的增加总体呈降低趋势。而Taq DNA聚合酶的浓度在1.75 U时效应最高。根据极差、方差分析,各因素效应曲线图,实际琼脂糖电泳图效果结合试验成本,确定野生小果油茶ISSR-PCR反应体系为:DNA模板为30 ng,引物浓度为0.7 μmol/L,dNTPs浓度为0.25 mmol/L,Mg2+浓度为2.0 mmol/L,Taq DNA聚合酶的量为1.75 U。
2.5 ISSR-PCR反应体系稳定性检验
利用引物UBC825对其中5份样品进行ISSRPCR扩增,结果如图11所示,通过实验优化过的ISSR-PCR反应体系稳定性强,重复性高,扩增条带分离清晰,多态性高,特异性丰富。证明正交试验设计优化的野生小果油茶ISSR-PCR反应体系稳定可靠,能够应用于后续实验研究。
3 讨 论
本研究通过对野生小果油茶ISSR-PCR反应体系中的DNA模板,引物,dNTPs浓度,Mg2+,Taq DNA聚合酶5个影响因素进行单因素试验,首先确定了5个因素适应反应体系的浓度范围,然后通过正交试验设计,确定了野生小果油茶ISSR-PCR反应的最佳体系,即在20 μL的反应体系中,DNA模板为30 ng,引物浓度为0.7 μmol/L,dNTPs浓度为0.25 mmol/L,Mg2+浓度为2.0 mmol/L,TaqDNA聚合酶的量为1.75 U。
实验表明,引物浓度对反应体系的影响最大,这主要因为PCR扩增是在引物的指导下合成的。在反应过程中,引物与Mg2+和dNTPs形成复合物[8-9],引物的浓度决定复合物解离的速度,这与王彦华等[10]利用正交设计优化不结球白菜ISSR反应体系的研究得出的结论是一致的。不同的植物进行ISSR-PCR扩增要求不同的引物,即使引物相同,浓度也会产生差异。ISSR引物的浓度太低,会出现引物的竞争,从而导致模板的某些位点不能扩增出来,出现多态性差异的假象[11],降低实验结果的可靠性。ISSR引物浓度过高时,则会出现非特异性条带,同时容易产生引物二聚体,影响目标条带的扩增[12]。不同植物的ISSR-PCR最佳反应体系差别很大,5个因素对体系的影响也存在很大差异。如彭继庆等[13]得到Mg2+是体系的主要影响因素,梁文汇等[14]得到的是Taq DNA聚合酶是影响最大的因素,而李慧慧等[15]建立的栝楼ISSR-PCR体系Taq DNA聚合酶是影响最小的因素,用量也仅需0.5 U。
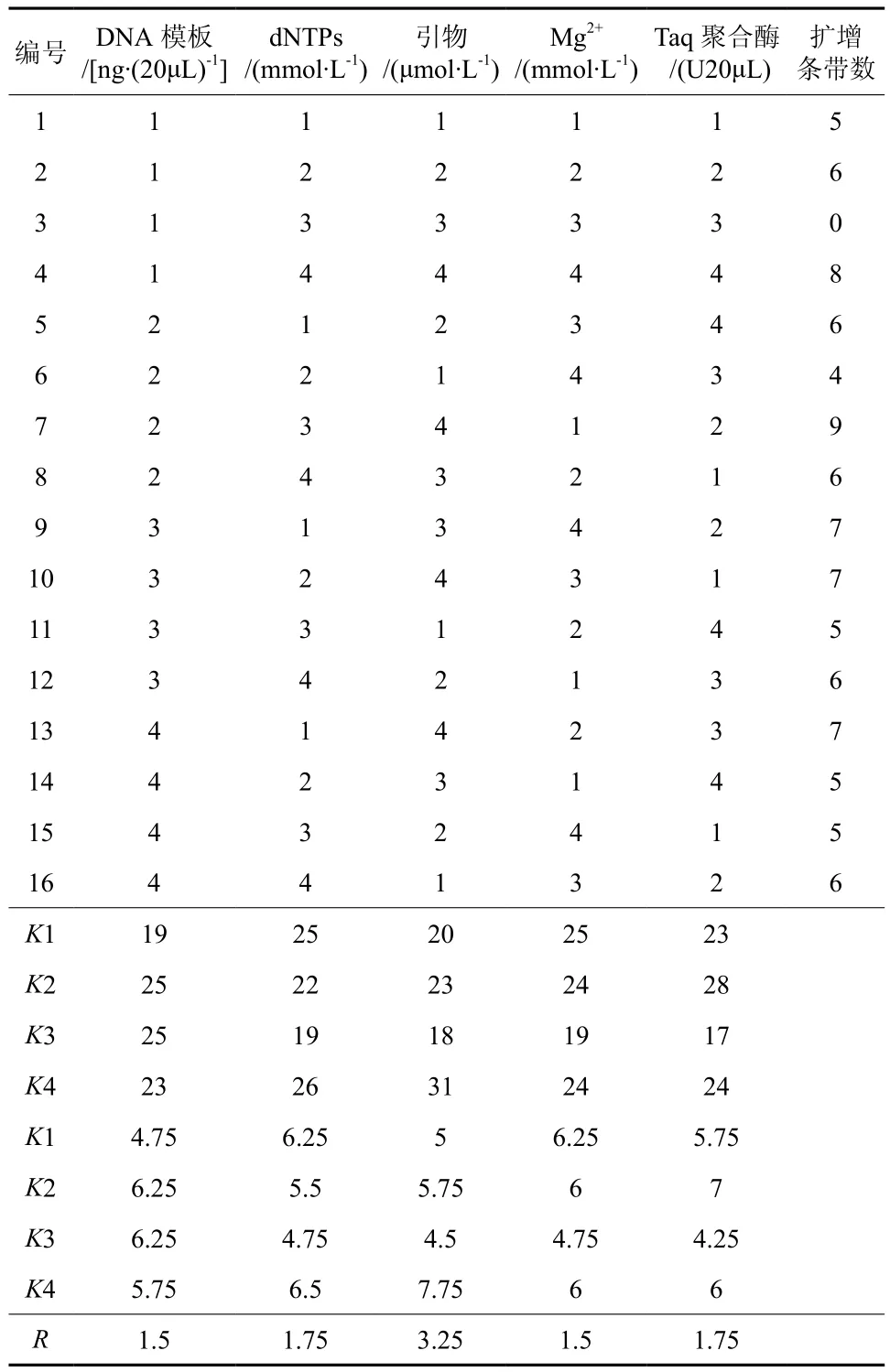
表5 正交试验设计数据分析Table 5 Data analysis of orthogonal test design

表6 正交试验设计方差分析Table 6 Variance analysis of orthogonal experimental design

图10 各因素效应曲线Fig.10 Effect curves of every factor
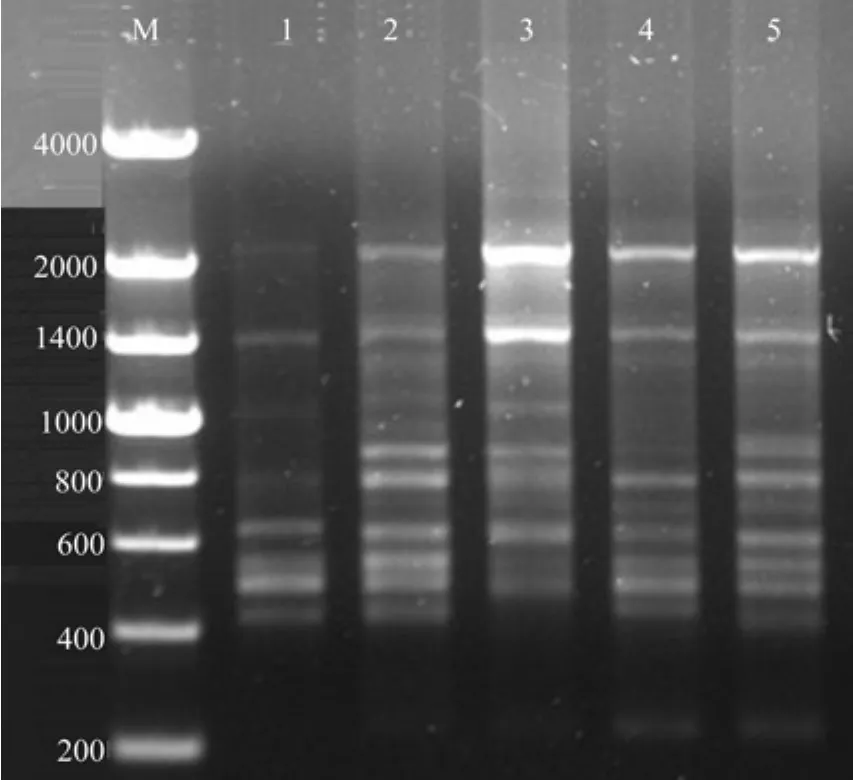
图11 5个样品对ISSR-PCR反应体系稳定性检验结果Fig.11 Inspection result of 5 samples on stability of ISSRPCR reaction system
各种植物的ISSR-PCR体系报道已有很多,但大多采用单因素实验。本试验所采用的正交试验设计具有均衡分散,综合可比,效果明确等特点[16-20],同时对实验数据进行了极差值分析,方差分析,并作出了各因素的效应曲线图,避免了直观分析人为因素影响结果的准确性。建立的ISSR-PCR反应体系具有良好的稳定性和可重复性。为以后小果油茶的遗传多样性研究,指纹图谱的构建,品种鉴定及育种提供了理论基础。
[1] 中国科学院中国植物志编辑委员会.中国植物志(第49卷,第3分卷)[M].北京:科学出版社,1998.
[2] 陈永忠.油茶优良种质资源[M].北京:中国林业出版社,2008.
[3] Zietkiewicz E, Rafalski A, Labuda D. Genome finger-printing by simple sequence repeat (SSR) anchored poly-merase chain reaction amplif i cation[J]. Genomics, 1994,20:176-183.
[4] 魏小玲,曹福祥,陈 建.海南木莲基因组DNA提取及ISSR反应体系的优化[J].中南林业科技大学学报,2010,30(5):91-96.[5] 刘本英,李友勇,唐一春,等.云南茶树资源遗传多样性与亲缘关系的ISSR分析[J].作物学报, 2010, 36(3): 391-400.
[6] 范海艳,曹福祥,彭继庆,等.博白大果油茶ISSR-PCR反应体系的建立与优化[J]. 中南林业科技大学学报,2011,31(4):97-103.
[7] 盖钧镒.实验统计方法[M].北京:中国农业出版社,2000.
[8] 王关林,方宏筠.植物基因工程原理与技术[M].北京:科学出版社,1998.
[9] 张维铭.现代分子生物学实验手册[M].北京:科学出版社,2004.
[10] 王彦华,侯喜林,徐明宇.正交设计优化不结球白菜ISSR反应体系研究[J].西北植物学报,2004,24(5):899-904.
[11] Smith J J, Scott-Craig J S, Leadbetter J R,et al.Charaeterization of random amplified Poly- morphic DNA(RAPD) products from Xanthomonas campestris and some comment on the use of RAPD in phylogenetic analysis[J]. Mol phylogenet Evol,1994,3(2): 135-145.
[12] 李开拓,赵依杰,钟凤林,等.黄皮ISSR-PCR反应体系的优化[J].中国农学通报,2009,25(19):3741.
[13] 彭继庆,曹福祥,许若娴.壳菜果ISSR-PCR反应体系的建立与优化[J].中国农学通报,2012,28(16):53-59.
[14] 梁文汇,谭健晖,黄寿先,等.大叶栎ISSR扩增体系的优化[J].安徽农业科学,2009,37(22):10424-10425.
[15] 李慧慧,朱玉球,斯金平,等.栝楼ISSR-PCR体系的正交优化[J]. 生物技术,2009,9(6):38-41.
[16] 刘颖嘉,黄 宇,荣俊冬,等.巴戟天ISSR体系的建立与优化[J]. 种子,2011,30(9):1-4.
[17] 原勤勤,文亚峰,刘儒,等.枣优良品种亲缘关系的ISSR研究[J].经济林研究,2012,30(1):56-61.
[18] 姚小华, 黄 勇, 王开良, 等. 小果油茶优良种质资源筛选与综合评价[J]. 经济林研究,2012, 30(4): 1-8.
[19] 刘海龙, 马锦林, 张日清, 等. 11份山茶属植物亲缘关系的ISSR分析[J]. 经济林研究,2012, 30(4): 87-90.
[20] 卢 莉, 张 强, 王玉花, 等. 利用正交设计优化茶树ISSR反应体系[J]. 经济林研究,2010, 28(1): 14-19.
Establishment and optimization of ISSR-PCR reaction system of Camellia meiocarpa Hu.
LI Guo-shuai, CAO Fu-xiang, PENG Ji-qing, XU Wen, HU Shuang-xi, PENG Yan-chao
(Central South University of Forestry and Technology, Changsha 410004, Hunan, China)
In order to establish a stability and repeatability reaction system of wildCamellia meiocarpa, fi ve factors, the concentration of DNA template, primers, dNTPs, Mg2+andTaqDNA polymerase, were studied by the single factor tests, orthogonal experimental design L16(45)and variance analysis, with the total DNA ofCamellia meiocarpaas an experimental material. The PCR amplif i cation reaction process was optimized. The optimal system of ISSR-PCR reaction system was established as follows: 30 ng DNA temple, 0.7 μmol/L primers, 0.25 mmol/L dNTPs, 2.0 mmol/L Mg2+, 1.75U Taq DNA polymerase were contained in 20 μL reaction system. The variance analysis shows that the effects of 5 factors on the system did not reach a signif i cant level, and of them, the primer concentration had the greatest impact on the reaction system. The established system was applied in the amplif i cations of 5 varieties of wildCamellia meiocarpaHu, and the results indicated the system had stability and repeatability.
wildCamellia meiocarpa; ISSR-PCR reaction system; single factor experiment; orthogonal experimental design
S794.4
A
1673-923X(2014)04-0036-07
2013-08-31
“生物化学与分子生物学”校级重点学科基金(066)
李国帅(1988-),男,河南安阳人,硕士研究生,从事生物化学与分子生物学研究
曹福祥(1962-),男,湖南新化人,教授,博士,博士生导师,主要从事生物化学与分子生物学研究:
E-mail:csfucao@163.com
[本文编校:吴 彬]
