油桐Tunglfy基因在花芽分化期对不同外源激素的分子响应
2014-12-29李建安
孙 颖 ,刘 儒 ,罗 敏 ,李建安
(1. 中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004;2.中国林业科学研究院 亚热带林业实验中心,江西 分宜336600)
油桐Tunglfy基因在花芽分化期对不同外源激素的分子响应
孙 颖1,刘 儒2,罗 敏1,李建安1
(1. 中南林业科技大学 经济林培育与保护省部共建教育部重点实验室,湖南 长沙 410004;2.中国林业科学研究院 亚热带林业实验中心,江西 分宜336600)
为了探索不同外源激素对油桐花芽分化过程中关键成花基因表达的影响,采用不同种类、不同浓度梯度的外源激素在未分化期进行叶片喷施处理,分析研究对油桐成花基因Tunglfy基因表达量的差异,以期为油桐花期调控的分子生物学研究提供支撑和依据。结果表明:外施6-苄基腺嘌呤对Tunglfy基因表达均有抑制作用,整个花芽分化进程中较对照都降低了Tunglfy基因表达量。不同浓度赤霉素对Tunglfy基因的表达有着不同的影响,高浓度赤霉素对Tunglfy基因的表达具有抑制作用,而低浓度则起到促进作用。脱落酸的50 mg/L和200 mg/L对Tunglfy基因的表达有较强的抑制作用,而100 mg/L对Tunglfy基因的表达均有明显的促进作用。
油桐;Tunglfy基因;外源激素;花芽分化
长期以来研究者普遍认为高等植物花芽分化与植物体内营养水平存在密切关系,而后的一系列研究结果表明,植物的内源激素也在一定程度上影响着植物成花[1-4]。有关油桐花芽分化研究已有相关报道[5-8],如李建安等人对油桐花芽分化期生理基础研究等[6]。
细胞分裂素有促进植物花芽分化作用,黄迪辉等研究表明在苹果生理分化转向形态分化期间进行摘叶试验,减少了花芽的形成[9]。内源细胞分裂素的增加可以促进苹果开花,KoshitaY等研究发现内源激素对成花的作用[10]。部分学者认为脱落酸对花芽分化具有促进作用,如钱桦等[11]发现6-苄基腺嘌呤促进石斛花芽分化作用;但部分学者并不这样认为,如王玉华等[12]在研究发现脱落酸对花芽分化具有一定的抑制作用。因此,脱落酸对花芽分化的影响目前还处于探索阶段[13]。大量研究表明赤霉素对植物成花表现抑制作用,任小林[14]等、王媛等[15]、黎维诗[16]等均在自己的研究中发现赤霉素对花芽分化具有显著抑制作用。
在成花调控途径中,LFY基因位是可见的花器官形成的“开关”基因,LFY基因表达量到达一定之后调控AP1等下游基因的表达,植物进行可见花器官的发育[17]。本文通过对油桐花芽分化期内6-苄基腺嘌呤、脱落酸、赤霉素对Tunglfy基因表达的影响的研究,进一步为油桐的花期化学调控提供依据。
1 材 料
1.1 实验材料
6月上中旬,在湖南省林科院天际岭林场,选择树体健壮、无病虫害的植株,在天气晴好的上午进行叶面喷施处理,每种激素设4个处理(包括对照),随机区组设计,单株小区,重复3次。喷施的浓度分别为,6-苄基腺嘌呤:25 mg/L、50 mg/L、100 mg/L;赤霉素:50 mg/L、100 mg/L、200 mg/L;脱落酸:25 mg/L、50 mg/L、100 mg/L;对照喷等量清水。
于7月底至9月底,每隔10天采集幼芽2~4个/次/株。采后液氮暂存带回实验室置于-80°超低温冰箱保存,以备后续试验。
1.2 实验方法
花芽分化时期划分参照《油桐LFY同源基因的克隆及花芽分化生理基础研究》[18];总RNA采用改良CTAB法提取[19],并将其提取的RNA反转录为cDNA,-20℃冰箱中保存用于后续试验。内参基因Actin引物:ActinF1:5'-GCAACTGGGATGATATGGGT-3';ActinR1:5'-AGATAGGAG -GTAATGTGCCG-3';Tunglfy基 因 引 物:LFYA1:5’-CATATGCTACTTATCCC TAACCTAC-3’;LFYS1:5’-TGACGAACCAGGT GTTTAG -GTATGC-3’。反应体系为:12.5 µL的Easy Taq Mix;正反向引物 (10 µmol)各 1.0 µL,模 板 cDNA1.0 µL,ddH2O 是 9.5µL, 总 体 积 5µL。反应条件:94℃变性3 min,94℃变性30 s,55℃退火30 s,72℃延伸90 s,27个循环,72℃延伸5 min,4℃保存[19]。采用Excel 2007和SPSS 17.0软件进行数据图表分析。
2 结果与分析
2.1 不同方法提取RNA的质量分析
样品经液氮研磨后,在传统CTAB法的基础上,分别加入含PVP-40、巯基乙醇的5%的CTAB裂解液,氯仿∶异戊醇=24∶1进行抽提,离心后取清液加入异丙醇沉淀RNA。
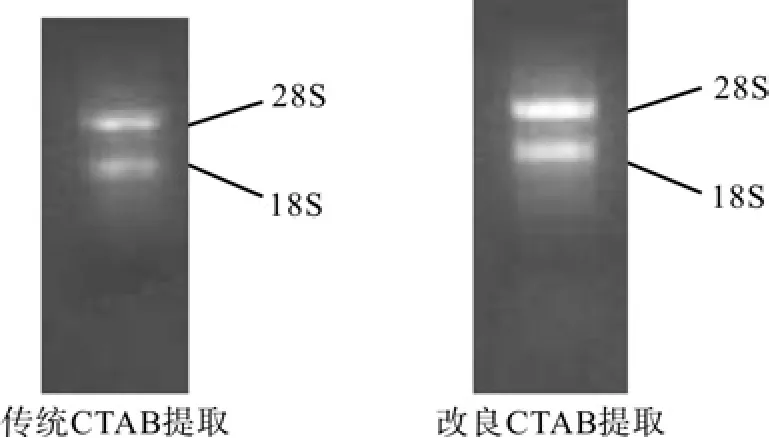
图1 不同方法的油桐总RNA提取效果比较Fig.1 Comparison of RNA extraction effects with different methods
由图1可以看出,传统CTAB法得的RNA28S与18S条带亮度淡,表明总RNA的浓度较低,获得量少; 而改良CTAB法所获得的RNA28S与18S条带清晰且二者比例接近2∶1;表明其提取效果较好。经BIO-RAD SmartSpec plus 核酸蛋白测定仪测其OD值,260/280约为1.9~2.02,提取质量符合RT-PCR扩增试验要求。
2.2 Tunglfy 基因外源激素信号的分子响应
在整个花芽分化期,油桐Tunglfy基因相对表达量呈先上升后下降的趋势,随着花芽分化的进行,在萼片原基形成期Tunglfy基因相对表达量最大为2.03,在雌蕊原基形成期Tunglfy基因相对表达量为最低值为0.25,如图2所示。
2.2.1Tunglfy基因6-苄基腺嘌呤信号的分子响应
花芽形态分化开始后,25 mg/L浓度梯度的油桐Tunglfy基因相对表达量不断降低,在花瓣原基形成期出现最低值0.17。随之相对表达量呈快速上升趋势,在雄蕊原基形成期达到整个分化时期的最大值1.18。整个花芽形态分化过程中6-苄基腺嘌呤 25 mg/L浓度处理后的Tunglfy基因相对表达量均低于对照,但在雌蕊原基形成期高于对照。可见25 mg/L浓度处理在一定程度上抑制成花关键基因Tunglfy的表达。

图2 Tunglfy基因对6-苄基腺嘌呤信号的分子应答Fig.2 Molecular response of Tunglfy gene to 6-BA
50 mg/L浓度处理下,油桐Tunglfy基因在花序分化期相对表达量达到2.08,随后Tunglfy基因相对表达量迅速下降,但花瓣原基形成期基因相对表达量开始上升。在整个花芽形态分化期间,50 mg/L处理也使Tunglfy基因的表达高峰提前到花序分化期,同时油桐Tunglfy基因相对表达量均低于对照,但在雌蕊原基形成期高于对照。可知50 mg/L处理对Tunglfy基因的表达具有一定的抑制作用。
雌蕊原基形成期100 mg/L浓度处理后的油桐Tunglfy基因达到表达最大值为1.57。随后Tunglfy基因相对表达量开始迅速下降,在萼片原基形成期达到最低值。之后Tunglfy相对表达量逐渐增强的趋势。整个分化阶段内100 mg/L浓度处理处理油桐Tunglfy表达量与对照比较均低于对照,但在雌蕊原基形成期高于对照。由此看见100 mg/L对Tunglfy基因的表达具有一定的抑制作用且延迟了Tunglfy基因的表达表达高峰期到花芽分化中雌蕊原基形成阶段。
2.2.2Tunglfy基因脱落酸信号的分子响应
在油桐花芽花序分化开始后,喷施50 mg/L脱落酸的花芽中Tunglfy基因表达量开始缓慢上升,在雄蕊原基分化期时达到1.36,在整个形态分化期中为最大值。在雄蕊分化期后一直处于下降的趋势。与对照比较发现,在形态分化期间,50 mg/L处理的油桐花芽中Tunglfy基因表达量均低于对照,说明该浓度对油桐Tunglfy基因的表达具有抑制作用。

图3 Tunglfy基因对脱落酸信号的分子应答Fig.3 Molecular response of Tunglfy gene to abscisic acid
脱落酸100 mg/L处理的Tunglfy基因在花序分化期至萼片原基分化期的表达量变化差异较小,在花瓣原基分化期迅速攀升至最大值2.21而超过对照处理。花萼原基分化期至花瓣原基分化期,Tunglfy基因的表达量开始下降,与对照基本吻合。随后,基因表达量再次上升,雄蕊原基分化期后变化平稳,表达量水平高于对照。从花萼分化期开始,脱落酸100 mg/L处理的Tunglfy基因表达量都处在高于对照的水平,说明脱落酸100 mg/L处理对油桐Tunglfy基因的表达具有促进作用。
脱落酸100 mg/L处理的Tunglfy基因表达量呈现于对照相反的趋势,从花序原基分化期开始,基因表达量开始上升,在花萼原基分化期达到第一个峰值,随后开始下降,在花瓣原基分化期下降到最低值。从花瓣原基分化期至雄蕊原基分化期逐渐上升,在雄蕊原基分化期后,保持平稳表达水平。在分化过程中,Tunglfy基因表达处于较低的水平,说明脱落酸200 mg/L处理对油桐Tunglfy基因的表达具有抑制作用。
脱落酸3个浓度梯度对油桐Tunglfy基因表达的影响分析,脱落酸对油桐Tunglfy基因表达的促进作用还是抑制作用是与脱落酸浓度存在一定关联,本研究中高浓度(200 mg/L)或低浓度(50 mg/L)脱落酸处理均对Tunglfy基因的表达起到抑制作用。
2.2.3Tunglfy基因赤霉素信号的分子响应
在花序分化期至雄蕊原基分化期,赤霉素50 mg/L和100 mg/L处理对油桐Tunglfy基因表达的影响基本一致,从花序分化期开始迅速上升,并在花萼原基分化期时达到最大值。与对照比较发现,油桐Tunglfy基因表达高峰期提前。花萼原基分化期后基因表达量迅速下降,在花瓣原基分化期达到最小值,在此之后,50 mg/L处理在雄蕊原基分化期达到第二峰值,随后开始下降。
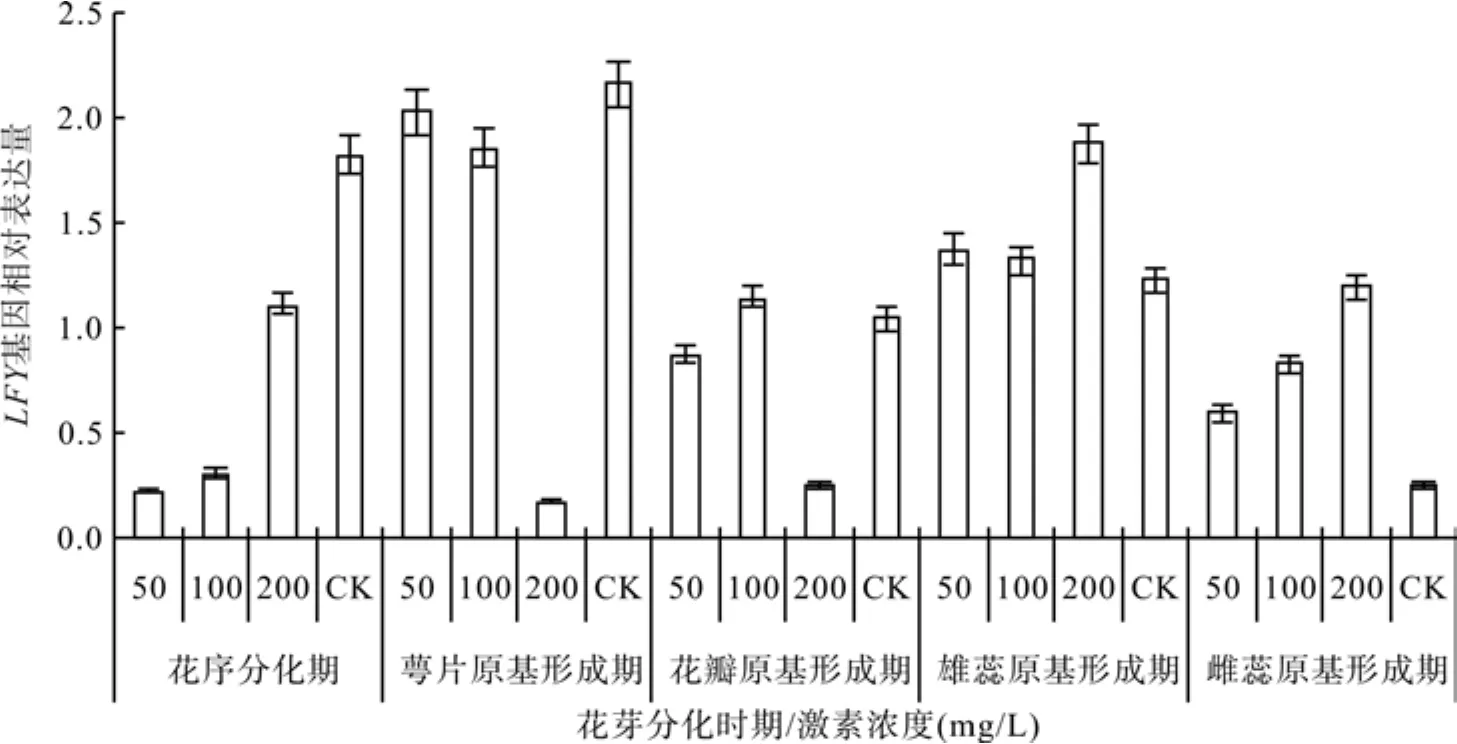
图4 Tunglfy基因对赤霉素信号的分子应答Fig.4 Molecular response of Tunglfy gene to gibberellic acid
赤霉素200 mg/L处理对Tunglfy基因表达的影响则表现出不同的变化趋势。赤霉素200 mg/L处理下Tunglfy基因表达量最大值出现在雄蕊分化期,晚于对照,说明200 mg/L处理具有推迟开花的作用。
总之,50 mg/L和100 mg/L的赤霉素、100 mg/L的脱落酸均有使Tunglfy基因表达量最大值提前,进而在不同程度上促进油桐花芽分化作用;6-苄基腺嘌呤的3个浓度、200 mg/L的赤霉素、50 mg/L、200 mg/L的脱落酸喷施后有不同程度的抑制作用。
3 结论与讨论
本实验材料油桐花芽含有较多的次生代谢物尤其是多糖、多酚,而酚类物质可RNA纯度,多糖形成难溶物质而不利于RNA分离。传统CTAB法的材料研磨、裂解后上清液上有粘稠液体覆盖,可能是多糖和多酚物质未去除干净,从而影响RNA提取质量。经电泳检测,28S上方有明显拖带,多糖等有机物仍有残留,而且RNA的OD260/OD280小于1.3,无法满足半定量RT-PCR的要求。而本文在传统CTAB法的基础上,分别加入含PVP-40、巯基乙醇的5%的CTAB裂解液,氯仿∶异戊醇=24∶1进行抽提,离心后取清液加入异丙醇沉淀RNA。能够有效的去除多糖等大分子有机物,经电泳检测多糖等物质残留较少,可以满足半定量的要求。
植物细胞分裂素对成花有促进作用,整个成花阶段中花芽形态分化期,体内的细胞分裂素水平达到最高。相关研究表明6-苄基腺嘌呤的浓度在400 mg/L能有效提前石斛的花芽分化时间[16],与本论文中研究50 mg/L结论相同。但也有研究表明在非诱导短日下细胞分裂素抑制它的开花[17]。这可能是因为6-苄基腺嘌呤对成花影响与植物种类、立地条件等有关系。脱落酸在花芽分化中起着不同的作用,即一些植物中有效的促进花芽分化还有一些植物中抑制花芽分化。本研究结果表明,脱落酸对油桐花芽分化的促进和抑制作用是表现在不同浓度上的,其中100 mg/L是促进作用而其他两个浓度则表现抑制作用。大量研究表明赤霉素对植物成花具有抑制作用。本文中200 mg/L的赤霉素处理的研究结果一致,但50 mg/L、100 mg/L处理则使Tunglfy基因表达高峰提前,促进提前开花,这与王媛等[15]研究结果基本相同。由此可见,赤霉素对植物成花时间影响还需要进一步研究。本论文仅对3种激素的各自影响,在生产实践中可能是两种或者多种激素混合喷施,因此不同激素种类组合、不同浓度激素组合等交互作用及其作用机理还有待进一步研究。
[1] 李建安,孙 颖. 林木成花分子基础研究进展[J].经济林研究,2007,25(2):66-70.
[2] 孙 颖,卢彭显,李建安.中国油桐栽培利用与应用基础研究进展[J].经济林研究2007,25(2):84-87.
[3] 胡芳名,刘丽娜,李建安,等. 拟南芥FLC基因抑制成花机理研究进展[J].经济林研究,2007, 25(4):77-81.
[4] Bernier G. Havelange A,et al.1993.physiological signals that induce fowering[J]. Plant Cell.2007,5:1147-1155.
[5] 李建安,孙 颖,陈鸿鹏,等.油桐LEAFY同源基因片段的克隆与分析[J].中南林业科技大学学报,2008,28(4):21-26.
[6] 李建安,孙 颖,郜爱玲,等.油桐花芽分化期营养与激素生理变化研究[J].中南林业科技大学学报,2011,31(3):34-38.
[7] 郭文丹,李建安,刘丽娜,等.油桐花芽分化期内源激素含量的变化[J].经济林研究,2009, 27(2): 31-34.
[8] 郜爱玲,李建安,刘 儒,等.高等植物花芽分化机理研究进展[J].经济林研究,2010, 28(2): 131-138.
[9] 黄迪辉,黄辉白.柑橘成花机理的研究与内源激素的关系[J].果树科学, 1992,9(1):13-18.
[10] KoshitaY, TakaharaT, OgataTetal. Involvement of endogenous plant hormones (IAA, ABA, GAs) in leaves and flower bud formation of satsum a mandarin (Citrus unshiu Marc.)[J].SciHortic, 1999,79: 185-194.
[11] 钱 桦,刘 燕,郑勇平,等.施用-6-BA对春石斛花芽分化及内源激素的影响[J].北京林业大学学报,2009,31(6):21-31.
[12] 王玉华,范崇辉,沈 向,等.大樱桃花芽分化期内源激素含量的变化[J]. 西北农业学报, 2002, 11(1): 64-67.
[13] 徐平珍,刘 涛,杨 莹,等.脱落酸在植物花发育过程中的作用[J].云南植物研究,2007, 29( 2): 215-222.
[14] 任小林,李海峰,弓德强,等.秋施乙烯利和赤霉素对牡丹萌芽及开花的影响[J].西北植物学报, 2004, 24(5): 895-898.
[15] 王 媛,崔雁汇,孔一昌,等.不同浓度赤霉素对地被菊‘紫重楼’开花特性的影响[J].中国农学通报,2012,28(19):164-167.
[16] 黎维诗,柯海丽,邓小果,等. 6-BA 和GA3处理对春石斛催花的影响[J].热带作物学报,2011, 32(6):1016-1019.
[17] MarkarovAM, 2002. Causes of flowering of long-day potato species under short-day and cold-night conditions [J]. Russian JPlant Physiol,49: 465-469.
[18] 孙 颖.油桐Tunglfy同源基因克隆与生理基础研究[D]. 长沙:中南林业科技大学, 2008.
[19] 刘 儒.油桐花芽分化期外源激素对Tunglfy表达特性及光合作用的影响[D]. 长沙: 中南林业科技大学, 2010.
Molecular response ofTunglfygene to exogenous hormones in fl ower buds differentiation period
SUN Ying1, LIU Ru2, LUO Min1, LI Jian-an1
(1.The Key Lab of Cultivation and Protection for Non-wood Forest Tree of Education Ministry , Central South University of Forestry and Technology ,Changsha 410004, Hunan, China; 2. Experimental Centre of Subtropical Forestry of CAF, Fenyi 336600, Jiangxi, China)
In order to explore different exogenous hormones on key flowering genes expression inAleurites fordiiflower bud differentiation process, the leaves spraying treatments were conducted by adopting exogenous hormones with different types and concentrations in the undifferentiated stage, and the differences of exogenous hormones on fl owering genes expression levels ofTunglfygenes were investigated, thus providing support and basis for molecular biology research of control the fl owering phase. The results show that the applying 6-benzyladenine to the buds had inhibitory action onTunglfygene expression, in the entire process of fl ower bud differentiation, the treated lowered down more the amount ofTunglfygene expression than the control; There were differences among different concentrations of gibberellic acid onTunglfygene expressions, the high concentrations of gibberellic acid onTunglfyhad inhibitory effect toTunglfygene expression, while the low concentrations played a facilitating role. The treatments with abscisic acid of 50 mg/L and 200 mg/L had strong inhibition toTunglfygene expression, and 100 mg/L forTunglfygene expression had obvious promoting role.
Vernicia fordii;Tunglfygene; exogenous hormones; fl ower bus differentiation
S794.3
A
1673-923X(2014)04-0025-05
2013-11-12
国家林业局行业公益性专项基金“红壤丘陵区经济林生态经营关键技术研究”(201104052);湖南省研究生创新基金“赤霉素对油桐成花调控”(CX2012B320)
孙 颖(1983-),女,辽宁铁岭人,博士研究生,研究方向:主要从事经济林培育研究
李建安(1964-),男,湖南茶陵人,教授,博导,研究方向:主要从事经济林培育研究;E-mail:lja0731@126.com
[本文编校:吴 彬]
