采用乳杆菌发酵提高黄帝椒加工品质*
2014-12-25刘世源宗红陆信曜诸葛斌方慧英孙进楼笑笑冯倩
刘世源,宗红,陆信曜,诸葛斌,方慧英,孙进,楼笑笑,冯倩
1(江南大学工业生物技术教育部重点实验室,生物工程学院,工业微生物研究室,江苏无锡,214122)
2(浙江正味食品有限公司,浙江省调味食品制造工程技术研究中心,浙江义乌,322000)
黄帝椒(Capsicum chinense)又名黄灯笼椒、黄辣椒,是海南特有的辣椒品种,形状似灯笼,色泽金黄,肉质较厚,辣度极高。黄帝椒具有很好的营养保健功能:其高含量的辣椒素类物质可增强食欲,改善血液循环,具有抗癌、降血压和减肥等作用[1];其丰富的抗氧化物质如维生素C、谷胱甘肽、总多酚等可清理体内多余的自由基和重金属等有害物质,具有抗衰老和预防癌症的作用[2]。因新鲜黄帝椒不易保鲜且辣度高,在海南省主要做成黄帝椒酱。黄帝椒酱具有浓郁鲜美的香味,深受嗜辣人群的喜爱。
乳酸菌是发酵糖类主要产物为乳酸的一类无芽孢、革兰氏染色阳性细菌。近年来,有很多关于接种乳酸菌发酵蔬菜的报道。研究表明,乳酸菌不仅能丰富食品的风味,而且能提高其品质和营养保健功能,具有抗肿瘤、降低胆固醇和提高免疫力等重要生物学功能[3]。
目前传统黄帝椒酱的制作方法是自然腌制,其加工工艺粗放而且会产生危害人体健康的亚硝酸盐。本研究室在采用PCR-DGGE技术对部分黄帝椒产品中的微生物进行分离及鉴定的基础之上[4],利用所筛选的乳杆菌加工黄帝椒,开发出了一套乳杆菌发酵黄帝椒酱的生物加工工艺。为考察乳杆菌加工对黄帝椒酱品质的影响,本文对乳杆菌发酵黄帝椒酱的亚硝酸盐、抗氧化物质及活性、有机酸和氨基酸等进行了分析,为黄帝椒生物加工产品品质的提高打下基础,同时为其他椒类的功能化生物加工提供借鉴。
1 材料与方法
1.1 材料与器材
新鲜黄帝椒“热辣2号”杂交种,产地海南陵水;
Lactobacillus plantarum E2,Lactobacillus plantarum M1和Lactobacillus brevis M2由本研究中心筛选保藏。
主要试剂:盐酸荼乙二胺、对氨基苯磺酸、亚硝酸钠、3,5-二硝基水杨酸、焦性没食子酸、酒石酸亚铁、Na2HPO4、KH2PO4、DPPH、铁氰化钾、三氯乙酸、水杨酸、FeSO4·7H2O、邻苯三酚、PITC、醋酸钠均为分析纯,甲醇、乙腈为色谱纯。
MRS培养基(g/L)配方:牛肉膏 10,蛋白胨 10,酵母粉 5,K2HPO42,柠檬酸铵 2,乙酸钠 5,葡萄糖20,吐温 80 1 mL,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,pH6.2~6.4,固体培养基加20 g琼脂。
MP5002电子天平,上海天平仪器厂;立式高压蒸汽灭菌锅,上海博讯实业有限公司;生化培养箱,上海一恒科学仪器有限公司;WK-200B高速组织粉碎机,青州市精诚机械有限公司;可见光分光光度计WFJ7200 Unic,上海仪器有限公司;高效液相色谱仪,美国戴安公司。
1.2 实验方法
1.2.1 发酵菌液的制备
分别将菌种L.plantarum E2,L.plantarum M1和L.brevis M2接种于固体MRS培养基活化,然后转接于液体MRS培养基,37℃静置培养12~20 h,离心,用生理盐水洗涤并调整菌浓为109CFU/mL,作为发酵菌液。
1.2.2 黄帝椒酱的加工工艺
新鲜黄帝椒清洗后沥干水分,切成0.5 mm×0.5 mm左右的丁状,加20%水,分别接入等量的3%发酵菌液(样品A接菌:L.plantarum E2、L.plantarum M1和L.brevis M2三菌等比例混合,样品 B接菌:L.plantarum E2和 L.plantarum M1两菌等比例混合)。混匀后装坛,密封,置于25℃发酵24h。发酵结束后,加入12%的食盐,混匀,PE瓶包装,置于30℃贮藏。10 d后取样测定,每个处理做3个重复。其中,不接菌的自然腌制样品作为空白对照。
1.2.3 测定方法
亚硝酸盐的测定:采用盐酸荼乙二胺法测定,方法参考GB 5009.33-2010。
总多酚含量的测定:采用Folin-Ciocalteu比色法测定[5]。
抗氧化活性的测定:清除DPPH·和铁还原能力的测定方法参考文献[6],清除超氧阴离子(O2-·)能力和在水杨酸体系中清除羟基自由基(·OH)能力的测定方法参考文献[7]。
有机酸的测定:采用高效液相色谱法[8]。
氨基酸和还原型谷胱甘肽的测定:采用高效液相色谱法测定[9]。
2 结果与讨论
2.1 乳杆菌对黄帝椒酱亚硝酸盐的降解
腌制食品中会产生一定量的亚硝酸盐,亚硝酸盐具有一定毒性且是强致癌物质。对不同黄帝椒酱样品中的亚硝酸盐含量变化测定结果如图1。

图1 不同黄帝椒酱样品亚硝酸盐含量的变化Fig.1 Changes of nitrite in different samples of Capsicum chinense sauce
由图1可见,自然腌制样品的亚硝酸盐含量在第4 d达到最高,为2.86 mg/kg,之后开始下降。黄帝椒经乳杆菌发酵后,其亚硝酸盐含量显著降低。在第10天,样品A和B的亚硝酸盐含量均降到0.2 mg/kg以下,与自然腌制样品相比,分别降低了93.3%、91.2%,亚硝酸盐基本被消除。乳酸菌发酵产生大量乳酸,使环境pH迅速降低,在H+的作用下NO2-被还原,同时,低 pH可抑制硝酸盐还原菌的生长[10]。由此可见,所用乳杆菌均有很强的亚硝酸盐降解能力。
2.2 乳杆菌加工黄帝椒酱抗氧化活性及抗氧化成分分析
2.2.1 乳杆菌加工黄帝椒酱抗氧化活性的分析
清除DPPH·、O2-·、·OH的能力和对铁的还原能力是衡量物质抗氧化活性的常用指标。对不同黄帝椒酱样品进行抗氧化活性的测定,结果见图2。
由图2黄帝椒酱的抗氧化活性指标可以看出,与自然腌制样品相比,样品A的清除DPPH·、清除O2
-·、清除·OH的能力和对铁的还原能力分别提高了约59.2%、55.3%、53.7%和82.1%,略高于样品B的抗氧化活性。乳酸菌具有抗氧化活性,其抗氧化机理包括乳酸菌的还原活性、活性氧的清除等[11]。乳杆菌发酵黄帝椒会产生一些抗氧化活性物质,从而提高了黄帝椒酱的抗氧化活性。
2.2.2 抗氧化成分总多酚和还原型谷胱甘肽含量的分析
植物多酚包括单宁类、酚酸类和黄酮类等[12],具有重要的抗氧化作用,可清理体内多余的自由基,抗衰老和预防癌症的发生[2]。对不同黄帝椒酱样品中总多酚进行测定,结果见图3。
由图3可知,与自然腌制样品相比,样品A和样品B的总多酚含量分别提高了59.7%和51.3%。乳酸菌在利用黄帝椒发酵的过程中,代谢途径可能涉及到合成多酚类的醋酸-柠檬酸及莽草酸复合途径[12],在产生有机酸的同时也产生了多酚类物质。这与王秀娟等人在利用乳酸菌发酵绿茶的研究中提高了茶多酚含量的结果相一致[13]。另外,乳酸菌发酵产酸,降低了环境 pH,抑制了黄帝椒多酚氧化酶的活性[14],从而抑制了多酚类物质的氧化。因此,乳杆菌提高了黄帝椒酱中的抗氧化成分总多酚的含量。
还原型谷胱甘肽(GSH)是由谷氨酸、半胱氨酸和甘氨酸经肽键缩合而成的三肽,具有多种生理保健作用,如抗氧化、增强免疫力、延缓衰老、整合解毒和抗肿瘤等作用。此外,GSH在与脱氨酸、L-谷氨酸钠等物质共存并发生反应的情况下,能够产生特有的风
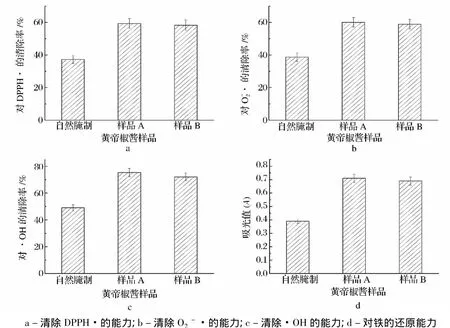
图2 不同黄帝椒酱样品的抗氧化活性的分析Fig.2 Analysis of antioxidant capacity in different samples of Capsicum chinense sauce
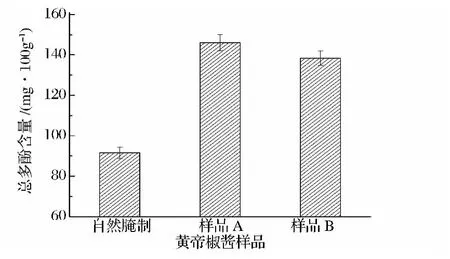
图3 不同黄帝椒酱样品总多酚含量的分析Fig.3 Analysis of total polyphenolin different samples of Capsicum chinense sauce
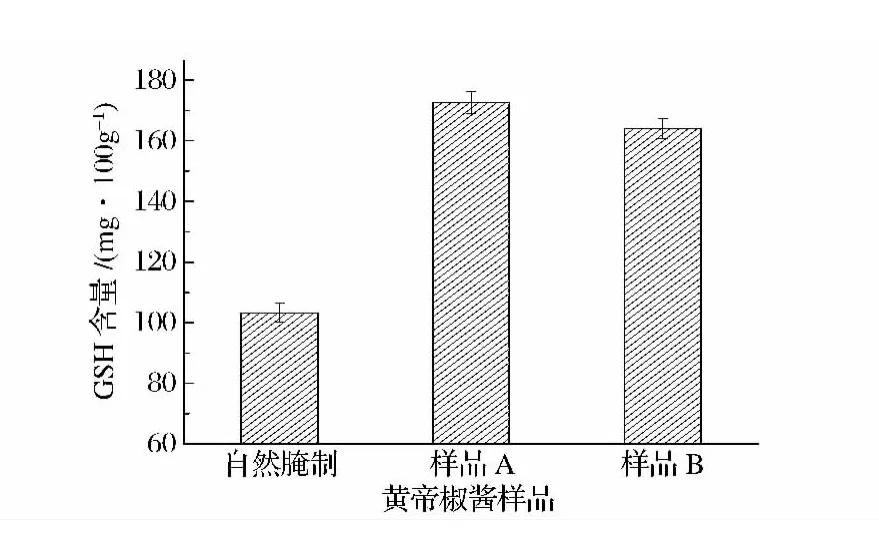
图4 不同黄帝椒酱样品GSH含量的分析Fig.4 Analysis of GSH in different samples of Capsicum chinense sauce
味物质,提高产品的风味。利用高效液相色谱对不同 黄帝椒酱样品中的GSH进行测定,结果见图4。GSH含量分别提高了67.1%、58.8%。在发酵黄帝椒的过程中,乳杆菌利用自身复杂的蛋白酶系分解蛋白质产生各种氨基酸,其中的谷氨酸、半胱氨酸和甘氨酸等经一系列代谢和谷胱甘肽还原酶的作用下生成GSH[15-17]。由此可见,乳杆菌可显著提高黄帝椒酱中的抗氧化成分还原型谷胱甘肽的含量。
2.3 乳杆菌加工黄帝椒酱有机酸含量的分析
利用高效液相色谱对不同黄帝椒酱样品中的有机酸进行分析,结果如图5。

图5 不同黄帝椒酱样品有机酸含量的分析Fig.5 Analysis of organic acids in different samples of Capsicum chinense sauce
由图5可以看出,与自然腌制样品相比,接种乳杆菌的两样品中苹果酸、琥珀酸、丙酸含量稍有增加,乳酸、乙酸含量增加显著,其中乳酸含量分别提高了1.9、2.5倍。与样品B相比,样品A中的乳酸较少,乙酸较多。可能是由于样品 B的发酵菌种L.plantarum E2和M1通过EMP途径进行同型乳酸发酵,代谢产物主要为乳酸;而样品A中的L.brevis M2通过PK、HK途径进行异型乳酸发酵,除产生乳酸外,还产生乙酸、乙醇和CO2等[18]。因此,在接等量菌种的情况下,样品B中乳酸含量稍高于样品A。由此可见,乳杆菌使黄帝椒酱中的有机酸含量增加,这不仅丰富了产品的风味而且增强了其生理保健作用。
2.4 乳杆菌加工黄帝椒酱氨基酸含量分析
2.4.1 γ-氨基丁酸含量变化分析
γ-氨基丁酸(GABA)是一种抑制性神经递质,它参与多种代谢活动,具有很高的生理活性,如抗焦虑,抗衰老,降血压,改善睡眠,调节激素分泌及神经营养等[19]。对黄帝椒酱样品中的γ-氨基丁酸的测定结果见图6。
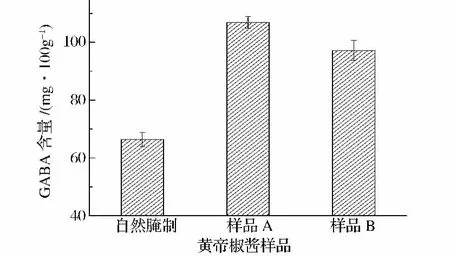
图6 不同黄帝椒酱样品GABA含量的分析Fig.6 Analysis of GABA in different samples of Capsicum chinense sauce
由图6看出,与自然腌制样品相比,样品A和样品B的GABA含量分别提高了69.7%和54.2%。发酵样品的GABA含量提高可能是因为乳酸菌在发酵过程中利用糖类发酵产酸,造成较低的pH环境,谷氨酸脱羧酶的活性在低pH下(<5.5)得到激发,催化谷氨酸脱羧生成γ-氨基丁酸[20]。由此可见,乳杆菌发酵提高了黄帝椒酱的GABA含量,使黄帝椒酱具有很高的生理保健功能。
2.4.2 其他氨基酸含量变化分析
氨基酸不仅是食品中的主要风味物质,而且是人体重要的生理活性物质,利用高效液相色谱对不同黄帝椒酱样品中的氨基酸进行分析,结果如图7。
由图7可以看出,与自然腌制样品相比,两发酵样品中的氨基酸含量均有不同程度的提高。其中具有保护心肌、增强肝脏功能和消除疲劳作用的天门冬氨酸(Asp)含量提高了2倍以上,人体必需的色氨酸(Trp)含量提高了1倍以上;呈鲜味的谷氨酸(Glu)含量提高了1倍左右。可见,乳杆菌加工提高了黄帝椒酱中的氨基酸含量,在丰富产品风味的同时又增强了产品的营养保健功能。
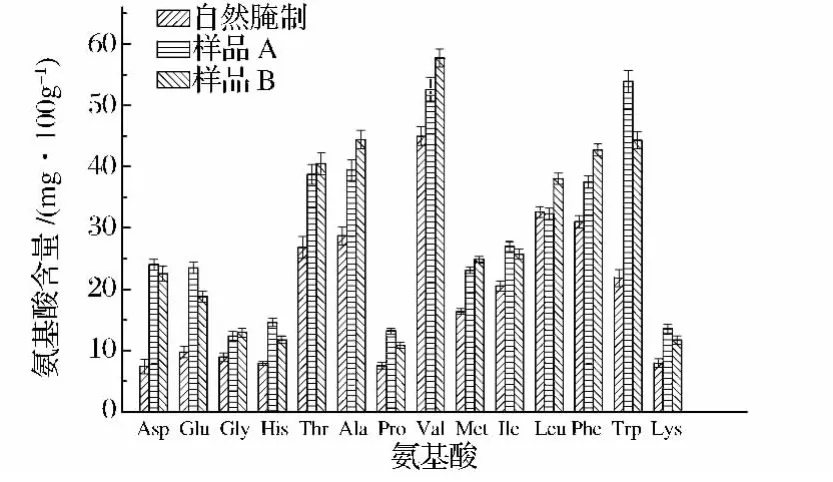
图7 不同黄帝椒酱样品的氨基酸含量的分析Fig.7 Analysis of amino acids in different samples of Capsicum chinense sauce
3 结论
本文对黄帝椒酱的亚硝酸盐、抗氧化活性及成分、有机酸和氨基酸进行了对比分析。研究发现,与自然腌制样品相比,乳杆菌发酵黄帝椒酱样品中的亚硝酸盐基本被消除,抗氧化活性提高了54% ~82%,总多酚、还原型谷胱甘肽(GSH)的含量分别提高了51%、59%以上;主要风味物质有机酸,特别是乳酸含量提高了2倍;具有呈味作用和生理活性功能的氨基酸含量均有所提高,其中γ-氨基丁酸(GABA)提高了54%以上,天门冬氨酸(Asp)和色氨酸(Trp)分别提高了2倍和1倍以上,鲜味氨基酸谷氨酸(Glu)提高了1倍左右。同时发现,两种不同接菌组合的样品A和样品B的相关指标无明显差异。结果表明,乳杆菌发酵不仅防止了黄帝椒酱的褐变、软化[14],还提高了黄帝椒酱的风味、增强了其营养保健功能,为开发高品质且具有营养保健功能的黄帝椒制品提供了依据。
[1] 刘向前,冯爱国,李春艳.辣椒营养成分开发利用研究进展[J].农业工程,2013,3(1):48 -52.
[2] 左丽丽,王振宇,樊梓鸾,等.植物多酚类物质及其功能研究进展[J].中国林副特产,2012(5):39-43.
[3] 马利华,秦卫东.乳酸菌发酵对牛蒡营养及抗氧化性的影响[J].粮油加工,2009(7):117-119.
[4] 李汉文,诸葛斌,方慧英,等.利用PCR-DGGE技术筛选分离海南黄帝椒产品微生物[J].食品与发酵工业,2012,38(3):38-42.
[5] 尹文清,宋鑫明,陈光英,等.青梅叶中多酚含量测定及抗氧化活性研究[J].食品科技,2009,34(5):283 -286.
[6] 武晋海,王昌禄,王玉荣,等.发酵方式对蔬菜质构和抗氧化性的影响[J].食品与发酵工业,2007,33(12):26-27.
[7] 张冬梅,李苹苹.萝卜泡菜抗氧化活性的研究[J].中国调味品,2012,37(9):29 -32.
[8] 贾洪锋,贺稚非,李洪军,等.高效液相色谱法测定发酵辣椒中的有机酸[J].食品科学,2008,29(3):374-376.
[9] 吕艳,冯凤琴.反相高效液相色谱定量分析多肽中的氨基酸组成[J].浙江农业科学,2005,29(3):374-379.
[10] 袁亚,池金颖,黄丹丹,等.人工接种乳酸菌对泡菜感官品质和亚硝酸盐含量的影响[J].食品工业科技,2012,33(7):119 -123.
[11] Lin Meei-Yn,Yen Chyuan-Liang.Antioxidative ability of lactic acid [J].Journal of Agricultural and Food Chemistry,1999,47:1 460-1 466.
[12] 肖正华.大叶白蜡树种子中植物多酚及色素的研究[D].乌鲁木齐:新疆大学,2007:18-19.
[13] 王秀娟,鲁丹,王玉华.不同菌种发酵绿茶对其茶多酚及咖啡碱含量影响的研究[J].食品工业科技,2010,31(17):200-203.
[14] 李汉文.海南黄帝椒的微生物分析及生物加工技术研究[D].无锡:江南大学,2012:39-40.
[15] 刘天祎,潘道东.抗氧化活性乳酸菌的筛选[J].食品科学,2011,32(19):125 -129.
[16] Kullisaar T, ZilmerM.Two antioxidative lactobacilli strains as promising probiotics[J].International Journal of Food Microbiolog,2002,72:215 -224.
[17] Talwalker A,KailasapqthyK,Hourigan J,et al.An improved method for the determination of NADH oxidase in the presence of NADH peroxidase in lactic acid bacteria[J].Journal of Microbio Methods,2003,52(3):333 -339.
[18] 杨生玉.微生物生理学[M].北京:化学工业出版社,2007:76-77.
[19] 周青,魏春,应向贤,等.产γ-氨基丁酸乳酸菌的筛选及发酵过程研究[J].食品与发酵工业,2011,37(5):25-28.
[20] Takeshi Higuehi,Hisanobu Hayashil,Keietsu Abe.Exchange of glutamate and γ-aminobutyricacid inalactobacill strain[J].Journal of Bacteriology,1997,179(10):3 362-3 363.
