两阶段搅拌转速控制策略发酵生产柠檬酸
2014-12-25李佳伟李江华堵国成孙福新
李佳伟 , 刘 龙 , 李江华 *, 堵国成 ,2, 陈 坚 ,2, 孙福新
(1.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.宜兴协联生物化学有限公司,江苏 宜兴 214203)
柠檬酸是三羧酸循环的中间代谢产物,由于它在食品(70%)、药物和化妆品(12%)以及其它工业(18%)中的广泛应用,使得柠檬酸成为最具商业潜力的发酵产品之一,柠檬酸的产量逐年递增[1]。采用黑曲霉柠檬酸产生菌进行深层液体发酵,已成为当今世界柠檬酸生产的主流技术,柠檬酸发酵成为好气发酵的典型之一[2]。
目前,在国内外文献报道中,关于柠檬酸发酵的研究主要包括低值原料的开发[3]、培养基研究[4]、浅层发酵的研究[5]、菌体形态的影响[6-7]、菌种诱变的研究[8-9]、菌体固定化的研究[10]以及溶氧条件对发酵过程的影响[10-12]。黑曲霉发酵生产柠檬酸的过程是一个好氧过程,供氧水平对柠檬酸产量有至关重要的作用。文献报道的溶氧水平优化大部分是对通气量的研究,对搅拌转速的影响的研究很少。作者以可溶玉米浆与玉米清液作为培养基,研究了搅拌转速关联溶氧水平优化黑曲霉发酵柠檬酸生产工艺,考察了发酵过程中菌体量、产物、培养基残糖等的变化情况,并在搅拌转速优化的基础上进行了分批补料发酵的研究。
1 材料与方法
1.1 菌种
柠檬酸生产菌黑曲霉 CCTCC M2013172:由作者所在实验室提供。
1.2 培养基
1.2.1 斜面培养基 (PDA培养基) 称取已去皮的马铃薯200 g,加水500 mL,煮沸30 min,四层纱布过滤,再加葡萄糖20 g和琼脂20 g,溶解定容至1 000 mL,趁热分装克氏瓶,每瓶50 mL左右,121℃灭菌20 min后取出,搁置成斜面。
1.2.2 发酵种子培养基 玉米清液,玉米浆,调节总糖10 g/dL,总氮0.2 g/dL。
1.2.3 发酵培养基 玉米清液,玉米浆,调节总糖
15 g/dL,总氮 0.08 g/dL。
1.3 培养条件
1.3.1 菌种活化及保藏 保藏的菌种转接于克氏瓶斜面上,37℃恒温箱倒置培养7 d,置于4℃冰箱保藏,一个月转接一次。
1.3.2 种子培养 PDA斜面(麸曲)培养一周,用无菌水洗下孢子,用玻璃珠打散,用血球计数板计数,以30万/mL的接种体积分数接入种子摇瓶培养基中,35℃、300 r/min摇床培养 24 h。
1.3.3 发酵条件 以10%的接种体积分数接入种子液,控制一定发酵条件,培养至还原糖低于0.5%发酵结束。
1.4 检测方法
1.4.1 菌浓检测方法 菌体干湿重测定:均匀取50 g培养液,用一层绢纱过滤至500 mL烧杯中,用洗瓶冲洗,冲洗量约200 mL左右,冲洗时边冲洗边用玻璃棒搅拌,之后将过滤到烧杯中的菌液通过高速离心机离心,或用滤纸抽滤后称湿重,然后于105℃烘箱烘干后称干重。
1.4.2 产酸测定方法 发酵液过滤取上清液1 mL,用0.142 9 mol/L的NaOH滴定(酚酞为显示剂),滴定的体积即为酸度,单位g/mL。
1.4.3 还原糖测定方法 3,5-二硝基水杨酸比色法测定溶液中还原糖[13]。
1.4.4 总糖测定方法 先对发酵培养基进行水解,然后用蒽酮比色法测定[14]发酵液中的总糖质量浓度。
2 结果与讨论
2.1 搅拌转速对黑曲霉生长的影响
考察了黑曲霉发酵生产柠檬酸过程中搅拌转速对于菌体生长的影响,在其它培养条件 (温度、pH、通风、初糖质量浓度)一致的情况下,研究了在不同的搅拌转速(400~800 r/min)下发酵过程中菌体生物量、发酵液残糖以及溶氧的变化情况,结果见图1。

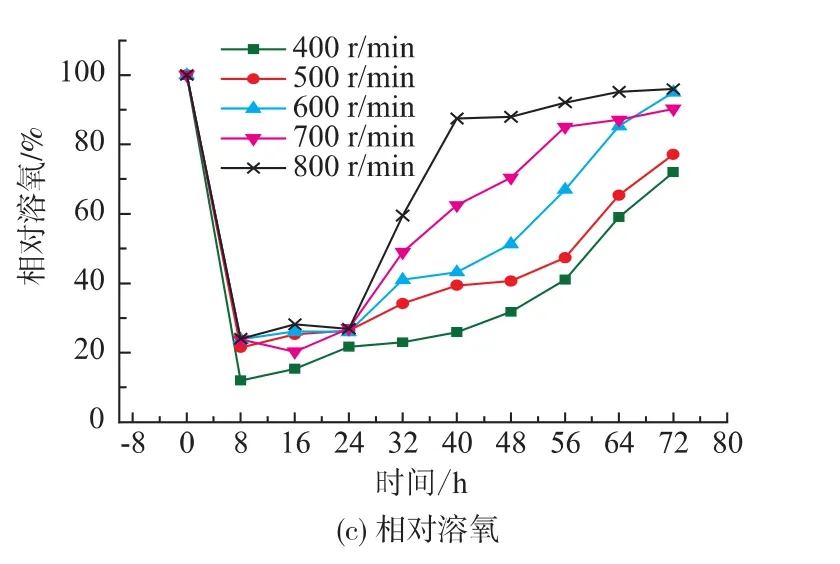
图1 不同溶氧对黑曲霉生长的影响Fig.1 Effect of agitationrate on the growth
由图1(a)可见,搅拌转速对于生物量有着很大的影响,随着搅拌转速的增大,生物量也相应增大,在400 r/min和800 r/min时,最大生物量分别为29 g/L和50 g/L,相差很大,说明低转速会导致菌体生长缓慢。这是因为黑曲霉是好氧微生物,对于溶氧的要求较高。另外,菌体并未因为较高的转速导致菌丝破碎溶解而致生物量降低,这可能因为发酵过程中黑曲霉是以菌球形态存在,对于搅拌的剪切作用承受能力较大。参考图1(b),低转速条件下培养液中的还原糖消耗相当慢,说明低溶氧条件下菌体的代谢活动相当缓慢。
由图 1(b)可见,发酵初期(0~8 h)残余还原糖的质量浓度有上升的趋势,搅拌转速越小,还原糖质量浓度上升越快。这是因为在发酵初期,黑曲霉菌体中的糖化酶会作用于底物大分子非还原糖(淀粉),将其分解为小分子还原糖为菌体的快速生长做准备。在发酵初期糖化酶水解淀粉产生还原糖的速度大于菌体分解利用的还原糖量,随着发酵的进行糖消耗速度增大,还原糖质量浓度逐渐降低,且与搅拌转速相关。
由图1(c)可见,不同的搅拌转速发酵过程,溶氧水平变化表现出相似的变化,在发酵前期(8~24 h)内保持较低的时间,说明这段时间是黑曲霉菌体的快速生长期,代谢活动旺盛需要大量的溶解氧。而发酵后期需氧量减少,供氧速率高于耗氧速率,溶氧上升,这与微生物的生长是一致的。
2.2 搅拌转速对黑曲霉生产柠檬酸的影响
不同搅拌转速下黑曲霉发酵产酸的情况见图2。产酸情况在保持恒定的不同的搅拌转速下有较大的差异,这与搅拌转速对黑曲霉菌体生长的影响是基本一致的。在搅拌转速为400 r/min时,柠檬酸生成量相当低,最终产酸为2.2 g/dL,当转速升高到500 r/min时,柠檬酸生成量有较大的提高,最终产酸量为12.9 g/dL。这说明溶氧水平对于柠檬酸产量有重要的影响,发酵过程一定要保持一定的溶氧水平。但产酸量并不完全随着搅拌转速的提高而升高,在搅拌转速500 r/min下最终产酸量最大,达到12.9 g/dL。当转速由500 r/min提高到800 r/min,最终产酸量由12.9 g/dL降低至11.1 g/dL。发酵前半程转速600 r/min时产酸量较大。

图2 不同搅拌转速对黑曲霉生产柠檬酸的影响Fig.2 Effect of agitation rate on citric acid production
在发酵初期(0~8 h)基本没有产酸,之后的 8~24 h产酸量快速升高,而这阶段也是菌体快速生长的阶段,综合图1和图2可以看出,发酵前期菌体生长与产酸是相关联的。当进入发酵期后,产酸量迅速提高,pH很快降低到2以下,这对发酵过程是必要的,因为只有在较低的pH下柠檬酸才能大量积累,也会有效抑制杂菌污染[15-16]。
通过公式γp=dP/dt可以计算不同转速下柠檬酸产生速率,其中P是柠檬酸产量(g/dL),t为时间(h)。用Origin软件对图2(a)中的酶活数据进行线性拟合后进行插值计算,可以得到不同搅拌转速下的产酸速率—时间关系曲线,如图2(b)。
由图2(b)可见,搅拌速率对最高产酸速率出现的时间基本没影响,均出现在32 h左右。较高转速和较低的转速均不利于产酸,转速500 r/min时产酸速率最大,达到 0.34 g/(dL·h)。 综合图 2(a)和图2(b)固定转速下500 r/min是最优转速。另外,在搅拌转速600 r/min下,发酵初期的产酸速率较其它转速高。
不同搅拌转速下黑曲霉的发酵动力学参数见表1。其中在转速500 r/min下,产酸量、糖酸转化率最大,为最佳转速。
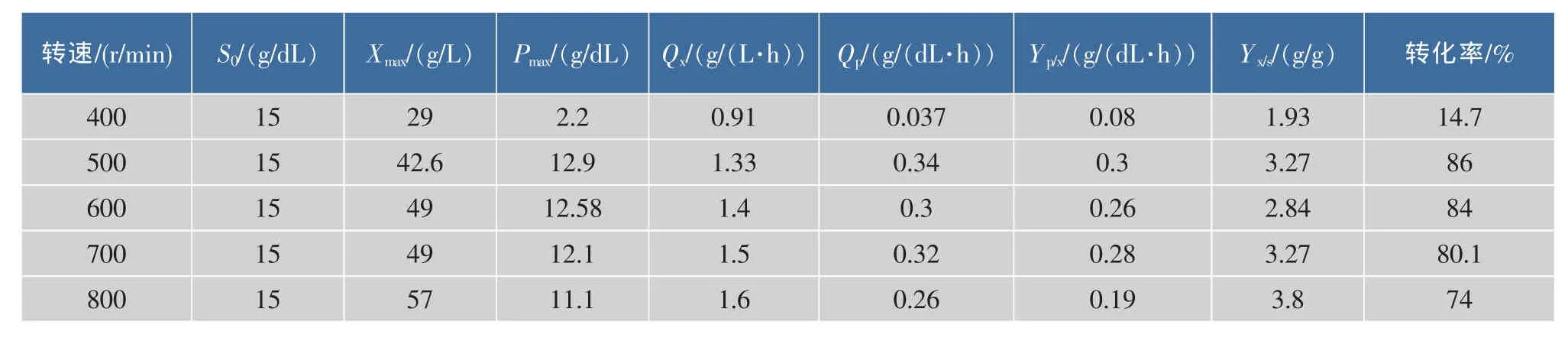
表1 不同搅拌转速条件下的发酵参数比较Table 1 Fermentation parameters in different agitation rate
2.3 两阶段搅拌转速控制对柠檬酸分批发酵的影响
根据文献[17]并基于上述的分析结果,提出了柠檬酸分批发酵过程的搅拌转速两阶段控制策略:发酵前期(0~16 h)搅拌转速控制 600 r/min,发酵中后期搅拌转速控制为500 r/min,结果见图3及表2所示。
从图3可以看出,在两阶段搅拌转速控制发酵过程中,黑曲霉菌体的生长情况变化不大,但是柠檬酸的积累量有较大的提高,见表1及表2。柠檬酸产量(14.1 g/dL)比最优恒定转速(500 r/min)提高了8.5 g/dL,相应的糖酸转化率也提高了8.5%,且柠檬酸的合成速率也有提高。因为发酵初期菌体生长与柠檬酸的合成相关联,较高的溶氧可以保证菌体的生长,同时使体系pH迅速降低到2以下,以抑制杂酸产生,主要积累柠檬酸。发酵中后期保持一定的溶氧水平就可以维持菌体的代谢,较高的溶氧会使菌体大量积累而降低产物的合成,而且较高的转速会影响黑曲霉的菌球形态,导致产物分泌减少。
2.4 基于两阶段搅拌转速策略分批补料发酵生产柠檬酸
分批补料发酵培养是在分批发酵过程中补充培养基,而不从体系中排除发酵液的培养方式。在发酵工业中采用分批补料发酵可以使底物的残留保持在较低的水平,可以缓和底物抑制,富集高浓度细胞,延长代谢产物的积累时间,获得更高的产量。
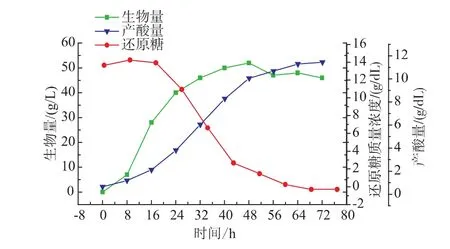
图3 采用两阶段搅拌转速控制的发酵过程曲线Fig.3 Fermentation curveunder two-stage agitation rate

表2 两阶段搅拌转速控制策略的发酵参数Table2 Fermentation parameterundertwo-stage agitation rate
根据图 1(b)及图 2(a),在发酵至 48 h 时,残糖量很低且产酸速率降至很低,参照文献[18-19],如果能在这时补充葡萄糖,理论上可以延长柠檬酸积累的时间,提高柠檬酸的产量。因此,作者研究将两阶段搅拌策略与分批补料发酵相结合进行发酵过程优化:发酵前期(0~16 h)搅拌转速控制为600 r/min,发酵中后期搅拌转速控制500 r/min,初始总糖质量浓度15 g/dL,发酵至48 h一次性补加葡萄糖50 g,使补入后的发酵液还原糖质量浓度为6 g/dL,结果见图4。
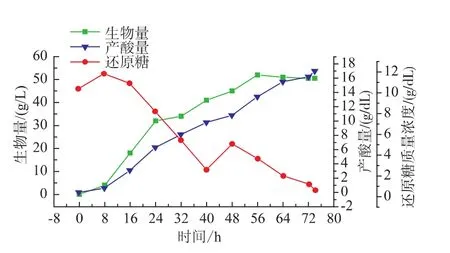
图4 两阶段搅拌转速策略分批补料发酵过程曲线Fig.4 Fermentation curve of fedbatch fermentation
由图4可以看出,在发酵进程残糖量较低的情况下补入葡萄糖后,为菌体的代谢活动提供了新的原料,菌体量由45 g/L上升到52 g/L,产酸速率明显升高。与两阶段搅拌转速控制分批发酵相比,分批补料发酵的柠檬酸产量 (17.2 g/dL)提高了22.8%,糖酸转化率(95.5%)提高了2.2%。
3 结语
通过采用可溶玉米浆与玉米清液作为发酵培养基对产柠檬酸黑曲霉CCTCC M2013172进行发酵条件的优化,为了便于测定生物量使用与生产培养基有所改变,所以产量也有所差异。通过考察搅拌转速等条件对发酵过程的影响,发现黑曲霉生产柠檬酸是生长关联型的,适当的菌体质量浓度有利于产酸,但是柠檬酸的产量并不是与菌体质量浓度呈正比例关系。
由发酵结果可知,在恒定转速400~800 r/min之间,转速500 r/min是最优转速,由于发酵前期菌体的生长情况与发酵液pH对后期的柠檬酸积累有很大影响,所以采用了两阶段搅拌转速策略:发酵前期(0~16 h)搅拌转速控制为 600 r/min,发酵中后期搅拌转速控制为500 r/min,柠檬酸产量(14.1 g/dL)与糖酸转化率均比最优恒定转速(500 r/min)下提高了8.5%。在此基础上又进行了分批补料发酵优化,与两阶段搅拌转速控制分批发酵相比,分批补料发酵的柠檬酸产量(17.2 g/dL)提高了22.8%,糖酸转化率(95.5%)提高了2.2%。
[1]孙荣,王燕,杨平平.柠檬酸发酵现状及展望[J].中国调味品,2011,36(1):90-92.SUN Rong,WANG Yan,YANG Pingping.Research progress on citric acid fermentation and prospect of it[J].China Condiment,2011,36(1):90-92.(in Chinese)
[2]冯志合,卢涛.中国柠檬酸行业概况[J].中国食品添加剂,2011(3):158-163.FENG Zhihe,LU Tao.Theoverview of China’s citric acid industry[J].China Food Additives,2011(3):158-163.(in Chinese)
[3]Adham N Z.Attempts at improving citric acid fermentation by Aspergillusnigerin beet-molasses medium [J].Bioresource Technology,2002,84(1):97-100.
[4]代真真,周勇,刘玉伟,等.柠檬酸发酵过程中液化条件的影响[J].食品与生物技术学报,2011,30(5):723-727.DAI Zhenzhen,ZHOU Yong,LIU Yuwei,et al.Effects of liquefying conditions during citric acid fermentation[J].Journal of Food Science and Biotechnology,2011,30(5):723-727.(in Chinese)
[5]Sakurai A,Imai H,Sakakibara M.Effect of oxygen tension on citric acid production by surface culture[J].Journal of Fermentation and Bioengineering,1996,82(5):519-521.
[6]Papagianni M,Mattey M,Kristiansen B.The influence of glucose concentration on citric acid production and morphology of Aspergillus niger in batch and culture[J].Enzyme and Microbial Technology,1999,25(8):710-717.
[7]Paul G,Priede M,Thomas C.Relationship between morphology and citric acid production in submerged Aspergillus niger fermentations[J].Biochemical Engineering Journal,1999,3(2):121-129.
[8]任晓莉,赵林,杨宝强,等.UV和 NTG复合诱变柠檬酸生产菌种黑曲霉[J].天津大学学报,2010,43(6):553-556.REN Xiaoli,ZHAO Lin,YANG Baoqiang,et al.Breeding of Aspergillus niger for citric acid fermentationby UV and NTG compound mutation[J].Journal of Tianjin University,2010,43(6):553-556.(in Chinese)
[9]郭伟,方慧英,诸葛斌,等.耐 Mn2+高产柠檬酸菌株的选育及其特性分析[J].食品与发酵工业,2013,39(4):37-41.GUO Wei,FANG Huiying,ZHU Gebin,et al.Breeding and characterization of Mn2+-resistance and high citric acid-yielding strain[J].Food and Fermentation Industries,2013,39(4):37-41.(in Chinese)
[10]Demirel G,Yaykasl1 K O,Yasar A.The production of citric acid by using immobilized Aspergillus niger A-9 and investigation of its various effects[J].Food chemistry,2005,89(3):393-396.
[11]Kamzolova S V,Shishkanova N V,Morgunov I G,et al.Oxygen requirements for growth and citric acid production of Yarrowialipolytica[J].FEMS Yeast Research,2006,3(2):217-222.
[12]陈雪梅,游佳清,李建成,等.溶解氧对黑曲霉发酵生产柠檬酸的影响[J].食品与发酵科技,2009(5):42-44.CHEN Xuemei,YOU Jiaqing,LI Jiancheng,et al.The influence of dissolved oxygen on Aspergillus niger fermentation producing citric acid[J].Food and Fermentation Technology,2009(5):42-44.(in Chinese)
[13]卢宗梅.溶氧对黑曲霉发酵生产柠檬酸的影响及临界氧的发现[J].中国科技博览,2012(7):81-82.LU Zongmei.The influence of dissolved oxygen on Aspergillus niger fermentation producing citric acidand the discovery of critical oxygen[J].China Science and Technology Review,2012(7):81-82.(in Chinese)
[14]齐香君,苟金霞,韩戍珺,等.3,5-二硝基水杨酸比色法测定溶液中还原糖的研究[J].纤维素科学与技术,2004,12(3):17-19.QI Xiangjun,GOU Jinxia,HAN Shujun,et al.Study on the preparation of cellulose/poly(ethylene glycol)/vitamin drug membrane and its release property[J].Journal of Cellulose Science and Technology,2004,12(3):17-19.(in Chinese)
[15]大连轻工业学院,华南理工大学,郑州轻工业学院,等.食品分析[M].北京:中国轻工业出版社,1998:178-181.
[16]刘勇,曹光宇.分批补料培养对 L-异亮氨酸发酵的影响[J].工业微生物,2000,30(2):26-29.LIU Yong,CAO Guangyu.The effect of batch feeding culture on L-isoleucine fermentation[J].Industrial Microbiology,2000,30(2):26-29.(in Chinese)
[17]Papagianni M.Advances in citric acid fermentation by Aspergillus niger:biochemical aspects,membrane transport and modeling[J].Bioresource Advances,2007,25(3):244-263.
[18]张琦,詹晓北,吴剑荣,等.两阶段搅拌转速控制策略发酵生产聚唾液酸[J].生物技术,2009,19(4):73-75.ZHANG Qi,ZHAN Xiaobei,WU Jianrong,et al.A strategy of two-stage agitation rate for polysialic acid production[J].Biotechnology,2007,25(3):244-263.(in Chinese)
[19]宋向阳,王斌,李鑫,等.分批补料对木糖发酵生产乙醇的影响[J].生物学杂志,2011,28(3):88-91.SONG Xiangyang,WANG Bin,LI Xin,et al.Influence of fed-batch for fermentation of xylose to ethanol[J].Journal of Biology,2011,28(3):88-91.(in Chinese)
