支链氨基酸生物合成及其代谢工程育种研究进展
2014-12-25张伟国郭燕风
张伟国, 郭燕风
(江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
支链氨基酸包括L-缬氨酸 (L-valine)、L-亮氨酸(L-leuine)和 L-异亮氨酸(L-isoleuine),因其疏水脂质链都具有分支的甲基集团,又称之为分支链氨基酸[1]。支链氨基酸作为人体必需氨基酸,不仅是蛋白质的合成原料,而且还具有特殊的生理和生物学功能,亦可作为生物体能源[2]。目前,支链氨基酸广泛应用于氨基酸输液、营养强化剂等医药行业[3]、洗涤剂[4]、以及除草剂领域[5-7]。由于支链氨基酸具有广泛的用途,其需求量逐年增高。L-亮氨酸、L-异亮氨酸、L-缬氨酸的需求量分别为4 000、1 000、2 500 t/年,并且都以15%~20%的速率快速递增。支链氨基酸可以通过蛋白水解提取法和酶催化法获得,但是由于提取工艺复杂,污染严重以及与异构体拆分困难等缺点,导致目前生产支链氨基酸的方法主要为微生物发酵法[8]。支链氨基酸生产菌种主要为谷氨酸棒杆菌Corynebacterium glutamicum (包括其亚种黄色短杆菌Brevibacterium flavum和乳糖发酵短杆菌Brevibacterium lactofermentum等)[9-10]和大肠杆菌Escherichia coli[11]。现在大多数企业所采用的生产菌种主要是通过常规诱变选育的,其遗传背景不清晰,很难再提高产量[11]。作者主要介绍Corynebacterium glutamicum中支链氨基酸的生物合成途径及其代谢调控,并对支链氨基酸代谢工程育种情况进行了综述。
1 支链氨基酸生物合成途径及其酶活性调节
支链氨基酸生物合成途径见图1[12]。三种支链氨基酸的生物合成途径是紧密相连的,其中,L-异亮氨酸和L-缬氨酸经由同一平行途径,由相同的酶催化合成的,而L-亮氨酸是从L-缬氨酸前体物质α-酮基异戊酸分支,并由一系列特殊的酶催化合成。支链氨基酸生物合成途径中有4个公共酶系(分别为:乙酰羟酸合成酶AHAS、乙酰羟酸异构还原酶AHAIR、二羟酸脱水酶DHAD和支链氨基酸转氨酶TAs)以及各自独特的合成酶系,但正是因为生物合成途径中的这些公共酶系,导致三种支链氨基酸在生物合成过程中相互作用,从而使某一支链氨基酸生产中常常副生另外两种支链氨基酸,进而导致产酸水平下降和提取精制困难;而且由于三种氨基酸分子结构相似,只是合成途径中各种酶对底物亲和性的不同,酶与底物存在着一种模糊的识别关系,从而导致三种支链氨基酸的代谢拮抗作用。
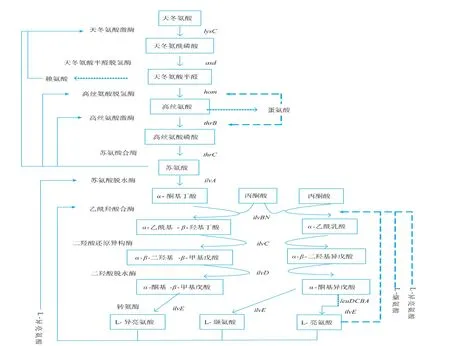
图1 谷氨酸棒杆菌中支链氨基酸生物合成途径及其反馈调节机制Fig.1 Biosynthetic pathway of branched-chain amino acids and regulation in Corynebacterium glutamicum
1.1 苏氨酸脱水酶
苏氨酸脱水酶(threonine dehydratase,TD)是 L-异亮氨酸合成的第一个关键酶,由ilvA基因编码,利用5-磷酸吡哆醛(PLP)为辅因子,催化L-苏氨酸转化为2-酮丁酸(2-ketobutyrate)。在C.glutamicum中,TD由4个完全一样47 000大小的亚基组成,与Nocardia属TD有较高的相似性,但与E.coli属TD的相似度就比较低[13]。TD的活性在一定程度上决定了L-异亮氨酸和L-缬氨酸、L-亮氨酸的生物合成的分布流向,因为2-酮丁酸存在时,乙酰羟酸合酶优先催化1分子丙酮酸和1分子2-酮丁酸脱羧合成1分子乙酰羟基丁酸而非催化2分子丙酮酸脱羧合成1分子乙酰乳酸[14]。因此,TD特异性地催化L-异亮氨酸的合成。在C.glutamicum和E.coli中,其最终产物L-异亮氨酸作为异构效应物抑制TD活性。对于L-苏氨酸、L-异亮氨酸、L-缬氨酸,TD的 K0.5分别为 21、78、12 mmol/L。对 TD C-端调节区域266-349进行定点突变可以解除这些反馈抑制[15]。
1.2 乙酰羟酸合酶
乙 酰 羟 酸 合 酶 (acetohydroxyacid synthase,AHAS),也叫乙酰乳酸合酶,由ilvBN编码,是支链氨基酸合成途径上的第一个共用酶也是关键酶,既可以催化2分子丙酮酸脱羧合成1分子乙酰乳酸(acetolactate),即L-缬氨酸和L-亮氨酸的前体;也可以催化1分子丙酮酸和1分子2-酮丁酸脱羧合成1分子乙酰羟基丁酸 (acetohydroxy butyrate),即L-异亮氨酸的前体[11]。AHAS由两个亚基组成,大亚基由ilvB编码,具有催化功能;小亚基由ilvN编码,具有调节功能,突变小亚基上的三个连续氨基酸可以解除三种支链氨基酸的反馈抑制[10]。同样,E.coli中同工酶AHAS II、III对2-酮丁酸的亲和性远高于丙酮酸。在2-酮丁酸存在时,优先合成L-异亮氨酸,此时L-缬氨酸和L-亮氨酸的合成减弱,高浓度的2-酮丁酸(100 mmol/L)会导致L-缬氨酸和L-亮氨酸匮乏。
1.3 乙酰羟酸异构还原酶
乙酰羟酸异构还原酶(Acetohydroxyacid Isomeroreductase,AHAIR)是支链氨基酸合成途径上的第二个公共酶,该酶由ilvC基因编码[16]。在L-缬氨酸和L-亮氨酸合成途径中,催化乙酰乳酸生成2,3-二羟基异戊酸(dihydroxyisovalerate);在 L-异亮氨酸合成途径中,催化乙酰羟基丁酸生成2,3-二羟基-3-甲基戊酸(dihydroxymethyl valerate)。 反应包括烷基的异构和还原,同时该反应还需要Mg2+(激活剂)和NADPH(氢供体)进行辅助。在E.coli中活跃的乙酰羟酸异构还原酶是由相同的4个亚基所组成的四聚体,而在C.glutamicum中ilvC基因编码的产物一直还未被描述。在C.glutamicum中,AHAIR被L-缬氨酸和L-亮氨酸所抑制。对于L-缬氨酸和L-亮氨酸,其IC50值都为7 mmol/L[16]。
1.4 二羟酸脱水酶
二 羟 酸 脱 水 酶 (dihydroxyacid dehydratase,DHAD)是支链氨基酸合成途径上的第三个共用酶,该酶由ilvD基因编码。在L-缬氨酸和L-亮氨酸合成途径中,催化2,3-二羟基异戊酸生成2-酮异戊酸(ketoisovalerate);在 L-异亮氨酸合成途径中,催化2,3-二羟基-3-甲基戊酸生成2-酮-3-甲基戊酸(ketomethyl valerate)。 在 E.coli中 DHAD 蛋白质分子是二聚物,由两个66 000的亚基组成,而在C.glutamicum中,该酶是由611个氨基酸残基组成的多肽链组成,相对分子质量大约为65 000。C.glutamicum中,L-缬氨酸和L-亮氨酸对DHAD的抑制作用比较微弱,其IC50值分别为170、120 mmol/L。不过,在三种支链氨基酸都存在的条件下,并没有发现对该酶的协同抑制作用。
1.5 转氨酶
支链氨基酸转氨酶(transaminases,TAs)是支链氨基酸合成途径上的最后一个共用酶。支链氨基酸转氨酶主要包括转氨酶B、转氨酶C和芳香族转氨酶,分别由基因ilvE、avtA和tyrB编码。这三种转氨酶在支链氨基酸的合成中都具有催化活性,但主要由转氨酶B催化三种支链氨基酸合成的最后一步反应。转氨酶B将来自脂肪族氨基酸中的α-氨基催化形成L-缬氨酸或者α-酮基谷氨酸。在C.glutamicum中ilvE基因编码形成由367个氨基酸残基组成的多肽链,相对分子质量约为40 000[17]。
1.6 异丙基苹果酸合成酶
在L-亮氨酸生物合成中,第二个关键酶为异丙基苹果酸合成酶(isopropylmalate synthetase,IPMS),IPMS由leuA基因编码,催化2-酮异戊酸生成异丙基苹果酸[18]。IPMS受到L-亮氨酸的反馈抑制和反馈阻遏。IPMS和转氨酶B的活性决定了在2-酮异戊酸节点生成L-亮氨酸或L-缬氨酸的流向。
2 支链氨基酸生物合成的相关调控
支链氨基酸合成途径的调节复杂而且具有多样性:支链氨基酸合成途径中存在一种酶催化多步反应以及多种最终产物反馈调节同一个酶的现象。而且三种支链氨基酸合成途径是平行关系;其合成途径涉及的关键酶活性和基因表达都存在多价调节机制。
2.1 支链氨基酸对乙酰羟酸合酶AHAS的反馈抑制和阻遏
支链氨基酸反馈抑制和阻遏的主要是乙酰羟酸合酶AHAS。在C.glutamicum中,仅存在一种AHAS,被三种支链氨基酸中的任何一种反馈抑制。对于L-缬氨酸、L-异亮氨酸、L-亮氨酸,其IC50值分别为0.9、3.1、6.0 mmol/L,其中L-缬氨酸的抑制能力最强[16]。需要指出的是,任意两种支链氨基酸组合,甚至全部三种支链氨基酸协同抑制,谷氨酸棒杆菌AHAS被抑制程度都不超过57%。AHAS的小亚基是调节亚基,对小亚基进行连续三个氨基酸的突变(Gly20Asp,Ile21Asp,Ile22Phe),可以完全解除三种支链氨基酸的反馈抑制作用[10]。对谷氨酸棒杆菌ilvN上3个相连的氨基酸残基进行替换,可以得到不受任何支链氨基酸反馈抑制的突变体,这说明在C.glutamicum中ilvN上三种支链氨基酸的结合位点为同一个变构位点,只是该位点对三种支链氨基酸的亲和性有所不同。
与 C.glutamicum不同的是,E.coli中存在AHAS I、II、III三种同工酶, 分别由 ilvBN、ilvGM 和ilvIH编码。三种同工酶在蛋白质序列和功能上存在着较大的差异,其中AHAS I对L-缬氨酸敏感,AHAS III对三种支链氨基酸都敏感。但是,AHAS II对三种支链氨基酸都不敏感。AHAS I基因序列与AHAS II、III具有很大的差别,在功能上主要表现为对2-酮丁酸亲和力的不同。AHAS I对2-酮丁酸亲和力比对丙酮酸的亲和力高了2倍,但是AHAS II、III却分别高了60倍和40倍。即使在丙酮酸浓度较高的情况下,L-缬氨酸可以完全抑制AHAS I的活性,AHAS III只有部分活性受到抑制。AHAS II对任何一种支链氨基酸的抑制作用都不敏感。
2.2 支链氨基酸胞外分泌调节
支链氨基酸在细胞内和细胞外的浓度会相差十几甚至几十倍。支链氨基酸在胞内积累会对细胞产生毒害作用,从而影响整体的发酵产酸水平。支链氨基酸必须通过膜透性酶BrnFE转运出去,才可减少这种产物毒害。另外,膜透性酶BrnFE的运输功能还需要调节因子Lrp的辅助才能更好地完成。
3 代谢工程菌种选育状况
传统诱变主要通过选育抗结构类似物的菌株,来解除中间产物及最终产物对合成途径中关键酶的反馈抑制和反馈阻遏,达到最终增加产量的目的;传统诱变也可以选育营养缺陷型菌株或某些药物耐受型菌株,以提高产量;同样也可以通过原生质体融合技术赋予菌株更多的遗传标记,达到增加产量的目的。
Katsumada等以谷氨酸棒杆菌和北京棒杆菌作为出发菌株,通过选育以乙酸为惟一碳源的菌株及以丙酮酸为惟一碳源的丙酮酸类似物敏感型菌株AV1和 AV2,L-缬氨酸的产量达到了 39、36 g/L,比出发菌株提高了36%[19]。陈宁等通过DES和UV诱变处理出发菌株TV10,在磺胺胍(SG)、α-氨基丁酸(α-AB)、2-噻唑丙氨酸(2-TA)结构类似物平板上定向筛选出一株L-缬氨酸产生菌TV23,产酸水平提高了19.4%[20]。张伟国等以硫酸二乙酯(DES)和亚硝基胍(NTG)诱变处理,以氨基酸结构类似物定向筛选出一株L-缬氨酸高产菌XQ-8(Leulα-ABhr2-TAhrAHVhr),50 L 罐补料分批发酵可产酸 72 g/L[21];以黄色短杆菌为出发菌株,经逐级诱变处理,获得L-异亮氨酸高产菌株XQ-4(AHVrAECrSGrEthrα-ABrIleHxrSucg), 可积累 L-异亮氨酸 28~30 g/L[22]。Ikeda由苏氨酸产生菌FAB-3-1选育乙硫氨酸(Eth)抗性突变株,得到一株L-异亮氨酸产生菌No.14083,流加乙酸可产酸33.5 g/L[23]。宋文军等根据代谢控制发酵原理,定向选育出突变株ISW330(Met-Ethrα-ABrAECr),可产 L-异亮氨酸 20.2 g/L[24]。
Tsuchida等诱变乳糖发酵短杆菌2256获得突变株 No.218(Met-Ile-2-TAr),最终可积累 L-亮氨酸28 g/L[25]。宋超先筛选出一株利福平(80 mg/L)耐受型菌株,最终可产L-亮氨酸32.1 g/L[26]。谢希贤以谷氨酸棒杆茵TG95为出发茵株,通过紫外诱变、原生质体融合和硫酸二乙酯诱变,定向选育L-亮氨酸产生菌TGL8207,摇瓶发酵产L-亮氨酸27.2 g/L,10 L罐补料分批发酵产酸44.5 g/L[27]。伍时华等采用原生质体融合技术,定向选育出一株L-亮氨酸高产菌TQ9806,该菌株经5 L罐分批发酵64 h,产L-亮氨酸22.7 g/L[28]。
目前,大多数企业所采用的生产菌种主要是通过常规诱变所选育的,其遗传背景不清晰,产量和糖酸转化率很难再提高。构建基因工程菌是解决产量低和糖酸转化率低的有效方法。构建基因工程菌主要是通过表达合成途径的关键基因、敲除或降低支路基因的表达等手段实现的。
Radmacher等在谷氨酸棒杆菌中缺失了ilvA和panBC基因,并过表达了ilvBNCD基因,在40 g/L葡萄糖的情况下摇瓶培养能产L-缬氨酸90 mmol/L[29]。Elisakova等定点突变ilvN解除AHAS的反馈抑制作用,同时缺失竞争途径中的ilvA和panB基因及过表达ilvBNC基因,在40 g/L葡萄糖的情况下摇瓶培养能产L-缬氨酸130 mmol/L[10]。Blombach等敲除进入TCA循环的aceE基因以增加前体物质丙酮酸的供给,并过表达ilvBNCE基因,分批发酵可产L-缬氨酸210 mmol/L[30]。Blombach等敲除编码催化丙酮酸转化为乙酸的丙酮酸/奎宁氧化还原酶的pqo基因,进一步增加丙酮酸供给;敲除编码磷酸葡萄糖异构酶的pgi基因,增加经过磷酸戊糖途径的碳流并使更多的NADPH用于L-缬氨酸的生物合成,结果携带质粒pJC4ilvBNCE的谷氨酸棒杆菌(ΔaceEΔpqoΔpgi) 菌株分批发酵能产生 L-缬氨酸48.0 g/L[31]。 Holátko通过定点突变技术,对 ilvD 和ilvE基因的启动子活性实施了上升调控;对ilvA和leuA基因的启动子活性实施了下降调控,最终菌株可产L-缬氨酸15.9 g/L[32]。侯小虎等定点突变ilvN解除三种支链氨基酸的反馈抑制,并串联表达ilvEBNrC基因,可产L-缬氨酸31 g/L[33]。
Gusyatiner等通过传统诱变的方法失活ilvE基因,并过表达tyrB基因,构建的菌株E.coli K-12 505/pACYC-tyrB可产L-亮氨酸2.7 g/L[34]。Katashkina等在E.coli中过表达诱变解除反馈抑制的leuA基因并失活ilvE基因,再过表达tyrB基因以及降低sucAB基因启动子活性,最终可产L-亮氨酸11.4 g/L[35]。
Eggeling等通过基因工程手段加强了2-酮丁酸的供给,使代谢流向L-异亮氨酸的合成途径,最终可产L-异亮氨酸20 g/L[36]。Ken-ichi等在E.coi K12中过量表达AK III(脱敏),构建的菌株葡萄糖转化率为30%[37]。Susanne Morbach等过量表达hom(脱敏)、thrB和ilvA(脱敏)三个基因,构建表达菌株SM13,葡萄糖转化率达到22%[38]。尹良鸿串联表达解除反馈抑制的ilvA和ilvBN可产L-异亮氨酸30 g/L[39]。
4 展望
目前,我国采用发酵法工业化生产支链氨基酸已有十多年的历史,但与国际先进水平相比,存在产酸水平低、杂酸高、发酵周期长、提取手段落后、产品纯度低和生产过程污染严重等问题。解决目前存在的问题,在我国开展此方面的研究对于国内支链氨基酸产业化,促进医药行业的发展具有重要的意义。而且国内几乎所有产支链氨基酸的菌种,都不可避免地副生另外两种支链氨基酸。深入研究支链氨基酸生物合成途径中的关键酶和关键因素,有望构造高产任意一种支链氨基酸且无副生另外两种支链氨基酸的菌株。
[1]Bonnefoy M,Laville M,Ecochard R,et al.Effects of branched amino acids supplementation in malnourished elderly with catabolic status[J].The Journal of Nutrition,Health&Aging,2010,14(7):579-584.
[2]Tom A and Nair K S.Assessment of branched-chain amino acid status and potential for biomarkers[J].The Journal of Nutrition,2006,136(1):324S-330S.
[3]Kalogeropoulou D,LaFave L,Schweim K,et al.Leucine,when ingested with glucose,synergistically stimulates insulin secretion and lowers blood glucose[J].Metabolism Clinical and Experimental,2008,57:1747-1752.
[4]陈丽,周美华.氨基酸型表面活性剂研究动态[J].精细与专用化学品,2004,12(19):7-11.CHEN Li,ZHOU Meihua.Research trend of amino acid-based surfactants[J].Fine and Specialty Chemicals,2004,19:7-11.(in Chinese)
[5]Chipman D M,Duggleby R G,Tittmann K.Mechanisms of acetohydroxyacid synthases[J].Chemical Biology,2005,9(5):475-481.
[6]McCourt J A,Duggleby R G.Acetohydroxyacid synthase and its role in the biosynthetic pathway for branched-chain amino acids[J].Amino Acids,2006,31(2):173-210.
[7]王秀君,郎志宏,单安山,等.氨基酸生物合成抑制剂类除草剂作用机理及耐除草剂转基因植物研究进展[J].中国生物工程杂志,2008,28(2):110-116.WANG Xiujun,LANG Zhihong,SHAN Anshan,et al.Advances in mechanism of herbicide in inhibiting amino acid biosynthesis and herbicide-tolerant transgenic plants[J].China Biotechnology,2008,28(2):110-116.(in Chinese)
[8]刘建军,赵祥颖,田延军,等.L-亮氨酸的应用及其生产菌的育种思路[J].氨基酸和生物资源,2004,26(1):49-52.LIU Jianjun,ZHAO Xiangying,TIAN Yanjun,et al.Application of L-Leucine and the breeding idea[J].Amino Acids&Biotic Resources,2004,26(1):49-52.(in Chinese)
[9]Kennerknecht N,Sahm H,Yen M R,et al.Export of L-isoleucine from Corynebacterium glutamicum:a two-gene-encoded member of a new translocator family[J].Journal of Bacteriology,2002,184(14):3947-3956.
[10]Elišáková V,Pátek M,Holátko J,et al.Feedback-resistant acetohydroxy acid synthase increases valine production in Corynebacterium glutamicum[J].Applied and Environmental Microbiology,2005,71(1):207-213.
[11]Park,J H,Lee K H,Kim T Y,et al.Metabolic engineering of Escherichia coli for the production of L-valine based on transcriptome analysis and in silico gene knockout simulation[J].PNAS,2007,104(19):7797-7802.
[12]Park J H,Lee S Y.Metabolic pathways and fermentative production of L-aspartate family amino acids[J].Biotechnology Journal,2010,5(6):560-577.
[13]Choi Y J,Park J H,Kim T Y,et al.Metabolic engineeringof Escherichia coli for theproductionof1-propanol[J].Metabolic Engineering,2012,14:477-486.
[14]Vega T,Breccia G,Gil M,et al.Acetohydroxyacid synthase (AHAS) in vivo assay for screening imidazolinone-resistance in sunflower(Helianthus annuus L.)[J].Plant Physiology and Biochemistry,2012,61:103-107.
[15]Möckel M,Eggeling L,Sahm H.Threonine dehydratases of Corynebacterium glutamicum with altered allosteric control:their generation and biochemical and structural analysis[J].Molecular Microbiology,1994,13(5):833-842.
[16]Leyval D,Uy D,Delaunay S,et al.Characterisation of the enzyme activities involved in the valine biosynthetic pathway in a valine-producing strain of Corynebacterium glutamicum[J].Journal of Biotechnology,2003,104(1-3):241-252.
[17]McHardy A C,Tauch A,Rückertb C,et al.Genome-based analysis of biosynthetic aminotransferase genes of Corynebacterium glutamicum[J].Journal of Biotechnology,2003,104(1-3):229-240.
[18]Ruklisha M,Paegle L,Denina I.L-Valine biosynthesis during batch and fed-batch cultivations of Corynebacterium glutamicum:Relationship between changes in bacterial growth rate and intracellular metabolism[J].Process Biochemistry,2007,42(4):634-640.
[19]Katsurada N,Uchibori H,Tsuchida T.Process for producing L-valine by fermentation[P].US Patent:5188948A,1993-02-23.
[20]陈宁,熊明勇,赵丽丽,等.L-缬氨酸生产菌的选育及基于遗传算法的发酵培养基优化[J].天津轻工业学院学报,2002,4:18-20,38.CHEN Ning,XIONG Mingyong,ZHAO Lili,et al.Breeding of L-valine producing strain and the medium optimization of fermentation based on genetic algorithms[J].Journal of Tianjin University of Light Industry,2002,4:18-20,38.(in Chinese)
[21]张伟国,钱和,乎守涛,等.L-缬氨酸高产菌X选育及营养需求研Q-8补料分批发酵的研究[J].食品工业科技,2012,33(2):192-194.ZHANG Weiguo,QIAN He,HU Shoutao,et al.Study on the fed-batch fermentation of L-valine hyper-producer XQ-8[J].Science and Technology of Food Industry,2012,2:192-194.(in Chinese)
[22]李进,张伟国.L-异亮氨酸菌种选育及发酵条件优化[J].食品与生物技术学报,2006,25(1):54-59.LI Jin,ZHANG Weiguo.Breeding of L-isoleucine producer and its optimal fermentation conditions[J].Journal of Food Science and Biotechnology,2006,25(1):54-59.(in Chinese)
[23]Ikeda S,Fujita I,Yoshinaga F.Screening of L-isoleucine producers among ethionine resistant mutants of L-threonine producing bacteria[J].Agricultural and Biological Chemistry,1976,40(3):511-516.
[24]宋文军,陈宁,魏春,等.L-异亮氨酸产生菌的选育及其发酵条件优化[J].食品与发酵工业,2003,29(3):34-37.SONG Wenjun,CHEN Ning,WEI Chun,et al.Breeding of L-isoleucine producer and its conditions optimization on fermentation process[J].Food and Fermentation Industries,2003,29(3):34-37.(in Chinese)
[25]Tsuchida T and Momose H.Improvement of an L-leucine-producing mutant of Brevibacterium lactofermentum 2256 by genetically desensitizing it to α-acetohydroxy acid synthetase[J].Applied and Environmental Microbiology,1986,51(5):1024-1027.
[26]宋超先.L-亮氨酸产生菌的选育及其发酵条件的研究[D].天津:天津科技大学,2004.
[27]谢希贤,杜军,徐庆阳,等.谷氨酸棒杆菌苏氨酸脱氨酶基因敲除及对L-亮氨酸发酵的影响[J].中国食品学报,2010,2:40-45.XIE Xixian,DU Jun,XI Qingyang,et al.Knockout of threonine dehydratase gene in Corynebacterium glutamicum and its influence on L-leucine fermentation[J].Journal of Chinese Institute of Food Science and Technology,2010,2:40-45.(in Chinese)
[28]伍时华,方杰,陈宁.L-亮氨酸高产茵的代谢控制育种[J].生物技术通讯,2001,12(3):S27-S30.WU Shihua,FANG Jie,CHEN Ning.Metabolic control breeding of L-leucine high ·producing strain [J].Letters in Biotechnology,2001,12(3):S27-S30.(in Chinese)
[29]Radmacher E,Vaitsikova A,Burger U,et al.Linking central metabolism with increased pathway flux:L-valine accumulation by Corynebacterium glutamicum[J].Applied and Environmental Microbiology,2002,68(5):2246-2250.
[30]Blombach B,Schreiner M E,Holátko J,et al.L-valine production with pyruvate dehydrogenase complex-deficient Corynebacterium glutamicum[J].Applied and Environmental Microbiology,2007,73(7):2079-2084.
[31]Blombach B,Schreiner M E,Bartek T,et al.Corynebacterium glutamicum tailored for high-yield L-valine production[J].Appl Microbiol Biotechnol,2008,79(3):471-479.
[32]Holátko J,Elišáková V,Prouza M,et al.Metabolic engineering of the L-valine biosynthesis pathway in Corynebacterium glutamicum using promoter activity modulation[J].Journal of Biotechnology,2009,139(3):203-210.
[33]Hou X H,Ge X Y,Wu D,et al.Improvement of L-valine production at high temperature in Brevibacterium flavum by overexpressing ilvEBNrC genes[J].Journal of Industrial Microbiology&Biotechnology,2012,39(1):63-72.
[34]Gusyatiner M M,Lunts M G,Kozlov Y I.DNA coding for mutant isopropylmalate synthase L-leucine-producing microorganism and method for producing L-leucine[P].US Patent:64032 B1,2002-01-11.
[35]Katashkina J Y,Lunts M G,Doroshenko V G,et al.Method for producing an L-amino acid using a bacterium with an optimized level of gene expression[P].US Patent:7604979B2,2009-10-20.
[36]Eggeling L,Morbach S,Sahm H.The fruits of molecular physiology:engineering the L-isoleucine biosynthesis pathway in Corynebacterium glutamicum[J].Journal of Biotechnology,1997,56(3):167-182.
[37]Hashiguchi K I,Takesada H,Suzuki E,et al.Construction of an L-isoleucine overproducing strain of Escherichia coli K-12[J].Bioscience Biotechnology and Biochemistry,1999,63(4):672-679.
[38]Morbach S,Sahm H,Eggeling L.L-Isoleucine Production with Corynebacterium glutamicum:further flux increase and limitation of export[J].Applied and Environmental Microbiology,1996,62(12):4345-4351.
[39]Yin L H,Hu X Q,Xu D Q,et al.Co-expression of feedback-resistant threonine dehydratase and acetohydroxy acid synthase increase L-isoleucine production in Corynebacterium glutamicum[J].Metabolic Engineering,2012,14:542-550.
