淀粉支载阿司匹林前药的合成及其体外释放
2014-12-24梅天笑王小莺袁厚群聂海静鲍光明
梅天笑,王小莺,袁厚群,万 根,聂海静,鲍光明
(1.江西农业大学动物科学技术学院;2.江西农业大学理学院,江西南昌330045)
阿司匹林(aspirin)又名乙酰水杨酸、醋柳酸、巴米尔,是一种典型的解热镇痛药,常用于感冒、发烧、头痛、神经痛、急性风湿性关节炎及牙痛等[1,2].随着研究深入,阿司匹林的许多新用途逐渐被发现,如防治糖尿病及其并发症,还有一定的抗癌疗效[3-7].但是,阿司匹林分子中苯甲酸结构的强酸性特征,导致一系列的胃肠道反应[8-10],而且,阿司匹林结构不稳定,在体内易水解产生游离的水杨酸,影响疗效.为了克服这些副作用,对阿司匹林做一些结构改造很有必要.淀粉廉价易得、无毒无害、环保、无免疫原性、在体内易降解,是药物制剂的常用辅料,是作为阿司匹林支撑剂的最佳选择.
本研究首先利用水杨酸和醋酸酐合成阿司匹林,然后用阿司匹林和氯化亚砜合成乙酰水杨酰氯,最后用乙酰水杨酰氯和淀粉合成淀粉-阿司匹林高分子前药[11].反应结束后用紫外分光光度计测定前药中阿司匹林的接入率,并在人工胃液和人工肠液中进行体外释放研究.
1 材料与方法
1.1 仪器与试剂
仪器:SHB-3循环水真空泵,郑州市合众仪器有限公司;DHG-9101-1SA电热恒温鼓风干燥箱,金坛市盛蓝仪器制造有限公司;R201D电热恒温水浴锅,巩义市科华仪器设备有限公司;UV2800紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;ESJ220-4G精密电子分析天平,西安顺智电子科技有限公司;88-1恒温磁力加热搅拌器,苏州市华隆工贸有限公司;透析膜等.
试剂:所用试剂均为分析纯.N,N-二甲基甲酰胺(DMF)、氯化亚砜(SOCl2)、三乙胺(Et3N)、氢氧化钠(NaOH)、浓硫酸、浓盐酸、磷酸二氢钾、乙酸酐、95%乙醇、水杨酸、三氯化铁和饱和碳酸氢钠均产自天津市福晨化学试剂厂;可溶性淀粉产自天津市大茂化学试剂厂;胃蛋白酶和胰蛋白酶产自韩国BIOSHARP公司.
1.2 阿司匹林的合成
阿司匹林的合成参考文献[11,12]的方法,在干燥的100 mL圆底烧瓶中加入12.4 g水杨酸和25.2 g乙酸酐,用滴管缓慢滴加25滴浓硫酸,边滴加边震荡烧瓶,直至水杨酸溶解,在85℃下加热搅拌2 h.反应结束后,冷却至室温,在不断搅拌的情况下,倒入约200 mL蒸馏水,置混合物于冰浴中冷却,以使结晶完全,水解过量的乙酸酐.析出固体后抽滤,用冷水洗涤至弱酸性,抽干,得15.4 g乙酰水杨酸粗产品,产率为95.2%.加入饱和碳酸氢钠溶液,搅拌至无气泡,滤去不溶物,用浓盐酸将滤液调至酸性,并有固体逐渐析出.将烧杯置于冰水浴中充分冷却,使固体析出完全,抽滤,用冷水洗涤至弱酸性,置于80℃烘箱中烘干,得到纯化阿司匹林15 g,检测熔点:135℃.称重后取少量阿司匹林溶于几滴乙醇中,加入0.1 mol·L-1的三氯化铁溶液1-2滴检验,溶液未出现颜色变化.其余产品置于干燥容器中备用.
1.3 乙酰水杨酰氯的制备
用前一步合成的阿司匹林(水杨酸与乙酸酐合成)进行酰氯化反应,如式(1).称取已烘干的阿司匹林3.60 g置于100 mL干燥圆底烧瓶中,向烧瓶中加入5-6滴DMF,控制内温不高于30℃.开启电磁搅拌后缓缓向烧瓶内滴加5 mL氯化亚砜,同时调节磁力加热搅拌器升温至65℃,冷凝回流2 h,关掉冷凝水,蒸出过量的氯化亚砜,TLC(氯仿∶甲醇∶水 =8∶2∶0.2)跟踪,抽滤烘干得3.5 g淡黄色固体,产率为88.2%.
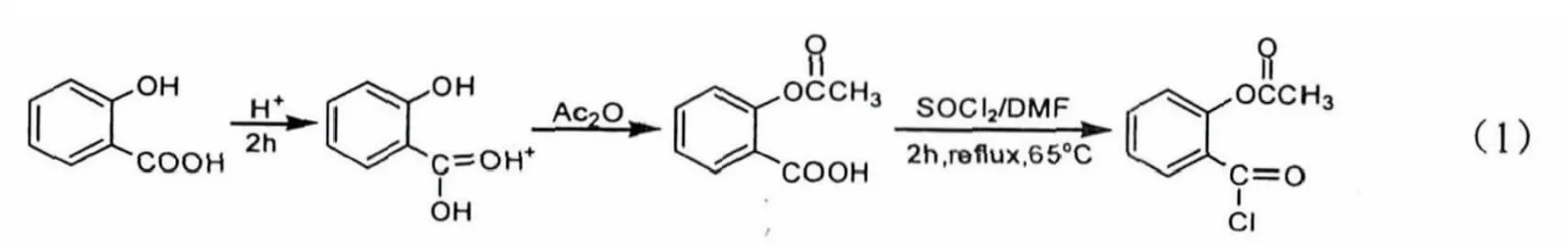
1.4 淀粉—阿司匹林复合物的合成
用上一步合成的乙酰水杨酰氯与淀粉连接,如式(2).在100 mL干燥圆底烧瓶中加入2 g可溶性淀粉和20 mL DMF,在加热条件下电磁搅拌,使其充分溶解形成均相溶液,然后向烧瓶内滴加8滴三乙胺.搅拌条件下将上步反应制好的乙酰水杨酰氯迅速加入到烧瓶中,加完后在80℃下反应7 h.反应完毕得到一糊状液体,冷却至室温后向糊状液体中加入50 mL去离子水,震荡便有浅黄色沉淀析出,将混合物加入到经过预处理的透析袋中透析3 d,最后用少量去离子水洗涤3次,抽滤烘干得到5.1 g浅黄色固体物质,便是淀粉—阿司匹林高分子前药的产品.

1.5 高分子前药中阿司匹林接入率的测定
1.5.1 标准曲线的制作 配制5组不同浓度的水杨酸-0.1 mol·L-1NaOH溶液.5组浓度分别是4、8、12、16、20 mg·L-1,用第5 组配制的水杨酸-0.1 mol·L-1NaOH 溶液在 λ =250-320 nm 之间[13,14],每隔1 nm测定该溶液的吸光度,测得最大吸光度为0.405,所对应的波长为λ=298 nm.然后以0.1 mol·L-1NaOH溶液作参比,在λ=298 nm处用紫外可见分光光度计分别测定各组溶液的吸光度,以浓度C为横坐标,吸光度为纵坐标,绘制标准曲线(图 1).其回归方程为:D298nm=0.0195C+0.0135,其中 R2=0.9968.
1.5.2 复合物中阿司匹林接入率的测定 精密称取纯化复合物0.025 g,置于100 mL的圆底烧瓶中,向圆底烧瓶加入20 mL 0.1 mol·L-1NaOH溶液,加热水解回流2 h.回流结束并将其冷却至室温后转移到50 mL容量瓶中,用0.1 mol·L-1NaOH溶液定容至刻度线.充分摇匀后,用移液枪精密吸取5 mL于50 mL容量瓶中,加入 0.1 mol·L-1NaOH 溶液至 50 mL 刻度线,摇匀.以 0.1 mol·L-1NaOH溶液作参比,在λ=298 nm处测得吸光度并记录.
1.5.3 淀粉—阿司匹林复合物的体外释放研究 (1)淀粉-阿司匹林复合物的称取[1]:称取淀粉—阿司匹林复合物32 mg,备用.

图1 浓度—吸光度标准曲线Fig.1 The standard curve of concentration-absorbance
(2)人工胃液与人工肠液的配制:配制人工胃液和人工肠液各 1000 mL[15].
(3)检测波长的确定:分别以人工胃液和人工肠液为介质,配制一定浓度的水杨酸溶液,利用紫外可见分光光度仪进行全波长扫描(200-400 nm),然后选择其特征吸收峰所对应的波长作为体外释放实验的检测波长.经过测定,在人工胃液中,水杨酸的最大吸收波长为310 nm;而在人工肠液中,水杨酸的最大吸收波长为303 nm.
1.5.4 标准曲线的测定 各称取水杨酸7.5 mg溶于100 mL人工胃液和100 mL人工肠液中,各分别移取溶液 2.5、5.0、10.0、15.0、20.0 mL 于 5 个容量瓶中定容.
分别以人工胃液和人工肠液作参比,利用紫外可见分光光度计分别测定各组溶液D310nm和D303nm.
以浓度C为横坐标,D310nm为纵坐标,绘制标准曲线(图2).其回归方程为:D310nm=0.0213C+0.0946,其中 R2=0.9724.
以浓度C为横坐标,D303nm为纵坐标,绘制标准曲线(图3).其回归方程为:D303nm=0.0131C+0.3907,其中 R2=0.9755.

图2 水杨酸在人工胃液中的标准曲线Fig.2 The standard curve of salicylic acid in artificial gastric juice

图3 水杨酸在人工肠液中的标准曲线Fig.3 The standard curve of salicylic acid in artificial intestinal juice
1.5.5 溶出度测定 分别以人工胃液和人工肠液80 mL为溶出介质,控制其温度为37±0.2℃,磁力搅拌器转速约60 r·min-1.将淀粉—阿司匹林复合物置于人工胃液和人工肠液中,每隔1 h取释放液5 mL,在离心机上离心后,利用微孔滤膜过滤,然后测定其吸光度并计算前药浓度.
2 结果与分析
2.1 复合物的核磁共振氢谱(1H-NMR)分析
从淀粉-阿司匹林复合物的核磁共振氢谱可以看出,淀粉—阿司匹林在DMSO中的核磁共振氢谱化学位移δ:7.95、7.54、7.22、7.09、5.50、5.42、5.11、4.59、3.67、3.59、3.38、2.33 ppm.其中,化学位移δ为:ppm是阿司匹林基氢谱数据,表明目标化合物中阿司匹林基官能团的存在,而化学位移、5.11)ppm是淀粉基氢谱数据.由此可以推断出,本试验成功将阿司匹林连接到淀粉分子上.
2.2 接入率的计算
由吸光度和回归方程,计算出该组溶液的水杨酸浓度C,从而计算出复合物水解出的水杨酸质量M,最后计算出接入率.阿司匹林接入率η按水杨酸计算为:η=M/W×100%,最后求得阿司匹林的接入率为2.62% .
2.3 共价复合物在人工胃液和人工肠液中的释放
由图4和图5可知,共价复合物在人工胃液和人工肠液中均无爆释现象,说明在淀粉上连接阿司匹林分子可以有效控制药物的释放.另外,淀粉—阿司匹林在人工胃液中的零级释放时间比人工肠液中的更长,超过32 h,说明淀粉—阿司匹林共价复合物在人工胃液中具有良好的释放性能,降解速度较慢,这就可以有效控制血药浓度,减小药物对胃和肠的刺激作用[1].
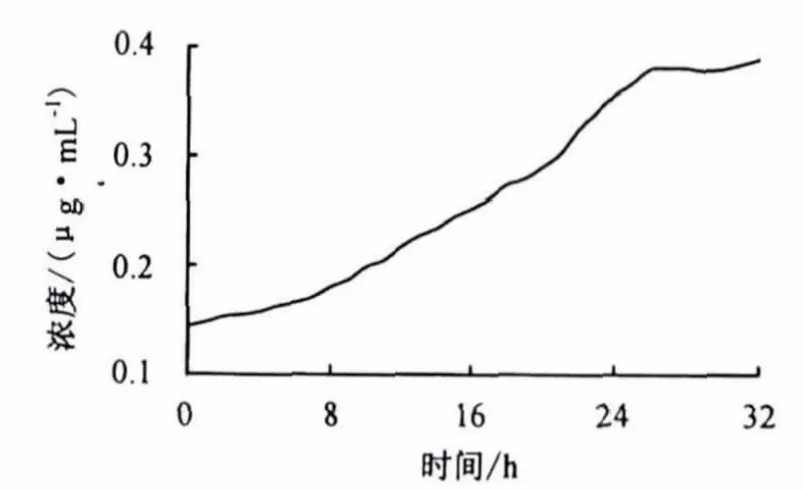
图4 共价复合物在人工胃液中的释放Fig.4 In vitro drug release of the covalent compound in artificial gastric juice
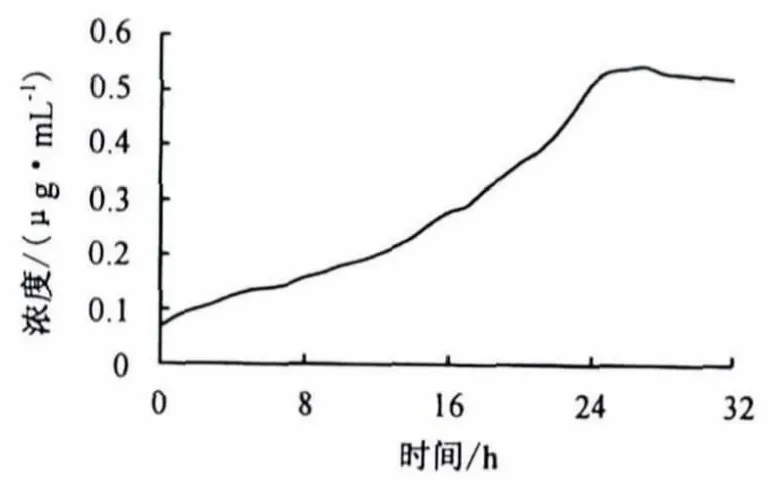
图5 共价复合物在人工肠液中的释放Fig.5 In vitro drug release of the covalent compound in artificial intestinal juice
3 结论
本研究以淀粉和乙酰水杨酰氯为原料合成淀粉—阿司匹林复合物,并对该复合物进行核磁共振氢谱的测定,图谱清晰地表明阿司匹林成功接入到淀粉分子上,通过紫外分光光度计测定表明,淀粉-阿司匹林中阿司匹林的接入率为2.62%,接入率的高低可能与温度有关,同时,接入率也可能会随着乙酰水杨酰氯与淀粉质量比的变化而不同.淀粉—阿司匹林在人工胃液和人工肠液里的释放结果表明,在淀粉上连接阿司匹林分子可以有效减缓药物成分的释放,控制血药浓度,减小药物对胃肠道的刺激作用.对阿司匹林进行结构修饰具有重要的临床意义,可使其充分发挥药用价值,并尽量避免副作用的产生.
[1]王建国.葡萄糖—阿司匹林共价复合物的合成及体外释放研究[D].赣州:赣南师范学院,2009.
[2]华秀芳,金剑,肖忠革,等.阿司匹林的研究进展[J].中华临床医学研究杂志,2005,11(13):1889-1890.
[3]YIBING Y,DAVID R P.Aspirin response and failure in diabetic patients with cardiovascular disease[J].Current Opinion in Pharmacology,2005(5):190-197.
[4]SHEENA S.M,ROBERT J.S,ARTHUR A,et al.Comparison of aspirin resistance in type 1 versus type 2 diabetes mellitus[J].The American Journal of Cardiology,2006,97(4):567-570.
[5]THOMAS F.IMPERIALE M D.Aspirin and theprevention of colorectal cancer[J].The New England Journal of Medicine,2003,348(10):879-880.
[6]DYER O.Aspirin could be used to prevent cancer[J].British Medical Journal,2003,326(5):561-565.
[7]张骁.国外药学进展[J].中国制药信息,2006,22(1):15-16.
[8]温晓娜,毛静怡.非甾体抗炎药的不良反应[J].中国药师,2006,9(10):959-960.
[9]刘春安,袁孟彪.阿司匹林所致胃粘膜损伤的研究近况[J].中华内科杂志,1998,37(8):564-565.
[10]李军婷,李兆申,刘厚环,等.非甾体抗炎药致上消化道出血的临床特征[J].中华消化内镜杂志,2001,18(3):151-154.
[11]苏俊,曾静.阿司匹林—羟乙基纤维素复合物的合成[J].四川化工,2010(5):11-15.
[12]杨锐生,郭建敏,张燕军.阿司匹林丁醇酯的合成[J].齐鲁药事,2010,29(8):491-492.
[13]高文霞.右旋糖酐改性阿司匹林及体外释药研究[D].合肥:合肥工业大学,2005.
[14]姚日生,高文霞,邓胜松,等.右旋糖酐—阿司匹林偶联物的合成[J].精细化工,2005,22(4):205-208.
[15]国家药典委员会.中华人民共和国药典(2010年版2部)[M].北京:中国医药科技出版社,2010.
