南林895杨树GmNHX1基因的转入及其耐盐性分析
2014-12-24孙伟博邓大霞杨立恒诸葛强
孙伟博,邓大霞,杨立恒,诸葛强
(南京林业大学林木遗传与生物技术省部共建教育部重点实验室,江苏南京210037)
盐胁迫是全球范围内影响作物产量最大的非生物胁迫之一,盐胁迫能通过渗透胁迫、离子毒害和离子失衡来抑制植物生长[1].杨树是营造生态公益林和短周期工业原料林的重要树种,采用基因工程手段培育多抗性的速生、丰产、优质杨树新品种,比常规育种更快更容易选育出具有重要经济价值的杨树新品种,是近年来林木遗传改良的重要研究领域[2-4].然而土地盐碱化严重制约了杨树速生林的可持续发展.加强杨树的抗盐机理研究,对加速林业经济的持续发展、进一步改善盐渍土地环境以及对其综合开发利用有重大意义.
土壤中包含很多离子,如Cl-、Na+、K+、Ca2+、、Mg2+和SO2-4等,这些离子在通常情况下作为土壤供给植物的营养成分,而当这些离子的浓度升高到对植物生长产生不良影响时,便会造成离子胁迫而发生盐害[5].在盐渍条件下,对盐胁迫敏感的植物所吸收的多余盐离子主要集中在细胞质中,影响一些酶的活性,因而外界盐度过高就会抑制其生长;而耐盐植物会把吸收的Na+离子通过区域化作用将其贮存在液泡内,从而不受离子的毒害作用[6].GmNHX1基因编码大豆细胞中液泡膜Na+/H+转运蛋白,能够有效地将Na+区隔化至液泡中,减轻Na+造成的毒害[7].本研究采用GmNHX1基因转化南林895杨树,以期了解GmNHX1基因的表达对转基因杨树耐盐性的影响.
1 材料与方法
1.1 供试材料
1.1.1 植物材料 遗传转化受体材料为南林895杨树(Populus deltoides×P.euramericana cv.‘Nanlin895’)叶片再生植株,培养于光照培养室,温度 25 ℃,光强30-45 μmol·m-2·s-1,光周期16 h·d-1.
1.1.2 菌株与载体 试验中所使用的大肠杆菌为DH5α(本实验室保存)和One Shot® ccdB SurvivalTM2T1R Competent Cells(购自Invitrogen公司),农杆菌菌株为EHA105(本实验室保存).
植物表达载体为pGWB402Ω,由岛根大学Tsuyoshi Nakagawa教授惠赠,由Gateway系统的表达载体pGWBs连接2x35s-Ω启动子制备获得.载体图谱如图1所示.
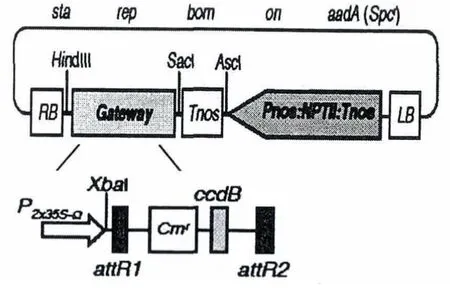
图1 植物表达载体pGWB402Ω图谱Fig.1 Binary vector pGWB402Ω
1.2 方法
1.2.1 载体的构建 利用Invitrogen公司的Gateway技术将耐盐相关基因GmNHX1构建到植物表达载体pGWB402Ω.
1.2.2 GmNHX1基因的遗传转化 采用农杆菌侵染叶盘法介导转化南林895杨树,农杆菌菌株为EHA105.遗传转化条件为:预培养时间3 d,菌液D600nm为0.8,侵染时间15 min,共培养时间4 d.头孢霉素含量在分化期为100 mg·L-1,在生根阶段适度降低,从而保证转化植株的快速生长.卡那霉素在分化阶段的筛选含量为20 mg·L-1,在生根阶段的筛选含量为10 mg·L-1.
1.2.3 转GmNHX1基因的分子检测 选择经卡那霉素抗性筛选获得的转基因植株进行PCR和Southern杂交分子检测.PCR检测:根据转基因植株GmNHX1的片段特异性设计引物(F:3'-ATGGTTTTTGAAATCAGTACTGTTG-5'.R:3'-TCAACGCCATTGATGGCC-5').采用 DIG High Prime DNA Labeling and Detection Starter KitⅠ(Roche公司提供)进行探针的制备及后期的Southern杂交.
1.2.4 转GmNHX1杨树耐盐性分析 试验共获得6个转基因株系,其中N1、N17和N21株系植株样本量充足.选取生长健壮、大小基本一致的未转基因南林895杨树和转GmNHX1基因杨树植株,置于NaCl浓度分别为50、100、150、200和300 mmol·L-1的无菌营养液中,于第15天测定各组杨树叶片的叶绿素相对含量、可溶性蛋白含量、丙二醛(MDA)含量以及保护酶活性等生理指标.采用便携式叶绿素计(SPAD-502)对标记叶片的相对叶绿素含量进行测定,6个重复,每个重复测定30次,取其平均值作为该叶片的相对叶绿素含量.采摘植株上部成熟叶片进行可溶性蛋白(Pr)、MDA含量和保护酶活性的测定.可溶性蛋白质含量采用考马斯亮蓝G-250染色法测定[8].MDA含量采用硫代巴比妥酸(TBA)方法测定[9].按改进的陈建勋等方法[10]进行POD活性的测定.SOD活性采用改良的NBT法进行测定[11].
2 结果与分析
2.1 GmNHX1基因表达载体的构建
LR反应后提取质粒进行检测,在13 kb处有特异性条带,质粒大小符合预测结果(图2).表明经过LR反应,GmNHX1基因已经从入门载体转移到最终的植物表达载体上.为防止假阳性结果对后续试验的干扰,对pGWB402Ω-GmNHX1质粒进行进一步检测.
对重组的含有GmNHX1基因的表达载体进行菌液PCR检测,在1.6 kb处显示有特异性条带,表明GmNHX1基因已连接入最终的植物表达载体中(图3).PCR扩增检测为阳性的重组子经进一步测序验证,结果表明所有测序样品均为阳性.采用Gateway技术快速构建GmNHX1基因的植物表达载体,对南林895杨树进行遗传转化.
2.2 转基因植株的分子检测
对经抗生素筛选为阳性的转pGWB402Ω-GmNHX1南林895杨树植株进行PCR分子检测.从图4可见:在正对照质粒和转基因杨树6个不同株系中扩增得到了目的片段,即 1、2、11、17、21、22 号,而阴性对照没有特异性扩增条带,说明GmNHX1已经成功整合到南林895杨树基因的基因组中.
2.3 PCR阳性植株的Southern检测
实验室克隆质粒的污染及转基因嵌合体的存在,都会造成PCR检测的假阳性结果.因此,对PCR检测为阳性的转基因植株和对照南林895植株在盐胁迫后采用Southern杂交进行检验比对,PCR 检测为阳性的 6 个株系 1、2、11、17、21、22 均表现为阳性(图5),表明GmNHX1基因已转入并整合到南林895杨树基因组中.
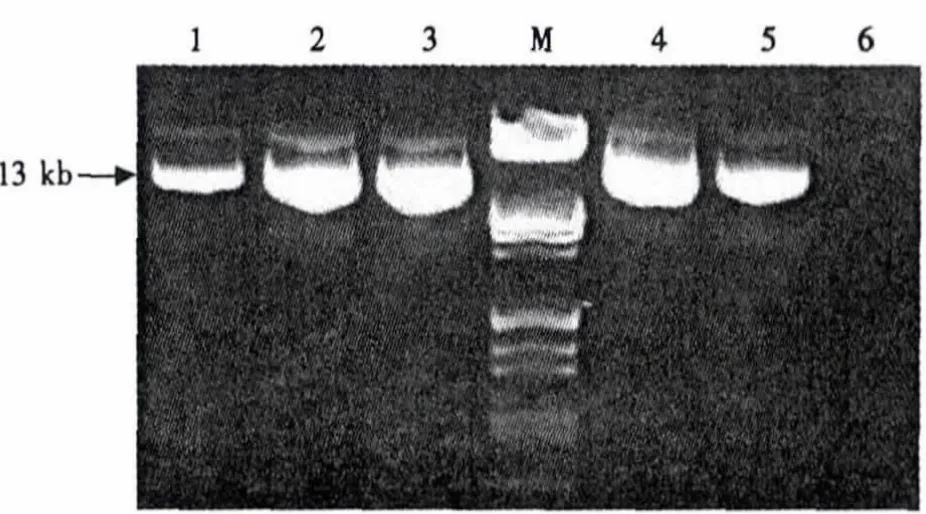
图2 LR反应构建表达载体pGWB402Ω-GmNHX1质粒检测Fig.2 Detection of expression vector pGWB402Ω-GmNHX1 derived from LR reaction
2.4 转GmNHX1南林895杨树耐盐性分析
2.4.1 盐胁迫浓度对转GmNHX1基因杨树植株叶片叶绿素相对含量的影响 叶绿素含量的高低在某种程度上与光合作用有关.由图6可知,随着盐浓度的提高,对照组和转GmNHX1基因组杨树叶片的叶绿素相对含量都逐渐降低,但对照组的降幅比3个转基因株系的大.随着盐胁迫浓度从最低值上升到最高值,CK、N1、N17 和 N21 株系叶绿素相对含量降幅分别为 625.81%、102.72%、87.75%和97.50%,统计分析结果表明,3个转基因组株系与对照组差异显著.300 mmol·L-1盐胁迫下,对照组的叶绿素相对含量仅为转基因植株N1、N17和N21株系的25.94%、25.59%、25.86%,统计分析结果表明,该浓度下转基因植株与对照组差异显著.

图3 LR重组子的PCR检测Fig.3 PCR detection for clones derived from LR reaction

图4 转基因植株GmNHX1基因PCR检测Fig.4 PCR detection of GmNHX1 in transgenic plants
2.4.2 盐胁迫浓度对转GmNHX1基因杨树植株叶片可溶性蛋白含量的影响 在盐胁迫过程中,随着盐胁迫浓度的提高,对照组转基因N1和N21株系杨树叶片的可溶性蛋白含量逐渐降低.可溶性蛋白含量的降低可能与盐胁迫下蛋白质合成受阻有关.而N17叶片可溶性蛋白含量表现为先升高后降低的趋势.总体上看,对照组叶片可溶性蛋白含量的降幅均大于3个转基因株系(图6).除300 mmol·L-1NaCl处理外,其余不同浓度盐胁迫下,3个转基因株系的可溶性蛋白含量均与CK差异显著.
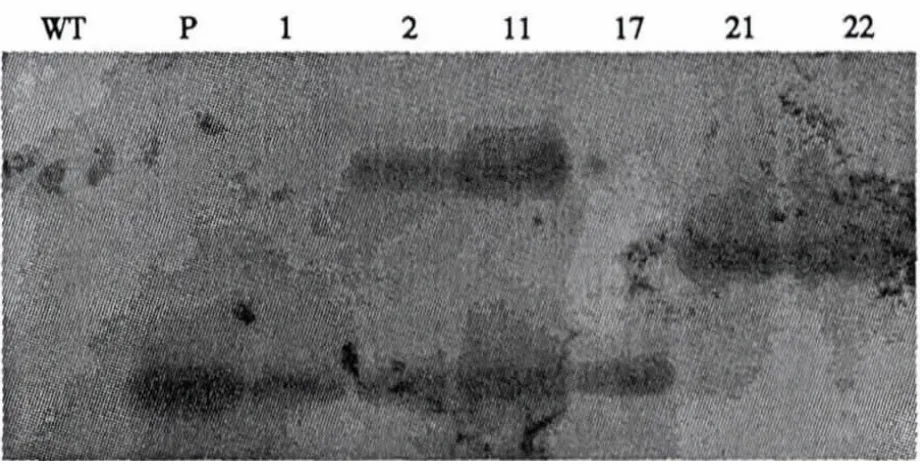
图5 转基因植株Southern杂交检测Fig.5 Southern blot analysis of transgenic plants
2.4.3 不同盐浓度对转GmNHX1基因杨树植株叶片MDA含量、SOD活性和POD活性的影响 从图6可以看出,随着盐胁迫浓度的提高,对照和3个转基因株系杨树叶片的MDA含量逐渐提高,其总体变化趋势与叶绿素相对含量的变化趋势相反.3个转基因株系的MDA含量的增幅比对照组小.150和200 mmol·L-1NaCl盐胁迫下,N1、N17和N21三个株系的MDA 含量分别为 CK 组的 66.27%、69.69%、73.01% 和 70.75%、70.28%、77.20%.统计分析表明,3 个转基因株系的MDA含量均与CK差异显著.3个转基因株系的MDA含量变幅差异不大,300 mmol·L-1NaCl盐胁迫下,转基因株系N1与其他2个转基因株系差异显著.
盐胁迫15 d后各株系的SOD活性均随着盐胁迫浓度的升高而逐渐降低,表现为一定的浓度效应.但随着盐胁迫浓度的升高,3个转基因株系SOD活性的降幅比对照组小(图6).盐胁迫浓度从50 mmol·L-1升高到300 mmol·L-1,对照组植株的SOD活性降幅高达442.41%,而转基因N1、N17和N21株系的降幅仅为114.62%、106.79%和118.64%,表明转基因植株的SOD活性降幅均与对照有显著差异.3个转基因组株系的SOD活性变幅差异不大.

图6 不同浓度NaCl处理对转抗盐基因杨树植株叶片叶绿素相对含量、可溶性蛋白含量、MDA含量、SOD活性和POD活性的影响Fig.6 Effects of different concentrations of salt stress on the chlorophyll relative content,soluble protein content,MDA content,SOD activity and POD activity
对照组和转基因植株的POD活性随着胁迫浓度的升高均表现为先升高后降低的变化趋势,均以100 mmol·L-1盐胁迫处理的活性最高.对照组的峰值较3个转基因株系低,峰型平缓;而转基因植株峰型较陡.与对照组株系相比,在高浓度盐胁迫下转基因植株POD活性降幅减小(图6).50 mmol·L-1盐胁迫下转基因株系与对照差异不显著,其余各种浓度盐胁迫下转基因株系叶片的POD活性均与对照组差异显著.测得的耐盐性各项生理数据表明,与对照组植株相比,转抗盐基因杨树幼苗在盐胁迫下GmNHX1基因得到表达,在一定程度上减轻了盐胁迫对杨树幼苗的毒害作用.
3 小结与讨论
本研究结果表明:随着盐胁迫浓度的提高和胁迫时间的延长,对照植株叶绿素相对含量降幅、可溶性蛋白含量降幅以及MDA含量增幅均低于对照植株;在100-300 mmol·L-1浓度下,转基因植株的POD活性变化与对照植株有显著差异.本研究结果还表明:转抗盐基因杨树植株在盐胁迫下诱导GmNHX1的表达,同样能够提高杨树植株的抗盐能力;而转基因植株个体间耐盐性的表达水平有差异,可能与外源基因的插入位点及调控方式不同有关.
[1]梁慧敏,夏阳,王太明.植物抗寒冻、抗旱、耐盐基因工程研究进展[J].草业学报,2003,12(3):1-7.
[2]卢孟柱,胡建军.我国转基因杨树的研究及应用现状[J].林业科技开发,2006,20(6):1-4.
[3]饶红宇,黄敏仁.杨树基因工程研究的现状及展望[J].林业科技开发,1999,18(4):3-6.
[4]陶晶,秦彩云,姚露贤.杨树耐盐突变体育种研究进展[J].吉林林业科技,2000,29(2):5-8.
[5]陈少良,李金克,等.盐胁迫条件下杨树组织及细胞中钾、钙、镁的变化[J].北京林业大学学报,2002,24(5/6):84-88.
[6]APSE M P,AHARON G S,SNEDDEN W A,et al.Salt tolerance conferred by overexpression of a vacuolar Na+/H+antiporter in Arabidopsis[J].Science,1999,285(5431):1256-1258.
[7]LI W Y F,WONG F L,TSAI S N,et al.Tonoplast-located GmCLC1 and GmNHX1 from soybean enhance Nacl tolerance in transgenic bright yellow(BY)-2 cells[J].Plant,Cell and Environment,2006,29(6):1122-1137.
[8]BRADFORD M M.A dye binding assay for protein[J].Ana Biochem,1976,72(7):248-254.
[9]CAKMAK I,HORST J H.Effects of aluminum on lipid peroxidation,superoxide dismutase,catalase,and peroxidase activities in root tips of soybean(Glycine max)[J].Physiologia Plantarum,1991,83(3):463-468.
[10]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2002:121-122.
[11]SEN G A,WEBB R P,HOLADAY A S,et.al.Overexpression of superoxide dismutase protects plants from oxidative stress[J].Plant Physiol,1993,103(4):1067-1073.
