加速溶剂萃取-高效液相色谱-串联质谱联用测定莱州湾海水养殖区野生鱼肌肉中19 种抗生素及2 种磺胺代谢产物残留
2014-12-24刘思思陈景文赵洪霞
刘思思, 杜 鹃, 陈景文, 赵洪霞
(工业生态与环境工程教育部重点实验室,大连理工大学环境学院,辽宁 大连116024)
抗生素是一类对细菌、真菌、支原体、衣原体等致病微生物具有抑制或杀灭作用的天然、半合成或完全人工合成的药物,被广泛用于临床医疗、畜牧和水产养殖等行业。我国是抗生素生产和使用大国,2009 年产量已达14.7 万吨[1]。我国也是水产养殖大国,水产养殖总产量占全世界的61.4%[2]。养殖过程中,大量的抗生素被作为生长促进剂添加到饲料中来促进动物的生长发育,提高产量,而海水养殖排出的污水往往未经处理直接排入大海,造成严重的抗生素污染。迄今已有约68 种抗生素在我国的地表水环境中被检出[3]。由于其“假持久性”,这些抗生素进入环境后,易残留在动物源性食品中,有潜在的生态风险。已有研究表明,磺胺类等抗生素会导致许多细菌产生耐药性[4],且具有潜在的致癌性[5]。因此监测水生生物体内抗生素残留对生态风险评价及食品安全具有重要意义。
目前,国内外对生物样品中抗生素的前处理方法主要有超声辅助萃取[6]、酶联免疫法[7]、加压溶剂萃取(ASE)[8-10]等,样品再经固相萃取柱富集净化。超声辅助萃取法提取效率高、省时、能耗低等优点,但重复性较差。酶联免疫法基于抗原抗体特异性原理,简单、快速、灵敏、特异性强,但不适合用于多种抗生素残留检测,且容易出现假阳性。ASE 法能在较高的温度和压力下选择合适的溶剂,高效、快速地萃取固体或半固体样品中的待测物。与传统萃取技术相比,ASE 技术具有萃取效率高、萃取时间短、所需溶剂用量少等优点,且被美国环境保护署(EPA)选定为推荐的标准方法。液相色谱-串联质谱法(LC-MS/MS)由于具有选择性高、灵敏度高等特点,已成为目前国内外抗生素检测的常用方法[11-14]。厉文辉等[15]采用ASE-LC-MS/MS 方法对鱼肉中喹诺酮、磺胺和大环内酯类抗生素进行了分析,但其前处理方法仍较为繁琐。国内外关于鱼肉中多种抗生素残留的分析方法还有待研究。因此,本文建立了一种快速简便的鱼肌肉中多种抗生素残留的HPLC-MS/MS 检测方法,样品经ASE 萃取后只需进行冷冻离心去除极性脂肪等杂质即可直接进行分析,省去了样品前处理中的净化步骤,不仅提高了样品处理的通量,还减小了由于操作过程中的错误和可变因素而带来的误差。
1 实验部分
1.1 仪器与试剂
高效液相色谱-三重四极杆质谱联用仪(LC1100-6410B,美国Agilent 公司);加速溶剂萃取仪(ASE 350,美国Dionex 公司);聚丙烯离心管(30 mL,美国Nalgene 公司);马弗炉(4-10,沈阳市节能电炉厂);台式高速冷冻离心机(德国Thermo 公司);氮吹仪(HGC-12,天津市恒奥科技发展有限公司)。
磺胺嘧啶(sulfadiazine)、磺胺噻唑(sulfathiazole)、磺胺吡啶(sulfapyridine)、磺胺甲嘧啶(sulfamerazine)、甲氧苄氨嘧啶(trimethoprim)、乙酰磺胺吡啶(N-4-acetyl-sulfapyridine)、磺胺二甲嘧啶(sulfadimidine)、磺 胺 甲 恶 唑(sulfamethoxazole)、乙酰磺胺甲恶唑(N-4-acetyl-sulfamethoxazole)、磺胺地索辛(sulfadimethoxine)、磺胺氯哒嗪(sulfachlorpyridazine)、依诺沙星(enoxacin)、左氧氟沙星(levofloxacin)、诺氟沙星(norfloxacin)、恩诺沙星(enrofloxacin)、罗红霉素(roxithromycin)、林可霉素(lincomycin)、利福平(rifampicin)、喹乙醇(olaquindox)(纯度均99.9%)、D4-磺胺甲恶唑(D4-sulfamethoxazole,100 ng/μL)均购自德国Dr. Ehrenstorfer 公司;阿奇霉素(azithromycin,纯度98%)购自英国Fluorochem 公司;克拉霉素(clarithromycin,纯度98%)购自上海TCI 公司。
甲醇和乙腈均为色谱纯,购自美国Tedia 公司;甲酸为分析纯,购于天津市科密欧化学试剂有限公司;甲酸铵为分析纯,购自国药集团化学试剂有限公司;硅藻土(美国Dionex 公司)于450 ℃焙烧3 h,置于干燥器内备用;C18 填料(平均粒径50 μm,孔径6 nm,碳载量17%;济南博纳生物技术有限公司)使用前浸泡在甲醇中3 h 以上,最后用氮气吹干。超纯水(18.2 MΩ·cm,25 ℃)由HealForce 系统(上海力康仪器有限公司)制备。
1.2 标准溶液的配制
标准储备溶液:准确称取标准品0.010 0 g,用甲醇溶解并定容到10 mL 棕色容量瓶中,配制成1 000 mg/L 的标准储备溶液,在-18 ℃下避光保存(3 个月内使用)。
标准工作溶液:分别取上述标准储备液适量,用甲醇定容至10 mL,配制成已知浓度的中间标准工作溶液。用1.4 节中的初始流动相稀释成系列浓度的混合标准工作液,密封于4 ℃下保存备用。
1.3 样品前处理
将新鲜样品解剖、去皮,取背部肌肉剪碎后,准确称取1.000 g 肌肉样品,加入适量预萃取过的硅藻土,研磨混匀;萃取池(10 mL)底部铺上2.000 g的C18 填料,将混匀好的样品填入萃取池,并加入50 ng 回收率指示物D4-磺胺甲恶唑;设置的萃取条件:压力10 477.5 kPa,温度70 ℃,静态萃取时间5 min,冲洗溶剂体积为池容积的60%,氮气吹扫时间120 s,静态循环2 次。将萃取池置于ASE 350 上进行加温加压萃取。将收集的萃取液转移至30 mL离心管内,在-4 ℃、15 000 r/min 条件下离心20 min,取上层清液并在40 ℃水浴下氮吹至近干,加入初始流动相溶解、定容至1 mL 后待测。
1.4 仪器分析
色谱柱为Xterra MS C18 (100 mm×2.1 mm,3.5 μm);0.1% (v/v)甲酸水溶液(含0.1% (v/v)甲酸铵)为流动相A,甲醇-乙腈(1∶1,v/v)为流动相B;流速0.3 mL/min;梯度洗脱条件:0 ~30 min,5% B ~88% B;柱温:40 ℃。
质谱条件:分析物在电喷雾离子源正离子(ESI+)扫描下以多反应监测(MRM)模式分析;优化的质谱参数见表1。其他优化的质谱参数:辅助气压力(N2)为8 L/min;雾化气压力为172.4 kPa;气化温度为350 ℃;电喷雾电压为4 000 V(+/ -)。

表1 19 种抗生素及2 种磺胺代谢产物优化的串联质谱参数Table 1 Optimized MS/MS parameters of the 19 antibiotics and 2 sulfonamide metabolites
1.5 质量保证与质量控制
所有玻璃器皿用自来水超声清洗30 min,用自来水清洗干净后,再用去离子水洗3 次,烘干后依次用二氯甲烷、丙酮、甲醇各洗2 次,待溶剂挥发完全后置于马弗炉中于450 ℃下烧3 h,自然冷却后取出待用。
样品在提取前添加回收率指示物标准品,以控制整个样品前处理过程的回收率,指示物的回收率范围为65.4% ~78.9% 。同时进行方法空白、基质加标、基质加标平行样及样品平行样的测定,以进行质量控制与质量保证。
在每批样品进行仪器分析前,用空白溶剂和已知浓度标准样品检查仪器的灵敏度和稳定性,同一标准样品测定的误差小于20% 方可进行样品测定,否则需对仪器进行调试[16]。
为了保证目标化合物识别的准确性,采用如下2 个标准:(a)色谱保留时间在标准品保留时间的0.75 min 之内;(b)信噪比(S/N)大于3∶1[17]。
2 结果与讨论
2.1 标准曲线、方法空白、回收率及检出限
21 种目标化合物标准样品的色谱图如图1 所示,由此可见在本文建立的色谱条件下,大多数目标化合物都有较好的分离。对1.25 ~5 000 μg/L 5 个质量浓度梯度的标准溶液中的目标化合物分别建立标准曲线,结果见表2。21 种目标化合物标准曲线的相关系数(r2)均在0.991 以上,说明各目标化合物在考察的质量浓度范围内都有良好的线性关系。
加标基质(为了模拟真实的生物基质环境,本实验以本实验室饲养的条件可控的鲤鱼肌肉组织作加标基质)中,左氧氟沙星、诺氟沙星、依诺沙星有检出。在本实验条件下,采用重复萃取1 遍的鲤鱼肌肉组织(仍有少量检出)作空白基质,连续分析7次,计算其标准偏差(SD);根据国际纯粹和应用化学联合会(IUPAC)对检出限(LOD)和定量限(LOQ)的定义[18],得到21 种目标物的LOD 和LOQ 分别为0.003 ~0.6 ng/g 和0.01 ~2.02 ng/g(见表2),表明方法有较高的灵敏度。
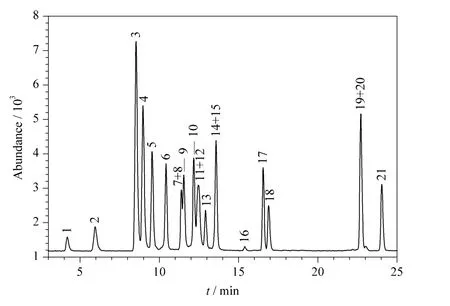
图1 21 种目标分析物混合标准溶液的色谱图Fig.1 Chromatogram of standard solution of the 21 target compounds
采用本实验室条件可控的鲤鱼肌肉组织按照低、中、高3 个添加水平进行加标回收测定,平行测定6 次,测定结果经空白校正,结果见表3。实验结果表明,该方法具有较好的准确度与精密度,低、中、高3 个添加水平的方法回收率(n =6)分别为55.2% ~110.7%、55.3% ~112.8%、60.6% ~113.3%,相对标准偏差(RSD)分别为0.1% ~17.6%、1.9% ~14.5%、2.3% ~13.5%。其中,ENX、ENR、AZI 和OLA 的加标回收率偏低。已有研究表明,喹诺酮类抗生素的吸附能力较强[15],而大环内酯类抗生素具有较强的亲脂性[19],因此推断原因可能是基质影响干扰了其萃取过程。类似结果在前人研究[20,21]中已有报道。

表2 21 种目标物的线性范围、相关系数、检出限和定量限Table 2 Linear ranges,r2,LODs and LOQs of the 21 analytes

表3 鱼肌肉中21 种目标物质的加标回收率及精密度(n =6)Table 3 Recoveries and relative standard deviations (RSDs)of the 21 analytes spiked in fish muscle samples (n =6)
2.2 实际样品分析
使用本文建立的方法对2014 年3 月莱州湾某海水养殖区内采集的两种野生海鱼(矛尾复虾虎鱼(Synechogobius hasta)和梭鱼(Liza haematocheilus))肌肉样品进行定量分析。结果表明,有6种抗生素被检出(经空白校正);而喹诺酮类抗生素在鱼体内的残留水平和检出频率(3/3)均较高,其中诺氟沙星的平均含量分别高达67.01、27.58 ng/g(见表4)。与其他近海海域抗生素在海洋生物体内的残留水平[22]相比,该区域的鱼体内抗生素残留水平较高。尽管其残留水平较低,但考虑其长期和大规模的使用,抗生素对海洋生态系统的影响仍不容忽视。

表4 两种海鱼肌肉中抗生素含量及检出频率(n =3)Table 4 Contents and frequencies of detected antibiotics in the muscles from two kinds of fish (n =3)
3 结论
本文采用池内同步净化的ASE 技术,建立了一种快速简便的鱼肌肉中多种抗生素残留的HPLCESI-MS/MS 分析方法。该方法具有良好的回收率、重现性和较高的灵敏度,为进一步研究抗生素的暴露水平和环境行为奠定了基础。采用该方法对莱州湾海水养殖区内采集的鱼类样品进行分析发现,有6 种抗生素被检出,喹诺酮类抗生素在鱼体内的残留水平较高。
[1] Li Z X,Tian B K,Zuo J E,et al. Environmental Engineering(李再兴,田宝阔,左剑恶,等. 环境工程),2012,30(2):72
[2] Food and Agriculture Organization of the United Nations(FAO). The State of World Fisheries and Aquaculture 2012.Rome:FAO Fisheries and Aquaculture Department,2012:27
[3] Wang D,Sui Q,Zhao W T,et al. Chinese Science Bulletin(王丹,隋倩,赵文涛,等. 科学通报),2014,59(9):743
[4] Gao P P,Mao D Q,Luo Y,et al. Water Res,2012,46(7):2355
[5] Willmott A,McCombie A,Rossleigh M. Intern Med J,2011,41(Suppl 3):25
[6] Sun W H,Leng K L,Wang Z J,et al. Food Science (孙伟红,冷凯良,王志杰,等. 食品科学),2009,30(24):294
[7] Zhou Q,Peng D P,Wang Y L,et al. Food Chem,2014,154:52
[8] Yu H,Tao Y F,Chen D M,et al. J Chromatogr B,2012,885:150
[9] Tao Y F,Yu G,Chen D M,et al. J Chromatogr B,2012,897:64
[10] Gentili A,Perret D,Marchese S,et al. J Agric Food Chem,2004,52(15):4614
[11] Yang C Q,Wang L X,Hou X H,et al. Chinese Journal of Chromatography (杨常青,王龙星,侯晓虹,等. 色谱),2012,30(8):756
[12] Meng J,Yang Y H. Chinese Journal of Food Hygiene (孟娟,杨永红. 中国食品卫生杂志),2012,24(6):546
[13] Gong Q,Ding L,Zhu S H,et al. Chinese Journal of Chromatography (龚强,丁利,朱绍华,等. 色谱),2012,30(11):1143
[14] Ding Y J,Zhang W H,Gu C,et al. J Chromatogr A,2011,1218(1):10
[15] Li W H,Shi Y L,Gao L H,et al. Journal of Instrumental Analysis (厉文辉,史亚利,高立红,等. 分析测试学报),2010,29(10):987
[16] Zhao H,Meng X Z,Xiang N,et al. Environmental Chemistry (赵恒,孟祥周,向楠,等. 环境化学),2012,31(5):573
[17] Zhu L Y,Hites R A. Environ Sci Technol,2006,40(12):3711
[18] IUPAC. Pure Appl Chem,1976,45(2):107
[19] Runnqvist H,Bak S A,Hansen M,et al. J Chromatogr A,2010,1217(16):2447
[20] Carretero V,Blasco C,Picó Y. J Chromatogr A,2008,1209(1/2):162
[21] Pecorelli I,Galarini R,Bibi R,et al. Anal Chim Acta,2003,483(1/2):81
[22] Na G S,Fang X D,Cai Y Q,et al. Mar Pollut Bull,2013,69(1/2):233
