多壁碳纳米管固相萃取净化-高效液相色谱法测定猪肉和鸡肉中的磺胺多残留
2014-12-24赵海香刘海萍闫早婴
赵海香, 刘海萍, 闫早婴
(河北北方学院应用化学研究所,河北 张家口075000)
磺胺类药物(sulfonamides,SAs)是指具有对氨基苯磺酰胺结构的一类人工合成抗菌药物,在动物饲养和水产养殖过程中被广泛应用[1]。SAs在动物体内作用和代谢时间较长,可造成SAs在动物可食性组织中残留,而长期食用就可能引起SAs在体内的蓄积,对健康有害[2]。为了保证消费者的安全,我国及许多国家规定了SAs的最大残留限量(MRL),即在动物源食品中SAs总量不超过0.10 mg/kg[3]。因此,建立简单有效的SAs多残留检测方法具有重要意义。
SAs多残留测定常经固相萃取(SPE)[4-6]和基质固相分散萃取(MSPD)[7-10]净化处理后,采用HPLC-MS/MS[5,10]、超 高 效 液 相 色 谱-串 联 质 谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)[7,11]、HPLCPDA[4,6]或HPLC-UV[8,9]测定。常用的净化吸附剂有HLB[4,5]、氨基(NH2)吸附剂[6,7]、PSA(N-丙基乙二 胺)[8]、C18[8]、硅 胶 固 载 离 子 液 体[9]和 碳 纳 米管[12,13]等,其中碳纳米管(CNTs)是一种新的以碳为基础的纳米材料,具有多孔、疏水表面和封闭面状π电子系,通过发生π-π 和疏水相互作用对其他化合物具有很强的吸附能力和较大的吸附容量,是一种较为理想的吸附材料[14]。CNTs对水样品中SAs(如磺胺甲恶唑、磺胺嘧啶)具有强烈的吸附作用[15-17],吸附效果好于C18[17]。Fang等[1]报道了以CNTs作为吸附剂的在线固相萃取-HPLC 同时测定鸡蛋和猪肉中10种SAs多残留的方法。最近报道了采用磁性多壁碳纳米管(MWCNTs)作为吸附剂的SPE净化鸡蛋样品中7种SAs残留的方法[12],以及采用分散固相萃取(DSPE)方法测定猪肉中18种SAs的方法[13]。MWCNTs性质与C18相似,属于非极性材料,但吸附能力更强[17],价格更低。本文以p Ka值为5~10.4的多种SAs为分析物,用MWCNTs SPE 柱净化样品,有效消除了基质效应,提高了方法的灵敏度,同时降低了分析成本。
1 实验部分
1.1 仪器、试剂和材料
Agilent 1100高效液相色谱仪(美国Agilent公司),配紫外检测器(UV)、G1313 型自动进样器、Chemstations色谱工作站;固相萃取装置(Supelco公司);RE-52旋转蒸发仪(上海振捷实验设备有限公司);3K-30冷冻离心机(Sigma公司);WH-861涡混合仪(太仓科教器材厂);MTN-2800 氮吹仪(天津奥特赛恩斯仪器有限公司)。
磺胺嘧啶(SDZ)、磺胺甲基嘧啶(SMR)、磺胺二甲基嘧啶(SMTZ)、磺胺间甲氧嘧啶(SMM)、磺胺邻二甲氧嘧啶(SDX)、磺胺甲恶唑(SMZ)、磺胺喹恶啉(SQX)、磺胺间二甲氧嘧啶(SDM)、胺苯磺胺(SA)、磺胺噻唑(STZ)、磺胺吡啶(SPD)和磺胺甲噻二唑(SMT)等磺胺对照品(纯度≥98.5%,美国Sigma公司);甲醇、丙酮、二氯甲烷、乙酸乙酯和乙腈为色谱纯(德国Fluka公司);其余试剂均为国产分析纯,水为二次蒸馏水。
准确称取各种磺胺类药物标准品各10.0 mg,置于10 mL棕色容量瓶中,用甲醇溶解并定容至刻度,混匀,配成1 000 mg/L 的标准储备液,-20 ℃避光存放,有效期6个月。准确量取磺胺类药物标准储备液各0.5 mL,用甲醇定容至10 mL,配制成50 mg/L的磺胺类药物混合标准储备液,再用流动相稀释成0.010~1.00 mg/L 的混合标准工作液,存放在2~8 ℃冰箱中备用,有效期6个月。
多壁碳纳米管(L-MWNT-2040),外径20~40 nm,长度5~15μm,表面积40~300 m2/g,纯度>95%,购于深圳纳米港公司。120 ℃下烘干2 h,干燥器中冷却备用。称取250 mg MWCNTs于6 mL固相萃取空柱管中,放置上下筛板,控制填装高度以保证其在一定的压力下具有0.5 mL/min的流速。
猪肉和鸡肉随机购于本地市场或超市。猪肉样品、鸡肉样品去皮后采用组织捣碎机搅碎、混匀,置于4 ℃保存备用。不能及时分析时应冷冻保存。
1.2 样品前处理方法
1.2.1 提取
称取匀浆后的样品(5±0.05)g,置于50 mL离 心 管 中;依 次 加 入15 mL 乙 腈 和4 g 无 水Na2SO4;涡旋混合提取1 min,超声提取5 min;以5 000 r/min离心5 min,上清液转移至另一50 mL离心管中;重复提取一次,合并上清液;加入10~15 mL正己烷脱脂;在5 000 r/min下离心5 min,弃去正己烷层,剩余提取液转移至梨形瓶中;于50 ℃浓缩至近干,待净化。
1.2.2 MWCNTs SPE净化
采用5 mL洗脱液丙酮-二氯甲烷(1∶1,v/v)、5 mL甲醇、5 mL pH6.0的NaH2PO4缓冲溶液活化MWCNTs SPE 柱。活化过程注意使MWCNTs SPE柱保持液面湿润。向1.2.1节提取液中加入5 mL pH6.0的NaH2PO4缓冲液,涡旋混匀,上样到MWCNTs SPE柱上;用5 mL pH6.0的NaH2PO4缓冲液洗涤蒸馏瓶,然后也上样到MWCNTs SPE柱上;弃掉流出液,真空抽干5 min;用5 mL 5%(v/v)丙酮-正己烷淋洗,弃掉淋洗液;用10 mL 丙酮-二氯甲烷(1∶1,v/v)溶液洗脱,收集洗脱液于10 mL离心管中;加入0.1 mL 乙二醇,在N2下吹至0.1 mL;加入0.9 mL 流动相,混匀;取适量溶液过0.22μm 液膜,进行HPLC-UV 分析。
1.2.3 液相色谱条件
色谱柱:Agilent ODS-C18(250 mm×4.6 mm,5μm);流动相:50 mmol/L NaH2PO4-乙腈(7∶3,v/v);流速:0.70 mL/min;紫外检测波长:270 nm;柱温:30 ℃;进样量:50μL。
2 结果与讨论
2.1 HPLC-UV 方法的建立
由于12种磺胺类药物的p Ka值在5~10.4之间,酸碱性不同,流动相的pH 值对磺胺类药物的保留时间和分离影响很大[18],应注意选择流动相的pH。研究选取的流动相体系包括乙腈-磷酸-水、甲醇-甲酸-水、甲酸-乙腈、甲醇-磷酸盐缓冲液、乙腈-磷酸盐缓冲液。为了有效改善色谱峰拖尾,从而改善SMR 和SMTZ、SMZ 和SDX 的分离,最后确定流动相为50 mmol/L NaH2PO4-乙腈(7∶3,v/v)溶液。利用NaH2PO4溶液对pH 的缓冲能力,保持pH 的相对稳定,12种SAs分离情况见图1。
2.2 MWCNTs净化条件的优化
2.2.1 pH 的影响
磺胺类药物难溶于水,但是一般在弱酸或弱碱溶液中易溶,且12种磺胺类药物p Ka值在5~10.4之间,酸碱性差别较大,因此选择pH4.5~7.5 的NaH2PO4缓冲溶液进行研究,选择出适宜的pH 溶液作为上样溶液。研究了0.5 mg/L 的12 种磺胺混合标准溶液在pH4.5~7.5的NaH2PO4缓冲溶液中的溶解性,实验采用乙酸乙酯萃取、HPLC-UV法测定,结果如图2所示。在pH5.5~6.0范围内,除了SA、SPD、SMR 外,其余9种磺胺类药物的萃取回收率均大于70%。分析其原因,可能是SA(p Ka10.4)在弱酸性水溶液中的溶解度较大,导致乙酸乙酯萃取回收率较低;而SMR(p Ka8.0)和SPD(p Ka8.5)在中性和弱碱性溶液中溶解度较低。最终确定缓冲溶液的pH 为5.5~6.0。
2.2.2 洗脱条件的优化

图1 12种磺胺药物经MWCNTs SPE净化的HPLC-UV 色谱图Fig.1 HPLC-UV chromatograms of the 12 SAs after MWCNTs SPE clean-up
首先考察了单一溶剂对SPE柱上12种磺胺的洗脱效率,结果如图3所示。乙酸乙酯、二氯甲烷、丙酮和甲醇这4种溶剂的洗脱效果相近,9种药物的回收率在60%~80%之间,不能够完全满足残留分析的要求;SMR 和SQX 的回收率较低,低于10%;SPD 的回收率低于50%。对上样流出液和淋洗液中的磺胺进行测定,没有检测到SMR、SPD 和SQX,因此这3 种分析物不存在穿漏和淋洗损失。结合2.1节的结果分析,SMR 和SPD 在此pH 值下溶解性较小,可能导致回收率低;SQX 可能与多壁碳纳米管的吸附作用强,不易被洗脱所致。

图2 不同pH 条件下12种磺胺类药物的乙酸乙酯萃取回收率(0.5 mg/L)Fig.2 Recoveries of the 12 SAs(0.5 mg/L)at different pHs with ethyl acetate extraction
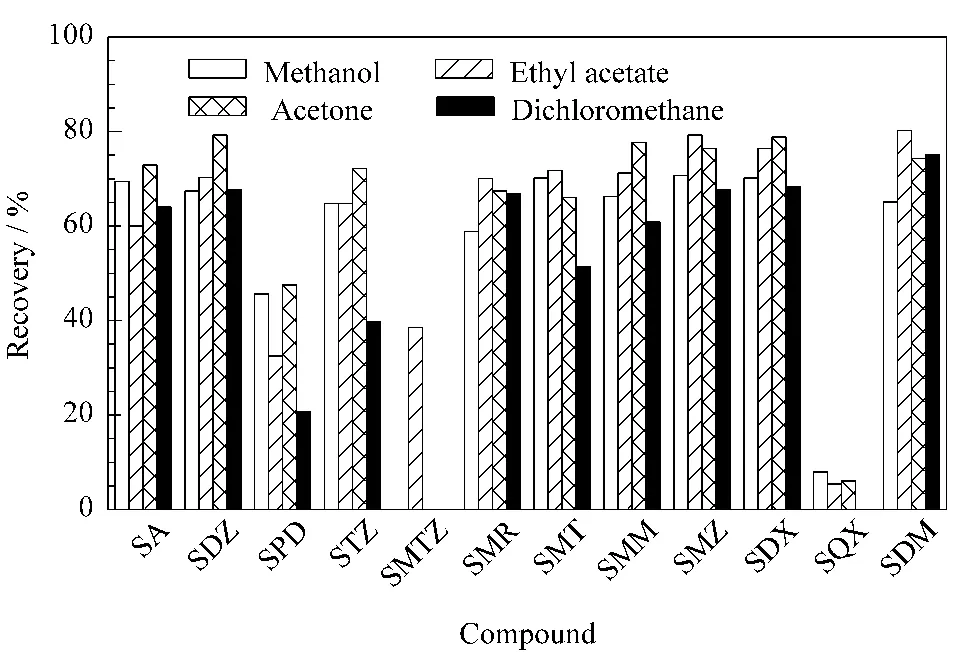
图3 4种单一有机溶剂作为洗脱剂时MWCNTs SPE柱上12种磺胺药物的回收率(0.5 mg/L)Fig.3 Recoveries of the 12 SAs(0.5 mg/L)on MWCNTs SPE cartridge with four single organic solvent as the elution solvent
为了获得理想的回收率,进一步考察了混合二元溶剂对MWCNTs SPE柱上0.5 mg/L的12种磺胺类药物的洗脱效果。由于甲醇作洗脱溶剂时干扰色谱峰较多,所以未使用甲醇。所选二元体系包括丙酮-乙酸乙酯(1∶1,v/v)、二氯甲烷-乙酸乙酯(1∶1,v/v)和丙酮-二氯甲烷(1∶1,v/v),结果见图4。除了SPD、SMR 和SQX 外,其余9种磺胺类药物的回收率在70%~90%之间,满足残留分析的要求。比较图3和图4可以看出,混合溶剂的洗脱回收率高于单一溶剂,对于低回收率的化合物SA、SDZ和STZ,丙酮-二氯甲烷(1∶1,v/v)的洗脱回收率较高。但图4 中SQX 的洗脱回收率均低于30%,可能的原因是其被MWCNTs强烈吸附而难于洗脱;SMR 和SPD 回收率较低的原因可能是其在pH6.0的NaH2PO4缓冲溶液中溶解度较低。综合考虑选择丙酮-二氯甲烷(1∶1,v/v)为洗脱溶剂,同时测定了9种磺胺类药物,各药物的回收率均能够满足残留分析的要求。综合以上实验结果,优化的净化条件如1.2.2节所述,研究表明影响磺胺类药物在MWCNTs SPE柱上吸附和洗脱的主要因素为酸碱性、在水中的溶解性和与MWCNTs的相互作用。

图4 混合溶剂(1∶1,v/v)对12种磺胺药物的洗脱效果图(0.5 mg/L)Fig.4 Elution effect of the 12 SAs(0.5 mg/L)with the mixed solvents(1∶1,v/v)
2.3 检出限、定量限和添加回收率
依据上述实验确定的提取、净化和HPLC-UV测定条件,根据S/N=3确定9种磺胺类药物的检出限为0.003 mg/L,根据S/N =10确定其定量限为0.01 mg/L。方 法 的 线 性 范 围 为0.01~1.0 mg/L,线性相关系数r2≥0.998。对猪肉和鸡肉样品进行添加回收率试验,分别添加3个水平,每个水平重复6次测定,回收率结果见表1,9种磺胺药物的添加回收率满足残留分析的要求(74.2%~89.2%)。净化效果图见图1,从色谱图可见分析物基本无干扰,净化效果较好,原因可能是SAs与MWCNTs除了表面吸附作用外,SAs具有的苯环和五元环或六元环结构,与MWCNTs的π 电子体系易形成π-π 共轭作用,因此MWCNTs对SAs药物具有较好的吸附能力,回收率高、净化效果较好。

表1 HPLC-UV 测定9种磺胺类药物的添加回收率和相对标准偏差(n=6)Table 1 Recoveries and relative standard deviations(RSDs)of the nine SAs in spiked samples determined by HPLC-UV with MWCNTs SPE(n=6)
3 结论
采用MWCNTs作为SPE 吸附剂搭建反相净化体系,建立了猪肉、鸡肉样品中多种SAs兽药残留的HPLC-UV 测定方法。净化效果较好,表明MWCNTs SPE是一种具有较好应用前景的动物组织样品残留物的净化柱;且MWCNTs SPE 柱的价格比常用的C18 SPE柱低,可降低分析成本。但对于种类繁多的SAs,由于受到药物酸碱性的影响,MWCNTs SPE柱在反相体系中难以在一个pH 值下同时分析p Ka范围较宽的SAs。因此MWCNTs SPE柱对SAs的应用还需要进行更多的探索,比如采用正相分析体系,减少酸碱性的影响等。
[1] Fang G Z,He J X,Wang S.J Chromatogr A,2006,1127(1/2):12
[2] Diaz T G,Cabanillas A G,Salinas F.Anal Lett,1990,23(4):607
[3] Shao B,Dong D,Wu Y N,et al.Anal Chim Acta,2005,546(2):174
[4] Guo M M,Li Z X,Tan Z J,et al.Progress in Fishery Science(郭萌萌,李兆新,谭志军,等.渔业科学进展),2010,31(5):97
[5] Ma L L,Guo C S,Hu W,et al.Chinese Journal of Analytical Chemistry(马丽丽,郭昌胜,胡伟,等.分析化学),2010,38(1):21
[6] Zhang Y,Wu Y L.Chinese Journal of Chromatography(张艳,吴银良.色谱),2005,23(6):636
[7] Li F G,Su M,Li X Y,et al.Chinese Journal of Chromatography(李锋格,苏敏,李晓岩,等.色谱),2011,29(2):120
[8] Kang M J,Song G,Wang F F.Dairy Industry China(亢美娟,宋戈,王翻飞.中国乳品工业),2013,41(6):46
[9] Wang Z B,Wang Y,Meng Q J,et al.Journal of Instrumental Analysis(王志兵,王月,孟庆娟,等.分析测试学报),2013,32(9):1044
[10] Shi Z H,Zhang X Y,Bu S J,et al.Chinese Journal of Chromatography(施祖灏,张小燕,卜士金,等.色谱),2012,30(9):883
[11] Song W,Hu Y Y,Han F,et al.Chinese Journal of Chromatography(宋伟,胡艳云,韩芳,等.色谱),2013,31(12):1161
[12] Xu Y,Ding J,Chen H Y,et al.Food Chem,2013,140(1/2):83
[13] Hou X L,Wu Y L,Yang T,et al.J Chromatogr B,2013,929(1/2):107
[14] He S W,Huang Z P,Zhu Y.Chinese Journal of Chromatography(何世伟,黄忠平,朱岩.色谱),2013,31(12):1146
[15] Tian Y,Gao B,Chen H,et al.J Environ Sci Health A Tox Hazard Subst Environ Eng,2013,48(9):1136
[16] Ji L L,Chen W,Zheng S R,et al.Langmuir,2009,25(19):11608
[17] Niu H Y,Cai Y Q,Shi Y L,et al.Anal Chim Acta,2007,594(1):81
[18] Wan C H,Long Z X,Hu H S,et al.Chinese Journal of Food Science(万春花,龙洲雄,胡海山,等.食品科学)2007,28(10):49
