甲胺磷农药降解菌的筛选及其降解效能研究
2014-12-23杜晨辉翟世博黄素云吴红萍
杜晨辉,翟世博,黄素云,吴红萍
(海南师范大学生命科学学院,海南海口571158)
甲胺磷(Methamidophos MAP),是一种广谱、高效、剧毒的有机磷杀虫剂,主要用于水稻、棉花等农作物虫害防治[1].由于其高效的病虫害防治特点,曾被长期、大量地使用,引起水体、土壤污染,严重破坏了环境生态平衡,同时危害到人畜健康[2].农药在环境中的降解主要包括水解、光降解和微生物降解三种途径,其中微生物降解具有反应条件温和、反应速度快和反应专一性强的特点[3-4].因此利用微生物降解甲胺磷农药是解决甲胺磷使用带来的环境污染的有效途径,一直以来也是国内外研究的热点.
海南省是农业大省,地处热带与亚热带地区,气候环境有利于病虫害的发生,农药的使用不可避免,且对病虫害的防治起着举足轻重的作用,为我省农业经济的发展提供了保障.但各种农药的使用也带来了诸多的环境污染、生态平衡和人类健康的问题,严重影响我省建设生态省和国家热带现代农业基地的目标.
目前国内外有关甲胺磷农药微生物降解的研究报道比较多,但海南省有关甲胺磷农药微生物降解方面的研究却鲜见报道.本研究从长期施用甲胺磷农药的土壤环境中筛选到2 株甲胺磷降解菌,并对其生物学特性进行了初步研究,既丰富了“海岛热区”独有的微生物资源,又为我省有机磷农药生产及使用过程中带来的环境污染及农产品安全问题的解决提供了基础材料.
1 材料和方法
1.1 土壤样本来源
土壤取自海口市灵山镇桂林洋农场长期施用甲胺磷农药的农田土壤,采样时样地种植草莓和青菜.
1.2 农药及试剂
甲胺磷标准品由海南正业中农高科股份有限公司提供,其他生化试剂购自海南天地科技有限公司,均为分析纯.
1.3 培养基
无机盐培养基[5]:NH4NO31.0g,MgSO4.7H2O 5.0 g,NaCl 0.5 g,MnSO40.01 g,K2HPO41.5 g,KH2PO40.5 g,加蒸馏水至1L,pH 7.0;富集培养基:无机盐培养基灭菌后加入适量的甲胺磷,作驯化及筛选分离菌株用;种子培养基:酵母膏5 g,蛋白胨10g,NaCl 5 g,加水至1 L,pH7.0~7.2.固体培养基加琼脂15 g/L,以上培养基均在121 ℃灭菌20 min,备用.
1.4 降解菌的驯化、富集筛选
取土壤10 g于250 mL三角烧瓶中,加入含0.4g/L MAP 无机盐培养基100 mL,摇床培养(30℃,180r/min)7d.以后按10%的接种量进行驯化、富集培养,每次7d,共6 次,并逐步提高甲胺磷终含量至0.8、1.5、2.0、3.0 g/L.取最后一次富集液梯度稀释至10-3,取稀释液涂布于无机盐固体培养基平板上(不加MAP的无机盐培养基作对照),挑取含甲胺磷的无机盐培养基上生长较好的菌株,LB纯化后保藏备用[6].
1.5 甲胺磷降解率的测定
1.5.1 甲胺磷标准曲线的绘制
利用甲胺磷和靶离子形成稳定黄色络合物的性质,采用分光光度法测定[7].
1.5.2 甲胺磷降解率的测定
取培养物,4500 r/min 离心10min,取上清液,参考文献[7]测定甲胺磷浓度.降解率ρ=(C1-C2)/C1×100%式中,C1为甲胺磷的原始浓度;C2为根据标准曲线的线性回归方程计算所得的甲胺磷浓度.
1.6 降解菌株生物学特性的研究
1.6.1 菌株生长曲线的测定
1.6.1.1 种子液的制备
挑取降解菌单菌落接种于种子培养基中,37 ℃、180 r/min 摇床培养24h,离心后去上清,用无菌水洗涤2次后重悬,即为种子液.
1.6.1.2 降解菌生长曲线测定
按5%的接种量接种种子液分别于装有100mL LB液体培养基和无机盐培养基(MAP含量为0.8g/L)的250 mL三角烧瓶中,37 ℃、180 r/min摇床培养.分别每2h和4h取样,测定OD600,连续测定24h和32h.
1.6.2 菌株对甲胺磷耐受性的测定
取保藏菌株,活化后划线接种于含不同甲胺磷浓度(0.4、0.8、1.5、2.0、3.0、4.0 g/L)的固体培养基平板上,观察菌株生长情况.
1.6.3 菌株培养条件的优化试验
采用单因子试验方法,分别测定降解菌株在不同初始pH值(4、5、6、7、8、9、10)培养基、不同培养温度(15、20、25、30、35、40 ℃)、不同接种量(1、2、4、6、8、10%)培养24 h 后培养液OD600值,确定菌株在含1.5 g/L MAP的无机盐培养基的最适培养条件.
1.6.4 菌株降解有机磷农药广谱性试验
挑取单菌落,划线接种于含1.5 g/L 乐果和久效磷的无机盐固体培养基平板上,28 ℃培养24~48 h,观察菌落生长情况.
1.6.5 菌株遗传稳定性的测定
取保藏菌株活化,划线接种于LB固体培养基平板上,每24h传代1次,连续传25代.分别取第5、10、15、20、25 代菌株接种于种子培养液中,按1.6.1.1 方法制备种子液.按5%接种量接种于含1.5 g/L MAP的无机盐液体培养基中,37 ℃、180 r/min 摇床培养72 h,按1.5.2方法测定菌株的降解率.
1.6.6 菌株对常见抗生素敏感性
挑取单菌落,划线接种于分别含20、50、100 μg/mL 的氨苄青霉素(Amp)、氯霉素(Cm)、卡那霉素(Kan)的LB 固体培养基上,28 ℃培养24~48h,观察菌落生长情况,测定菌株对不同种类及浓度抗生素的敏感性.
1.6.7 金属离子对菌株降解甲胺磷农药的影响试验
挑取单菌落接种于种子培养液中,按1.6.1.1 方法制备种子液.按5%接种量接种于添加0.05% Fe⁃Cl3、FeSO4、CuSO4、ZnSO4、MnCl2、BaCl2、AgNO3的无机盐液体培养基中(MAP 终含量为1.5 g/L),37 ℃、180 r/min摇床培养,按1.5.2方法测定金属离子对菌株降解甲胺磷的影响.
1.7 菌株的鉴定
菌株鉴定采用BIOLOG 鉴定系统,具体操作参考文献[8]进行.
2 结果与分析
2.1 降解菌的分离及筛选
通过驯化、富集和筛选,分离纯化到在甲胺磷无机盐平板上生长迅速的菌株2株,编号分别为HK-1和GLY-1.
2.2 甲胺磷的标准曲线及降解率
从图2 可以看出,菌株HK-1 和GLY-1 在培养72h后甲胺磷降解率分别达到85.76%,80.23%.菌株对甲胺磷的降解随着培养时间的增加而增大,一方面可能和菌株需要逐渐生长环境并利用甲胺磷农药作为生长的碳源;另一方面可能随着菌株的生长代谢产生的甲胺磷降解酶增加.当菌体培养到一定量时,共同竞争有限的碳源和产生的代谢产物抑制了对农药的降解.

图1 甲胺磷标准曲线Fig.1 The standard curve of MAP

图2 不同培养时间内菌株降解甲胺磷Fig.2 Degradation of MAP in different time of the two strains
2.3 降解菌株的生长曲线
从图3和图4可以看出,菌株HK-1和GLY-1在LB 培养液中培养均比在富集培养液中培养较早进入对数生长期,这和两种培养基的营养成分相关.菌株在只含MAP 的无机盐培养基中,只能利用无机盐作为碳源,且菌株需要一个适应和调节过程,并诱导菌体内降解酶的生成.随着甲胺磷逐渐被降解,中间产物积累到一定程度后,菌体生长受到抑制,细菌生长变缓[9-10].

图3 菌株在LB液体培养基中的生长曲线Fig.3 Growth curve of the two bacterial strains in LB medium
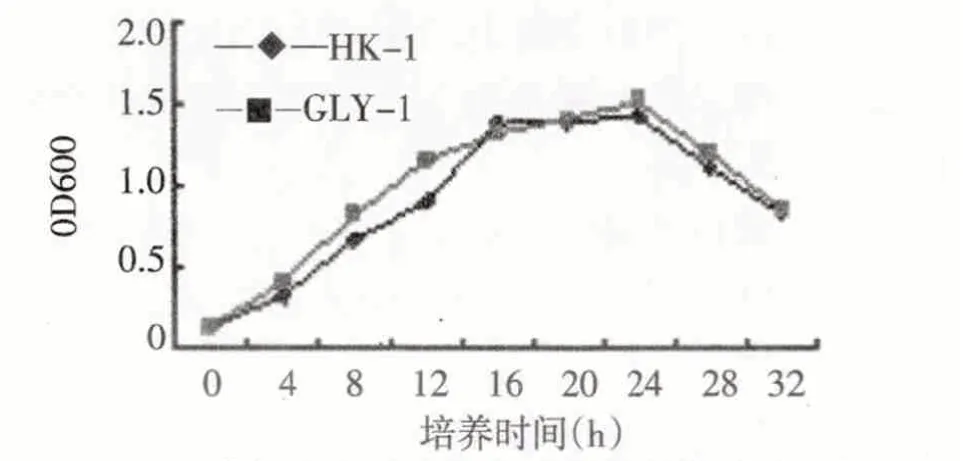
图4 菌株在含MAP的无机盐培养基中的生长曲线Fig.4 Growth curveof the two bacterial strains in enrichment medium
2.4 降解菌株对甲胺磷的耐受能力
从表1中可以看出,菌株HK-1和GLY-1的耐受甲胺磷农药的最大含量为3 g/L.若在无机盐培养基中添加大于3 g/L 的MAP,MAP 不但不能作为碳源被菌株利用,反而作为毒害物质抑制菌株的生长.

表1 降解菌对甲胺磷的耐受能力的测定Tab.1 The test of tolerance concentration of stains to MAP.
2.5 降解菌株的最适生长条件
从图5-图7 可以看出,在最适MAP 浓度的无机盐培养基中(MAP 终含量为1.5g/L),菌株HK-1 和GLY-1的最适初始pH、最适接种量及最适培养温度为7.0、4%~6%、25~30 ℃.从图8可知,两菌株均最适合在含1.5 g/L MAP 的无机盐培养基中生长,菌株可以在充分利用该浓度下的MAP 作为唯一碳源生长,这可能和MAP 浓度过高时产生毒副作用和MAP 浓度过低导致碳源供给不足而影响菌株生长相关.
2.6 菌株降解有机磷农药的广谱性
菌株在含1.5 g/L的乐果和久效磷的无机盐固体培养基平板上均能生长,说明菌株能够利用乐果和久效磷作为唯一碳源生长,具有一定的有机磷农药降解的广谱性.
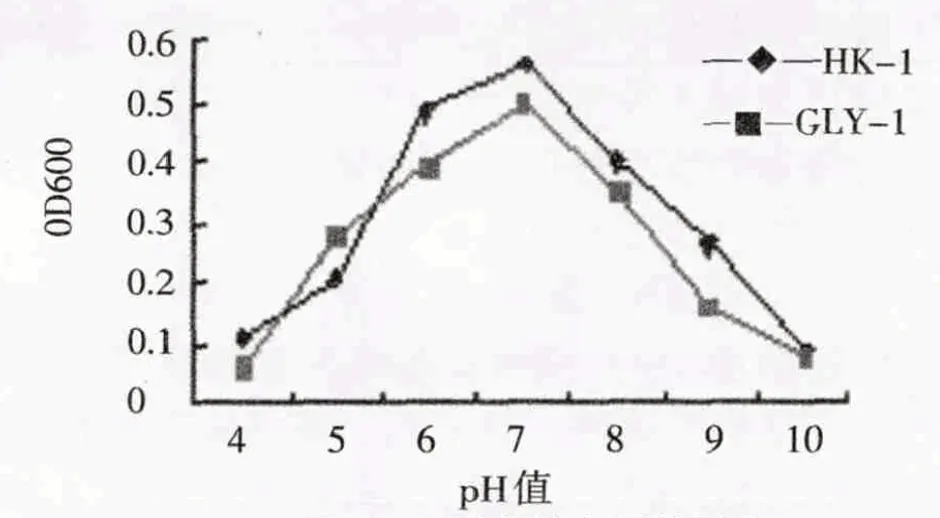
图5 pH对菌株生长的影响Fig.5 Effect of pH on strains growth
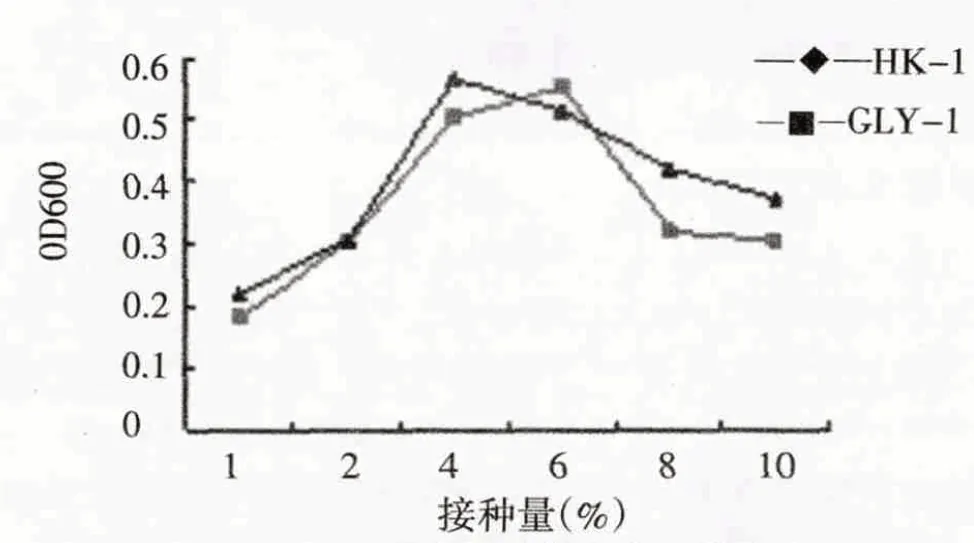
图6 接种量对菌株生长的影响Fig.6 Effect of inoculation quantity on strains growth

图7 温度对菌株生长的影响Fig.7 Effect of temperature on strains growth
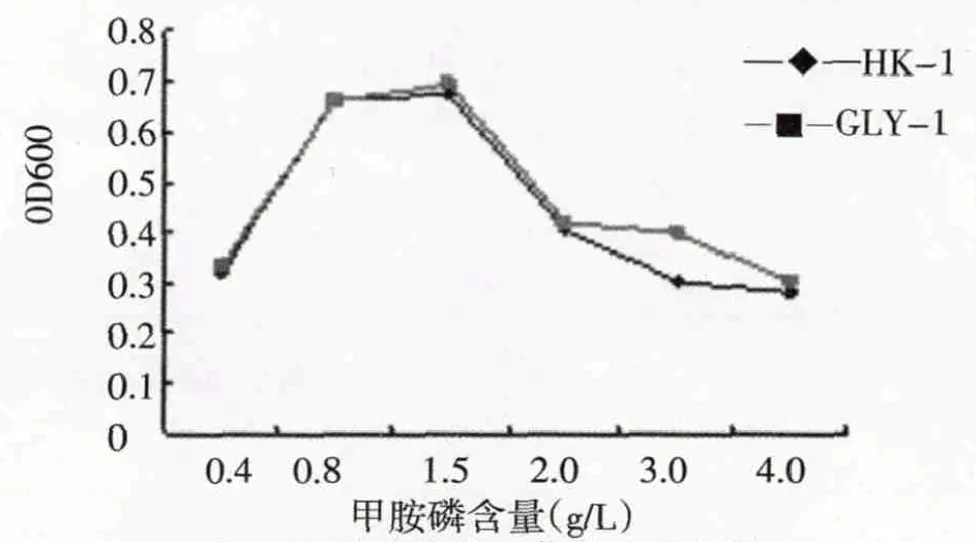
图8 甲胺磷浓度对菌株生长的影响Fig.8 Effect of MAP concentration on strains growth
2.7 菌株的遗传稳定性
从表2 可以看出,不同世代的菌株对甲胺磷农药的降解能力与初始菌株的降解能力相差不大,并未出现因传代而导致菌株甲胺磷降解能力降低或丧失的情况,说明这两株菌遗传稳定性较好.
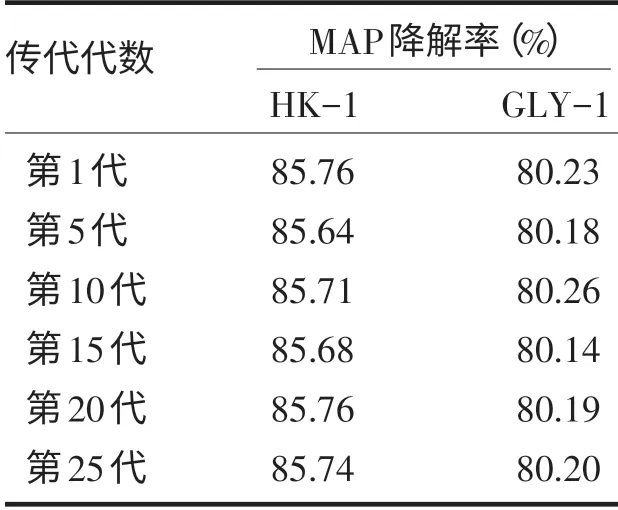
表2 菌株降解甲胺磷农药的稳定性Tab.2 Degradation stability of the four strains
2.8 菌株对抗生素的敏感性
从表3 可以看出,两株菌对测试的抗生素表现出不同程度的敏感性.其中,菌株HK-1 对氨苄青霉素(Amp)较敏感,低浓度氨苄青霉素即可抑制菌株的生长;对氯霉素(Cm)和卡那霉素(Kan)的敏感性一般,在低浓度下生长,但长速较慢,高浓度下不生长.菌株GLY-1 对氨苄青霉素(Amp)和卡那霉素(Kan)较敏感,只能在低浓度下生长;对氯霉素(Cm)的敏感性较弱,在低浓度下生长较好,当含量为50 μg/mL时生长较差.

表3 两株菌对抗生素敏感性试验Tab.3 Antibiotics sensitivity test of the two strains
2.9 金属离子对菌株降解能力的影响
从表4 结果可以看出,测试的金属离子对菌株GLY-1 降解甲胺磷均有不同程度的抑制作用,抑制程度依次为:Fe3+>Fe2+>Zn2+>Ag+>Cu2+>Mn2+>Ba2+;测试的金属离子中,Fe2+和Cu2+促进菌株HK-1降解甲胺磷,其他金属离子则不同程度地抑制菌株HK-1 降解甲胺磷,抑制程度依次为Fe3+>Ag+>Zn2+>Ba2+>Mn2+.同一金属离子对两菌株降解甲胺磷产生不同的促进或抑制作用,说明两株菌产生的降解酶系不同.
2.10 菌株鉴定结果
根据Biolog 鉴定系统结果,菌株HK-1 与Biolog GENIII数据库中的铜绿假单胞菌(Pseudomonas aeruginosa)的匹配程度(相似性)即SIM 值为0.507,离散程度(距离)即DIST 值为4.238;菌株GLY-1 与Bio⁃log GENIII 数据库中的特瑞特西苍白杆菌(Ochroba⁃trum tritici)的匹配程度(相似性)即SIM 值为0.719,离散程度(距离)即DIST值为3.972.根据Biolog鉴定系统的判断标准,即SIM>0.5、DIST<5,将菌株HK-1和GLY-1 初步鉴定为铜绿假单胞菌(Pseudomonas aeruginosasp.)和特瑞特西苍白杆菌(Ochrobatrum triticisp.).

表4 金属离子对菌株降解能力的影响Tab.4 Effect of metal ions on Strains’s degradation ability
3 结论
从长期施用有机磷农药污染的土壤中筛选分离到2株甲胺磷降解菌,编号为HK-1和GLY-1,经BI⁃OLOG 鉴定系统鉴定菌株HK-1 和GLY-1 分别为铜绿假单胞菌(Pseudomonas aeruginosasp.)和特瑞特西苍白杆菌(Ochrobatrum triticisp.).两菌株在含1.5 g/L MAP的无机盐培养基中培养72h,甲胺磷降解率分别为85.71%和80.25%.两菌株对甲胺磷的最高耐受含量为3 g/L,传代菌株降解甲胺磷的稳定性较好,且均能利用乐果和久效磷作为唯一碳源生长,具有一定的有机磷农药降解广谱性.菌株在含1.5 g/L MAP的无机盐培养基中培养的最适初始pH、最适接种量及最适培养温度分别为7.0、4%~6%、25~30 ℃,金属离子的添加影响菌株降解甲胺磷的效率,菌株对常见抗生素的敏感性不同.
本研究经驯化、富集、分离筛选到的2株甲胺磷高效降解菌株,为开发和利用微生物修复因有机磷农药生产和使用过程中带来的环境污染问题的解决奠定基础.但这仅仅是研究的开始,后期将进一步研究菌株降解甲胺磷农药的机制,分析降解的功能物质,并挖掘功能基因,同时从生态学角度研究和构建降解有机磷农药的微生物群落.
[1]崔中利,李顺鹏.化学农药的微生物降解及其机制[J].江苏环境科技,1998,3:225.
[2]廖金英,刘新,赵士熙.甲胺磷降解细菌的分离鉴定及其降解效能的研究[J].华东昆虫学报,2007,16(4):276-280.
[3]杨小红,李俊,葛诚,等.微生物降解农药的研究新进展[J].微生物学通报,2003,30(6):93-96
[4]吴红萍,郑服丛.微生物降解有机磷农药研究进展[J].广西农业科学,2007,38(6):637-642.
[5]赵萍,元文静,王雅,等.两株有机磷农药降解菌的分离鉴定及降解特性研究[J].兰州理工大学学报,2010,36(3):86-90.
[6]李莹莹,李文,张琛,等.甲基对硫磷降解菌L1的分离、鉴定及降解基因的克隆[J].生物技术通报,2008(6):128-131.
[7]刘安喜,林涛.甲胺磷的分光光度法测定[J].农药,1991,30(2):25-26.
[8]李运,盛慧,赵荣华.Biolog 微生物鉴定系统在菌种鉴定中应用[J].酿酒科技,2005(7):84-85.
[9]明惠青,李莉.甲胺磷降解菌的筛选及降解特性研究[J].微生物杂志,2006,26(2):60-62.
[10]郑永良,刘德立,刘世旺,等.甲胺磷农药降解菌的筛选鉴定及其降解效能研究[J].华中师范大学学报:自然科学版,2007,41(1):95-98.
