响应面优化酶法提取紫菜多糖工艺研究
2014-12-23刘敏张淑平
刘敏,张淑平
(1.上海理工大学 医疗器械与食品学院,上海 200093;2.上海理工大学 理学院,上海 200093)
紫菜多糖的含量由于品种、生长环境和生长季节等不同而有很大差别。紫菜多糖主要由岩藻糖、半乳糖、甘露糖、葡萄糖和木糖组成,是一种含糖醛酸的酸性异多糖。研究表明,紫菜多糖具有多种生物活性,具有很大的发展空间[1-3]。
多糖的传统提取方法是水提法,已广泛应用,但具有耗时长、提取率低等缺点[4]。伴随着多糖的深入研究,酶法提取多糖因其具有快速、高效、反应时间短和易于控制等诸多优点而被采用。
本研究以紫菜多糖得率为评价指标,酶添加量、提取温度、提取时间和pH 为影响因素,采用响应面分析法[5-7]优化酶法提取工艺,确定最优工艺参数,为紫菜多糖的应用和发展提供理论支持。
1 实验部分
1.1 材料与仪器
纤维素酶(U/g >150 000),枣庄市杰诺生物酶有限公司;紫菜;苯酚、浓硫酸、盐酸、氢氧化钠等均为分析纯。
FA20O4N 型电子天平;HY3-01 型电热恒温水浴锅;FD-2 型冷冻干燥机;UV-160O 紫外可见分光光度计;SHZ-D 循环水式真空泵。
1.2 实验方法[8-12]
紫菜→烘干→粉碎→紫菜粉→加水→调节pH→加纤维素酶→水浴→90 ℃灭酶10 min→抽滤→浓缩(旋转蒸发40 min,50 ℃)→冷冻干燥→产品。
精确称取紫菜干粉2 g,加入120 mL 蒸馏水。纤维素酶用量为1.5%,提取温度为50 ℃,提取时间为60 min,pH 为5.0。
多糖提取液稀释50 倍,以苯酚-硫酸法测定其多糖含量。紫菜多糖的得率按下式计算:
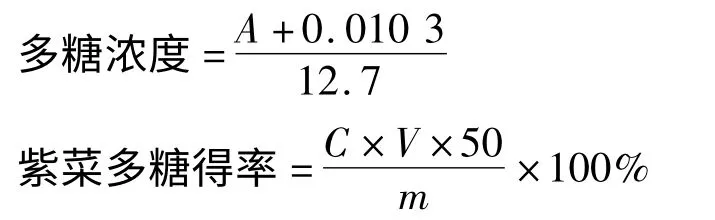
其中,葡萄糖标准曲线方程为Y = 12. 7x-0.010 3,A 为吸光度值,C 为多糖浓度,V 为溶液体积,m 为原料质量,50 为稀释倍数。
2 结果与讨论
2.1 酶用量对紫菜多糖得率的影响
酶用量对紫菜多糖得率的影响结果见图1。

图1 酶用量对紫菜多糖得率的影响Fig.1 Effect of enzyme loading on polysaccharide yield
由图1 可知,纤维素酶用量在0.5% ~1.5%时,紫菜多糖得率随酶用量的增大而上升;酶用量达到1. 5% 后,多糖得率基本趋于水平;酶用量为1.5%时,多糖得率达到最大,为12.61%。酶浓度过高,可能会抑制酶的作用[13-14]。因此,1.5%为最佳酶用量。
2.2 提取温度对紫菜多糖得率的影响
不同温度对多糖得率的影响见图2。

图2 提取温度对紫菜多糖得率的影响Fig.2 Effect of temperature on polysaccharide yield
由图2 可知,温度在40 ~50 ℃时,紫菜多糖得率随着温度的升高而增大,50 ℃时,达到最大,为13.52%;温度在50 ~65 ℃时,紫菜多糖得率随着温度的升高而降低。因此,50 ℃为最佳温度。
2.3 提取时间对紫菜多糖得率的影响
时间对多糖得率的影响见图3。
由图3 可知,在20 ~60 min,紫菜多糖得率随时间延长而增加,60 min 时达到最大,为12. 79%。60 ~100 min,紫菜多糖随着时间的延长而降低。究其原因可能是:由于时间的延长,导致紫菜粘度增大,反而不利于紫菜多糖的提取。因此,60 min 为最佳酶解时间。
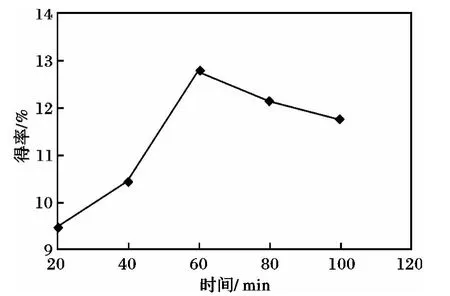
图3 提取时间对紫菜多糖得率的影响Fig.3 Effect of hydrolysis time on polysaccharide yield
2.4 pH 对紫菜多糖得率的影响
不同pH 对多糖得率的影响见图4。
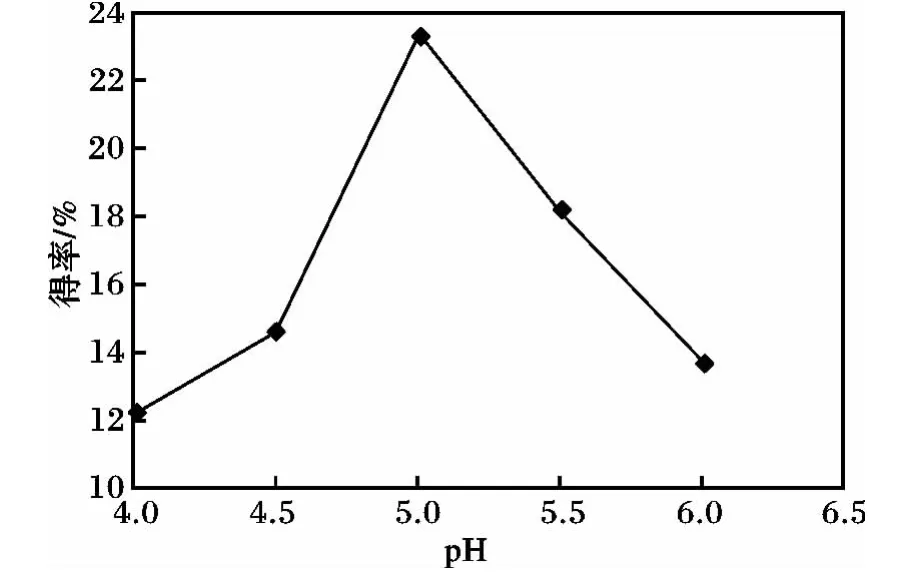
图4 pH 对紫菜多糖得率的影响Fig.4 Effect of pH on polysaccharide yield
由图4 可知,紫菜多糖得率随着pH 的增大先增加后降低。pH 在4.0 ~5.0 时,紫菜多糖得率随之增加,pH 为5.0 时达到最大,为23.51%;pH 在5.0 ~6.0 时,紫菜多糖得率随之降低。因此,5.0 为最佳pH。
2.5 响应面实验结果[15]
根据单因素实验结果,采用Design-Expert 8.5响应面实验设计,选择纤维素酶用量(W/W)、提取温度、提取时间、pH(W/V)4 个因素为影响因素,以紫菜多糖的得率为响应值,因素水平见表1,结果见表2。

表1 响应面实验设计Table 1 Experimental design for RSM

表2 响应面分析实验及实验结果Table 2 Program and experimental results of RSA
应用Design-Expert 8.5 对表2 中实验数据分析,得出紫菜多糖得率的二次回归方程为:
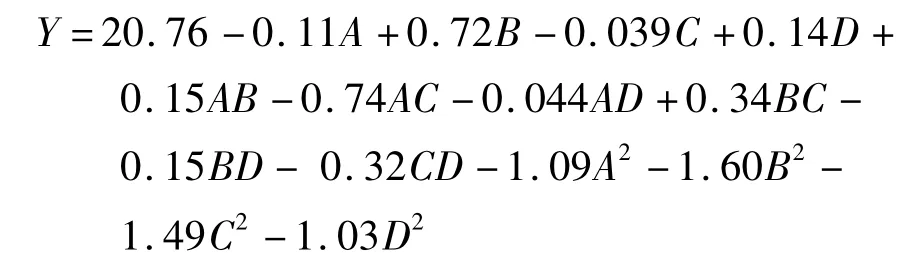
表3 为紫菜多糖得率的方差分析。由表3 可知,回归方程的P <0.01,说明模型高度显著。其中一次项B 的P=0.002 3 <0.01,表明温度对紫菜多糖得率有极显著影响;B2、C2、D2的P 值均小于0.05,表明因素对多糖得率的影响不是简单的线性关系;失拟项P=0.069 0 >0.05,表明拟合度较好,该响应面能够较真实地反映实验结果。

表3 方差分析表Table 3 Analysis of variance
根据上述回归方程做出立体分析图和等高线图,见图5 ~图7。

图5 酶用量、温度立体分析图和相应等高线图Fig.5 Three-dimensional chart and corresponding contour plot for effects of enzyme loading and temperature
由图5 可知,随着酶用量和温度的增大,紫菜多糖得率先提高后下降。酶用量在1.2% ~1.8%,温度在47 ~55 ℃时,紫菜多糖得率较高。
图6 显示酶用量和时间对紫菜多糖得率的交互作用影响。立体分析图可以看出时间和酶用量对紫菜多糖得率的影响均呈抛物线趋势。随着酶用量和时间的增大,紫菜多糖得率随之先提高后下降。由等高线图可以看出,酶用量在1.2% ~1.8%之间,时间在55 ~65 min 之间时,紫菜多糖得率达到最大。由于等高线图中,等高线形状接近圆形,说明A、D 两个因素交互作用不明显。

图6 酶用量、时间立体分析图和相应等高线图Fig.6 Three-dimensional chart and corresponding contour plot for effects of enzyme loading and extraction time

图7 温度、pH 立体分析图和相应等高线图Fig.7 Three-dimensional chart and corresponding contour plot for effects of temperature and pH
由图7 可知,随着温度和pH 的增大,紫菜多糖得率随之先提高后下降。当温度在49 ~53 ℃,pH在4.7 ~5.3 时,紫菜多糖得率达到最大。

图8 温度、时间立体分析图和相应等高线图Fig.8 Three-dimensional chart and corresponding contour plot for effects of temperature and time
由图8 可知,随着温度和时间的增大,紫菜多糖得率先提高后下降。当温度在49 ~53 ℃,时间在55 ~65 min 时,紫菜多糖得率达到最大。
2.6 验证实验
采用软件分析得到纤维素酶辅助提取紫菜多糖的最佳酶用量为1.48%,温度为51. 11 ℃,pH 为5.01,提取时间为60.48 min,紫菜多糖得率软件预测值为22.95%。选择最佳酶用量为1.5%,温度为51 ℃,pH 为5.0,提取时间为60 min,进行3 次平行实验进行验证,结果多糖得率为19.46%,与预测值22.95%非常接近,说明本实验优化结果是可行的。
3 结论
纤维素酶辅助提取紫菜多糖的最优工艺条件为:最佳酶用量为1.5%,温度为51 ℃,pH 为5.0,提取时间为60 min。在此条件下,多糖得率为19.46%。
[1] Zhang Q,Li N,Liu X,et al.The structure of a sulfated galactan from Porphyrahaitartensfs and its in vivo antioxidant activity[J].Carhohydr Res,2004,339(1):1105-1106.
[2] Guo T T,Gu J W,Zhang L X,et al.Mice’s anti-fatigue experiment with crude polysaccharidefrom Porpyrayezoensis[C]//In:Moon O L.Proceedings,12f 10th International Symposium on the Efficient Application and Preservation of Marine Biological Resources,A Special Session on the 2012 Yeosu World EXPO. Kores:Yosu National University,2005:81-87.
[3] Zhou H P,Chen Q H. Anticoagulant and anti-hyperlipidemia of polysaccharide from yezoensis[J]. J China Pharm Univ,1990,21:358-360.
[4] 邓庆华.用正交试验法优化金银花多糖提取工艺[D].长春:东北师范大学,2008.
[5] LI Q H,Caili F.Application of response surface methodology for extraction optimization of geminantpummk in seeds protein[J].Food Chemistry,2005,92(4):701-706.
[6] Malhotra A,Coupland J N.The effect of surfactants on the solubility,zeta,potential and viscosity of soy protein isolates[J].Food Hydrocolloids,2004,18:101-108.
[7] 杨文雄,高彦祥. 响应面法及其在食品工业中的应用[J].中国食品添加剂,2005(2):68-71.
[8] 马瑞君,郭守军,杨永利,等.正交实验法优选坛紫菜多糖的提取工艺[J].食品科学,2006,27(12):524-526.
[9] 张双灵.微波辅助提取紫菜多糖的工艺研究[J].实验报告与理论研究,2009,12(2):3-6.
[10]周小楠,董群.正交试验优化酶法提取金银花多糖工艺[J].食品科学,2012,33(22):119-122.
[11]杨玲,王振宇.响应面法优化蓝靛果抗氧化成分提取的工艺研究[J].林产化学与工业,2010,30(1):67-72.
[12]李亚娜,林永成,佘志刚.响应面分析法优化羊栖菜多糖的提取工艺[J].华南理工大学学报,2004,32(11):28-32.
[13]张巾英,张明春.应用纤维素酶提取中草药有效成分的研究进展[J].上海中医药杂志,2007(1):79-81.
[14]李元波,殷辉安,唐明林,等.复合酶解法提取三七皂甙的实验研究[J]. 天然产物研究与开发,2005,17(4):36-39.
[15]杨光,隋宁,杨波,等.响应面优化大豆蛋白降粘工艺的研究[J].大豆科学,2010,29(6):1028-1032.
