高产奶牛皱胃移位的营养调控措施
2014-12-21王会战
文/ 王 成 王会战 何 茹
(1天津嘉立荷牧业有限公司第八奶牛场;2天津市奶业发展服务中心)
奶牛皱胃移位(Displacement of the Abomasum,DA)是指皱胃的正常解剖位置发生改变,引起消化道梗阻,导致消化机能障碍的内科疾病。皱胃左方移位是指皱胃从瓣胃后方由右侧经过腹底移入左侧肋部,置于瘤胃和左侧腹壁之间,并引起消化机能障碍,导致慢性营养失调的疾病。随着奶牛养殖业的发展,奶牛产奶量的不断提高,该病的发病率逐年升高,成为威胁奶牛养殖业发展的一种严重疾病。自2007年初至2010年底,天津嘉立荷牧业有限公司第八奶牛场共发生皱胃移位奶牛103 例,现就该场奶牛的发病规律、原因及采取的具体营养调控措施做一陈述,以便为该病的防治提供更丰富的实践参考资料。
1 奶牛皱胃移位的发病规律和特点的调查
对天津嘉立荷牧业有限公司第八奶牛场为期4 年的数据统计结果表明,皱胃移位的年发病率为3.5%~5.5%(表1),随着成母牛年单产不断提高,该病的发生率也逐年提高,呈现出高产奶牛发病率明显高于低产奶牛的趋势。其中90%以上的病例为左方移位,右方移位的病例较少。

表1 2007~2010 年天津嘉立荷牧业有限公司第八奶牛场皱胃移位的发病率统计表
1.1 发病牛胎次分析
在103 例的发病牛当中,其中一胎牛47 例,占发病总数的45.63%,二胎牛26 例,占发病总数的25.24%。一胎、二胎牛发病数占发病总数的70.87%(表2)。皱胃移位的发生往往与围产期的饲养、饲喂方式密切相关。一胎、二胎牛多发皱胃移位,需要对其围产期的饲养,特别是怀孕后期的营养是否合理进行分析。

表2 皱胃移位发病牛胎次分布
1.2 产犊至发病天数分析
从产后发病的时间看,产后7 天内发病率为12.62%,8~15 天内发病率为47.57%,16~30 天发病率为21.36%,31~150 天发病率为9.71%,大于150 天发病率为8.74%,81.55%的皱胃移位发生在产后30 天内(表3)。以上数据证明皱胃移位发病与奶牛围产期,尤其是围产后期的营养管理密切相关。从皱胃移位发病角度看,围产期的产前阶段如何饲养,对减少皱胃移位发病率至关重要,在产后阶段的营养投入上,既要实现平稳、最大程度达到产奶高峰,又要保证奶牛消化系统健康、减少皱胃移位的发生,以延长产奶高峰期,提高305天泌乳期产奶量。
1.3 发病时间分析
从表4可以看出,1~3月、8~9月之间的发病率高。奶牛皱胃移位全年四季都有发生,产犊高的月份发病率也高。天津地区1~3月,8~9月正是一年中比较寒冷和比较炎热的时候,随着气候的变化,奶牛的干物质采食量(DMI)也发生了明显的变化,DMI明显下降。另外,饲料冰冻和霉变导致瘤胃功能紊乱,继发皱胃移位的可能性增大。
2 奶牛皱胃移位的原因
2.1 精饲料或短纤类饲料饲喂量过高导致皱胃弛缓
2008年天津嘉立荷牧业有限公司成立以来,全公司奶牛的饲养水平有了大幅提升。随着成母牛单产逐年提高,奶牛的精料饲喂量也有所增加。甜菜粕颗粒、大豆皮等短纤类饲料饲喂太多,与精料饲喂过多有相似的作用,会导致皱胃负担过重,其结果是引起皱胃的收缩能力和弹性下降,皱胃收缩力的下降就可以导致皱胃体积变大、弛缓,从而为皱胃移位的发生提供了基础病因。103 例奶牛皱胃移位手术统计结果显示,发生皱胃移位奶牛的皱胃体积要比正常大1~2 倍,而且多数皱胃内会积聚大量气体。
2.2 产后低血钙是引起皱胃弛缓的一个主要因素
围产期奶牛经历了一系列来自生理、内分泌、日粮和外界环境的变化,这对围产期奶牛的营养代谢产生了一定的影响,使奶牛在产后极易出现各种代谢性疾病和感染性疾病。其中产后低血钙症状尤为常见,大约67%的奶牛都会出现不同程度的低血钙症,而低血钙是引起皱胃收缩功能减弱的一个危险因素,由此导致的真胃移位发病率明显增加。
2.3 TMR中精粗比例失衡或者TMR加工不当导致精粗料分层可导致皱胃移位的发生
实际生产中精粗比例大于60︰40,精料过多而粗饲料饲喂量相对不足,或者粗饲料品质太差,牛只出现挑料现象,可加快瘤胃食糜进入皱胃内的速度,导致皱胃内脂肪酸增多,从而抑制皱胃平滑肌的运动和幽门开放,结果引起皱胃弛缓,积气膨胀,影响了正常的消化机能。又因瘤胃内没有足够的长纤维类饲料来填充而导致瘤胃体积缩小,给皱胃移位提供了有利的空间,所以发病率相对增高[1]。贺有涛等人通过调查统计发现,奶牛皱胃移位的发病率随干草占粗料比例减少而增多,随着精料的增加而增多[2]。
2.4 干物质总量采食不足,能量负平衡可导致皱胃移位的发生
泌乳初期奶牛对营养需求急剧增加的速度超过了从干物质中摄入营养的速度,皱胃左方移位奶牛出现临床症状前,其采食量明显低于健康奶牛,导致它们中的大多数在泌乳初期会出现能量负平衡问题。产前体况评分较高的奶牛产后干物质采食量较低,营养负平衡持续的时间比正常奶牛和体况评分比较低的奶牛更长[3~4]。Stengarde等(2008)报道,产前体况评分较高(≥3.5)的奶牛发生皱胃移位、酮病和其它代谢相关疾病、不孕和淘汰的可能性较大。
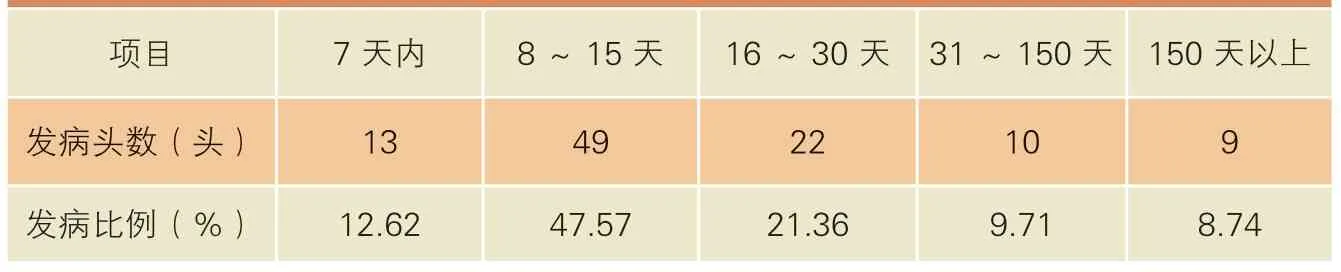
表3 皱胃移位奶牛产后发病阶段
3 奶牛皱胃移位的预防措施
3.1 在泌乳后期使奶牛的体膘恢复到一定的膘度,并且在整个干奶期都保持这一膘度
泌乳后期泌乳牛产奶量下降,因而奶牛对价格昂贵的补充饲料,如过瘤胃蛋白的需求量也相对减少。同时这些奶牛的采食量达到了最高峰,因而这时候日粮中的粗料比例应达到最大量。应为泌乳后期的奶牛单独配制日粮,为这些奶牛单独配制日粮有几方面的作用:一是帮助奶牛达到恰当的体脂储存,避免过肥或过瘦;二是通过减少饲喂一些不必要的价格昂贵的饲料,如过瘤胃蛋白和脂肪饲料来节省饲料开支;三是增加粗料比例,确保奶牛瘤胃健康,从而保证奶牛健康。
应监测奶牛的体膘膘度评分。这是一件很重要的事情,因为体膘过于肥胖的奶牛容易在产犊时患代谢性疾病,如酮病或脂肪肝、皱胃移位、胎衣不下、子宫炎、子宫感染和卵巢囊肿等,因而在产犊时使奶牛具有良好的体膘将在许多方面得到回报。在泌乳后期(产奶200 天之后)应关注奶牛的体膘膘度,确保奶牛获取足够的营养以补充奶牛体内营养储存。研究表明,在泌乳后期改变奶牛的体重和体膘比在干奶期更为容易实现。通过体况评分,在乳泌的后1/3阶段使其达到干奶期应达到的体况,在这个时期应通过饲料配方的调整使体况达到要求。奶牛如果体况恢复太快而偏肥,应放到产量较低,喂低能饲料的组中;如果奶牛偏瘦,应放在高产组,喂以高能饲料,直到必需的体况得以恢复。泌乳后期的奶牛,体膘膘度评分应在3.50~3.75,以确保奶牛营养储备,避免过于肥胖和瘦弱。因而我们建议在泌乳中期应对奶牛的体膘进行膘度评分,以确保在泌乳后期可根据膘度评分更好地调整奶牛体况。
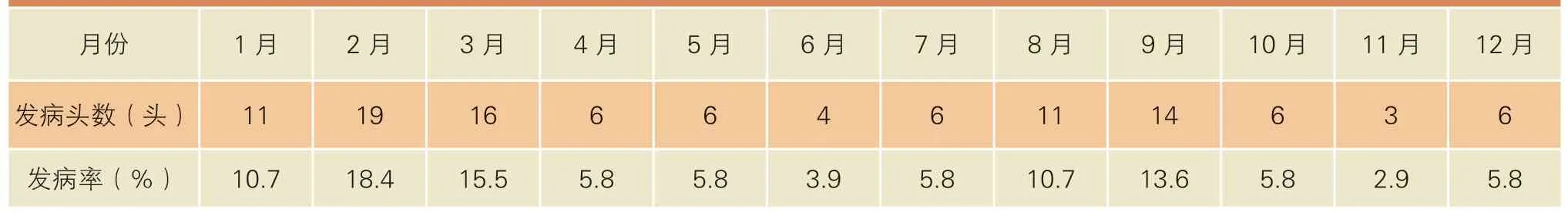
表4 2007~2010 年天津嘉立荷牧业有限公司第八奶牛场皱胃移位奶牛只各月分布情况

3.2 重视干奶牛的饲养管理
干奶初期应有适当的体况,该体况应该在整个干奶期保持不变,这是十分必要的。保证干奶牛日粮的微量养分的供应,特别是增加VA、VD、VE,使其达到奶牛营养需求(NRC)要求的2 倍的水平,铁、铜、镁、锌达到1.5 倍的水平。饲喂的硒应达每天6 mg的水平(为NRC要求水平的2倍);应坚持喂给而尽量不注射,如果一定要注射,必须在产前1.0~1.5个月注射,然后在生产时再注射1 次。如果血液中硒的含量水平太低,通过补饲可能需要2~3 个月才能达到所建议的水平,但当补饲一旦停止,水平将很快下降。在这个时期内,保持钙的正常水平是十分重要的,母牛在产犊时血液低钙会使产犊出现问题,如子宫脱出、胎衣不下、产后食欲不振和皱胃移位等增加。母牛如果发生难产会增加代谢紊乱及皱胃移位的发生。
3.3 重视围产期奶牛的饲养管理
奶牛在围产期所采食的日粮由高纤维日粮逐步过渡到高精料日粮。此时瘤胃功能的变化主要有两方面。一方面是日粮不同导致分解这些日粮的微生物菌群和数量在发生变化;另一方面是由于日粮的不同,微生物区系发生改变后,导致瘤胃乳头长度的变化。高精料日粮适合淀粉分解菌的生长,提高丙酸和乳酸的产量;高纤维日粮适合纤维分解菌的生长,提高甲烷产生量,而不利于生产丙酸和乳酸的细菌生长。发酵终产物将影响瘤胃乳头的生长。已知丙酸和乳酸的产量提高可以促进瘤胃乳头的生长,高纤维日粮使其变短[5]。瘤胃乳头的重新生长需要数周的时间[6]。围产期奶牛的饲养目标:一方面是满足奶牛该阶段的营养需求,为高峰的来临作准备;另一方面是完成瘤胃从高纤维日粮向高精料日粮的转变;在完成以上两点的同时要从营养的角度解决奶牛围产期代谢病的问题。在围产期阶段调整饲粮阳离子和阴离子的比例,即降低饲粮中钾和钠的含量,添加阴离子盐诱导轻度(代偿性)酸中毒,就有可能防止产后牛代谢性碱中毒的发生,从而避免产后低血钙症,降低皱胃移位的发生率。
3.4 加强产后牛护理,灌服产后灌服料
奶牛产后1 个月是皱胃移位的高发时期,产后奶牛身体虚弱容易发生前胃迟缓、低血钙、生产瘫痪、酮病、胎衣不下、重症乳房炎等疾病,而引发皱胃移位。要加强产后奶牛的护理,母牛分娩后用石粉250 g,益生酵母50 g,食盐300 g,氧化镁100 g,磷酸氢钙100 g,小苏打300 g,0.1%复合维生素25 g,0.4%复合维生素100 g,绿化钾150 g,丙二醇300 mL,加入38~40 ℃的温水30~50 L,用瘤胃灌药器灌服,同时肌注维生素ADE 10 mL。温水的量可根据分娩牛只体型的大小而定。
3.5 饲料精粗搭配合理,混合均匀,避免过短过细
从干奶期到分娩,奶牛日粮应精粗搭配合理,营养全面,混合均匀。配制日粮时应注意维生素和微量元素的含量。精料的增加和日粮变换不宜过快,一般要有7~10 天的过渡期;围产前期是干奶前期和围产后期的过渡阶段,是奶牛逐渐由粗饲料为主的日粮向精饲料为主的日粮过渡阶段,是饲养的关键。要切实保证奶牛日粮总干物质量,一般建议中性洗涤纤维(NDF)含量要大于32%,并保证粗饲料的有效长度,防止粉碎过细,更不宜制成颗粒;每天可饲喂2~3 kg优质禾本科干草,以促进瘤胃及其微生物区系功能发挥,防止皱胃移位。
3.6 正确计算奶牛粗饲料和其它饲料的摄入量
奶牛能吃多少饲料就应该饲喂多少饲料,奶牛能吃进去的粗饲料是有限的,正常情况下不喂精饲料时奶牛可采食优质粗饲料的干物质量为其体重的2.5%;高产奶牛由于精饲料比例较大,故粗饲料干物质为体重的1.6%,低产奶牛则为2.0%。原则上以粗饲料来满足维持能量的需要和蛋白质的需要。同时按照饲料多样化原则,粗饲料应由玉米青贮、禾本科干草、苜蓿干草、甜菜粕、大豆皮等多种成分组成。根据以往经验可确定奶牛粗饲料组成,如成年泌乳牛日干物质采食量可占到体重的3.0%~3.5%,达18~20 kg。奶牛每日可采食青贮饲料20 kg(干物质为5~6 kg),禾本科干草3 kg,豆科干草1 kg;这样粗饲料共9~10 kg,已接近日粮干物质的一半,从而保证了TMR中合适的精粗比例。
3.7 合理配置TMR日粮,规范TMR生产工艺
3.7.1 合理调整粗饲料的铡切长度
饲料颗粒的大小会影响奶牛采食的速度、瘤胃的蠕动和消化率。青贮料切割长度不宜过短,应切成1~2 cm的长度,同时保证青贮料中有15%~20%的长度超过4 cm;对于高青贮料含量的日粮而言,还应有适量的长干草来刺激奶牛咀嚼和唾液分泌,保证瘤胃正常反刍。
3.7.2 合理控制TMR的水分含量
水无论是在传统的饲喂模式还是TMR饲喂模式中都具有非常重要的作用。为了使泌乳量达到最高,又要保证牛只健康,就必须使干物质摄入量达到最理想。而TMR饲喂模式可最大限度增加饲料干物质采食量,但对水分的含量要求也更为严格和精确,这也是实际应用中要重点考虑的问题。
从多次实际观察和使用效果可知,全混合日粮的水分最佳含量在45%~55%(冬天取低限,夏天取高限),偏湿其采食量就会受到限制,偏干其适口性就会受到影响,采食量也要受到限制,因此在加料前要对各种原料的水分有一个基本的估测,以确保TMR的水分含量。如果TMR水分太低,根据具体情况可以加一些糖蜜或水来补充。
3.7.3 TMR的混合时间与混合均匀度
搅拌是制作TMR的一个最重要环节,是决定TMR质量及其饲喂效果的关键。为了发挥最佳性能,TMR必须进行适当而彻底的搅拌混合,TMR混合机容量以满载量的60%~70%为基础,混合时间一般是4~8 min。不完全的混合会造成原料混合不均匀而失去TMR的意义,有时还会造成相反的结果。
4 小结
奶牛皱胃移位多发生在产后30 天内,奶牛饲养者为了追逐更高的产奶量,饲养中投入了更多的精料,致使皱胃移位的发病率呈上升趋势。为预防本病的发生,平时应该加强干奶期奶牛的饲养管理,增加干草的饲喂量,以扩大瘤胃容积;控制围产期奶牛精饲料的饲喂量,精料喂量应逐渐增加。产后不能为催奶而过度加精料,应注意精粗料的配比,适度控制精料、青贮料的饲喂量。平时应注意在饲料中添加硒元素,产后及时补钙,防止出现产后低血钙诱发的皱胃移位。应合理配置TMR日粮,注意TMR加工工艺中的几个关键点,即准确度、干湿度、颗粒度、均匀度,另外,TMR日粮应随着季节和天气、原材料的改变而改变。成母牛要合理分群,避免过瘦和过肥的牛只在群里出现。所有这些措施只为一个目的,既要让牛高产,又要保证牛只健康。
[1]张国士.奶牛皱胃移位发病规律的研究.中国兽医杂志,2003,39(2):6-8.
[2]贺涛.奶牛皱胃移位发病原因调查分析 畜牧兽医杂志,2006,25(2):67-68.
[3]Hayirli A,Grummer R R,Nordheim E V,et al.Animal and dietary factors affecting feed intake during the prefresh transition period in Holsteins.J Dairy Sci,2002(85):3430-3443.
[4]Rukkwamsu K T,Kruip T A,Wensing T.Relationship between overfeeding and overconditioning in the dry period and the problems of high producing dairy cows during the post parturient period.Vet Q,1999(21):71-77.
[5]孟庆翔译.NRC奶牛营养需要.北京:中国农业大学出版社,2001.
[6]Dirksen G U,Liebich H G,Mayer E.Adaptive changes of the ruminal mucosa and their functional and clinical significance.Bovine Pract,1985(20):116.
