双链寡聚脱氧核苷酸/载体复合物在急性肺损伤肺泡巨噬细胞中的体外转染效率研究
2014-12-20王倩梅朱金文李明月
尹 文,王倩梅,冯 洋,朱金文,李明月,高 路
失血性休克(hemorrhagic shock,HS)是一种临床常见病症,常引发急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),后期出现多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)[1]。其中,ALI、ARDS和MODS的共同发病基础是失控性全身炎症反应[2],因此近年来防治ALI/ARDS的焦点转向炎症信号转导调控的领域,成为人们关注的热点研究方向[3]。核因子-кB(NF-кB)是一种多向性的转录调节蛋白,参与多种炎症介质基因的转录和调控,其激活效应在ALI/ARDS/MODS的序贯病理损害过程中发挥着重要作用[4-7]。本实验主要在NF-кB识别靶基因кB序列的关键环节上采取特异性措施干预,抑制靶基因的转录表达,观察NF-кB圈套dsODNs载体复合物对肺泡巨噬细胞体外转染效率的影响,实验结果可为临床筛选特异性药物、阻断全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)炎症瀑布效应,防治ALI/ARDS提供新的靶点。
材料与方法
1 材料
健康家兔,体重1.8~2.3kg,雌雄不限,由第四军医大学实验动物中心提供。本实验中实验动物的处置方法符合动物伦理学标准。
戊巴比妥钠购于Gibco公司,LPS、Lipofectamine2000购于Sigma公司,兔LDH试剂盒购于上海恒远生物科技有限公司,NF-кB ODN购于上海生工生物工程公司。
CK-40型倒置生物显微镜、BX51型正置荧光显微镜、FV1000激光共聚焦显微镜购于日本Olympus公司,流式细胞仪购于XXXX1-BD FACSCaibur公司。
2 方法
2.1 失血性休克动物模型建立,提取肺泡巨噬细胞(AM)实验家兔以3%戊巴比妥钠(40mg/kg)耳缘静脉注射麻醉后,固定于恒温手术台。分离其右侧股动、静脉,插管后连接于多道生理记录仪,检测并记录其平均动脉压。快速放血,使家兔平均动脉压在15min内降至30~40mmHg,通过回输血液(回输时间>30min)维持该水平60min。待血压平稳后,经股动脉采血,行血气分析确定失血性休克致急性肺损伤动物模型建立成功[8]。气管切开做一插管,行支气管肺泡灌洗后,提取灌洗液,低速离心提取AM。
2.2 AM鉴定及传代 待巨噬细胞贴壁90%后,取出培养瓶,倾倒瓶内陈旧的培养液,用Hanks液清洗1次以消除小牛血清对胰酶活性的抑制。加入37℃的0.25%胰酶溶液,覆盖贴壁细胞,消化3min左右,使细胞游离后终止消化,加入2ml含1%双抗、100ml/L小牛血清的RPMI 1640培养液,用吸管吹打平皿底部几次,使贴壁细胞充分脱落。以70%乙醇和清水依次清洗细胞计数板及其盖玻片;将细胞稀释成均匀的悬液,用毛细滴管在盖玻片下方滴加一滴细胞悬液,使之充盈计数室;在显微镜下,用10×物镜观察计数板四角大方格内的细胞数,计算细胞浓度和总细胞数。用消化液调节AM浓度至5×109个/ml,行瑞士染色(美蓝-伊红染色),经镜检胞浆红色,胞核蓝色者为巨噬细胞;将浓度调节至1×106细胞/ml,制备单细胞悬液;行台盼蓝染色,正常细胞不着色,死亡细胞呈淡蓝色,3min内计数活细胞和死细胞并计算活细胞百分数,细胞活力(%)=(总细胞数-着色细胞数)÷总细胞数×100%,确保细胞活力﹥95%。行AM传代培养。
2.3 AM分组转染及LDH活性检测 分组转染干预(n=10;每个处理组分别选取2组细胞,各设5个复孔):(1)对照组:AM经提纯并传代后,不加任何干预,培养4、6、8h时分别检测其LDH含量;(2)LPS刺激组:AM经提纯并传代后,给予10μg/ml LPS,余同对照组;(3)Lipofectamine2000组(Lipo2000组):AM经提纯并传代后,先后给予10μg/ml LPS和Lipofectamine2000,余 同 对 照 组;(4)NF-κB dsODNs/Lipofectamine2000组(dsODNs组):AM经提纯并传代后,先给予10μg/ml LPS,再给予预先配置 好 的 不 同 浓 度 的 NF-κB dsODNs/Lipofectamine2000(1∶0、1∶1、1∶3、1∶5、1∶7、1∶9),余同对照组。用流式细胞仪检测细胞内相对荧光强度和细胞摄取率;激光共聚焦显微镜观察细胞爬片中的绿色荧光分布。
其中,寡聚脱氧核苷酸(ODN)由上海生工生物工程公司合成,均经全硫代修饰,并在5'端标记异硫氰酸荧光素(FITC)(激发光:488nm;发射光525nm。)序列如下:
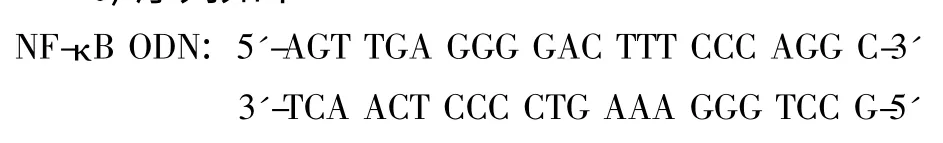
ODN退火采用等摩尔互补单链ODN混合,98℃水浴5min,然后缓慢降至室温,形成双链脱氧核苷酸(dsODNs),-20℃保存备用。
2.4 流式细胞仪检测细胞内相对荧光强度和细胞摄取率 分别取NF-κB dsODNs/Lipofectamine2000转染处理4、6h和8h时的AM细胞悬液,将浓度调整至1×106细胞/ml,以4%多聚甲醛固定,磷酸盐缓冲液(PBS)漂洗后,每份标本收集10 000个细胞,用流式细胞仪检测细胞内相对荧光强度和细胞摄取率。根据活细胞数用Cell QuestTM软件处理数据,评价转染效率。
2.5 激光共聚焦显微镜观察荧光分布 取dsODNs组的AM细胞悬液,行细胞爬片。待细胞贴壁,分裂生长密度达40%左右时为爬片标本制作成功。样本完成后于激光共聚焦显微镜下观察、照相并记录。2.6 统计分析 实验结果数据用均数±标准差(±s)表示,用SPSS17.0软件进行统计分析,统计方法采用等距重复测量方差分析、单因素方差分析等。
结 果
1 不同培养时间与细胞毒性的关系
如表1所示,对照组LDH水平随培养时间增长无明显变化趋势。而LPS组、Lipo2000组和dsODNs组的LDH水平随时间增长明显升高,均在8h时水平最高(图1),即细胞毒性最强;且在培养4、6h和8h时均高于对照组。另一方面,dsODNs组的LDH水平在各培养时间点均明显低于Lipo2000组(P<0.01)和LPS组(P<0.01)。该结果提示NF-κB dsODNs/Lipofectamine2000能够有效减轻细胞损伤,降低细胞毒性。
2 不同dsODNs/Lipofectamine2000浓度比率与细胞毒性的关系
表1提示培养6h时细胞毒性适中,因此以下实验均选取6h为例研究,实验观察不同比率的(dsODNs:Lipofectamine2000)转染组中LDH值变化,结果表明随着Lipofectamine2000比率的增加,细胞LDH含量逐渐增加,但在1∶5时出现折点(图1)。统计发现dsODNs/Lipofectamine2000浓度比率为1∶5时产生的LDH与其他比率各组(除1∶3组外)相比均有统计学差异。该结果提示NF-кB圈套dsODNs与Llipofectamine2000在一定浓度比率范围内影响细胞损伤程度,而1∶5为可供选择的合适转染浓度。
3 转染效率的评估
不同dsODNs/Lipofectamine2000浓度比率对转染效率的影响如表2所示。实验结果提示在转染6h时,dsODNs/Lipofectamine2000各浓度比率组的平均荧光强度均较无Lipo2000组(1∶0)明显增高,其中以1∶5组(P<0.01)最高,细胞摄取率也以1∶5组(P<0.01)最高,均显著高于1∶0组。该结果提示转染效率与脂质体的浓度之间不呈正比关系,即单纯增加Lipofectamine2000并不能有效提高转染效率。表2的结果还提示,各浓度比率组LDH含量随Lipofectamine2000比率的增加呈现增加的趋势。综上所述,表2的结果表明,在dsODNs/Lipofectamine2000浓度比率为1∶5、转染时间6h时,转染效率最高,而细胞毒性适中。
4 NF-кB圈套dsODNs在细胞内的分布
如图2所示,在荧光显微镜可见光下观察发现无Lipo2000组(浓度1∶0)以及dsODNs/Lipofecetamine2000 1∶1、1∶3、1∶5组细胞形态无明显变化;1∶7、1∶9组可见肺泡巨噬细胞变圆,突触减少;1∶9组有一定数量的细胞死亡,出现漂浮现象。Lipofectamine2000介导转染各组荧光物质分布于细胞质和细胞核中,其中以dsODNs/Lipofectamine2000为1∶5时荧光最强,1∶0即无Lipofectamine2000、直接转染组细胞核内少见荧光。
dsODNs/Lipofectamine2000比率为1∶5时,不同时间点(4、6h和8h)的荧光强度检测结果提示6h时荧光强度最大(图3)。
图1 不同dsODNs/Lipofectamine2000浓度比率对LDH产生的影响
表1 培养时间对LDH产生的影响(U/L,±s)
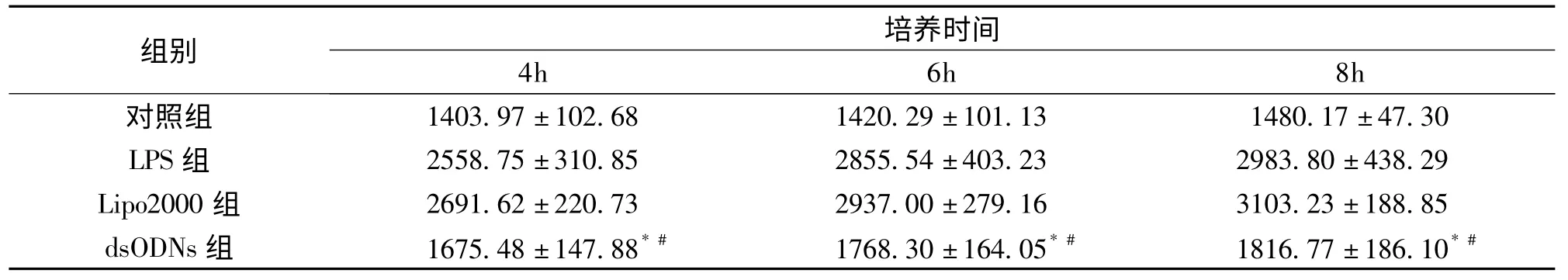
表1 培养时间对LDH产生的影响(U/L,±s)
与Lipo2000组比较:*P<0.01;与LPS组比较:#P<0.01
?
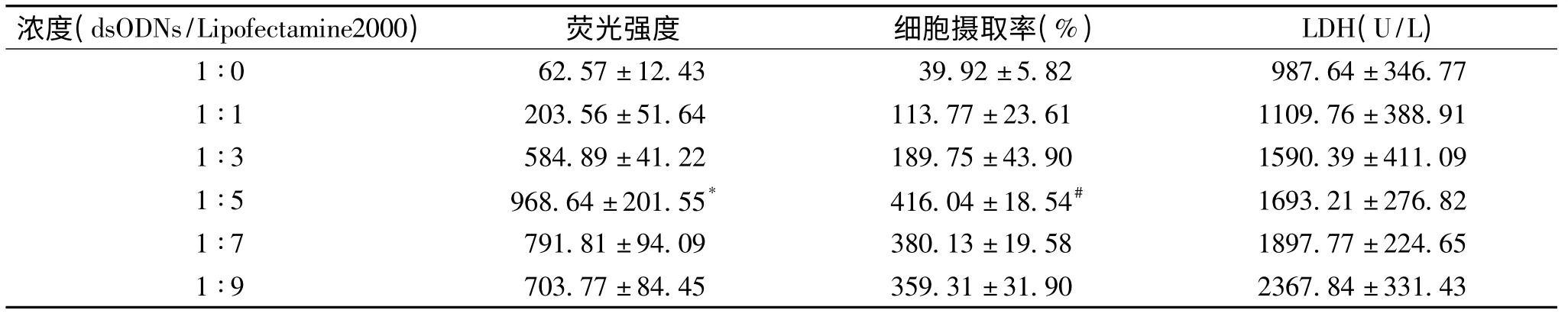
表2 dsODNs/Lipofectamine2000不同浓度比率对LDH产生量、荧光强度和细胞摄取率的影响
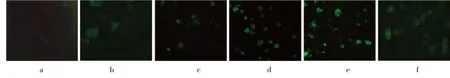
图2 不同dsODNs/Lipofecetamine2000转染,6h时肺泡巨噬细胞内摄取FITC标记的NF-кB decoy dsODNs。a.dsODNs/Lipofecetamine2000 1∶0;b.dsODNs/Lipofecetamine2000 1∶1;c.dsODNs/Lipofecetamine2000 1∶3;d.dsODNs/Lipofecetamine2000 1∶5;e.dsODNs/Lipofecetamine2000 1∶7;f.dsODNs/Lipofecetamine2000 1∶9
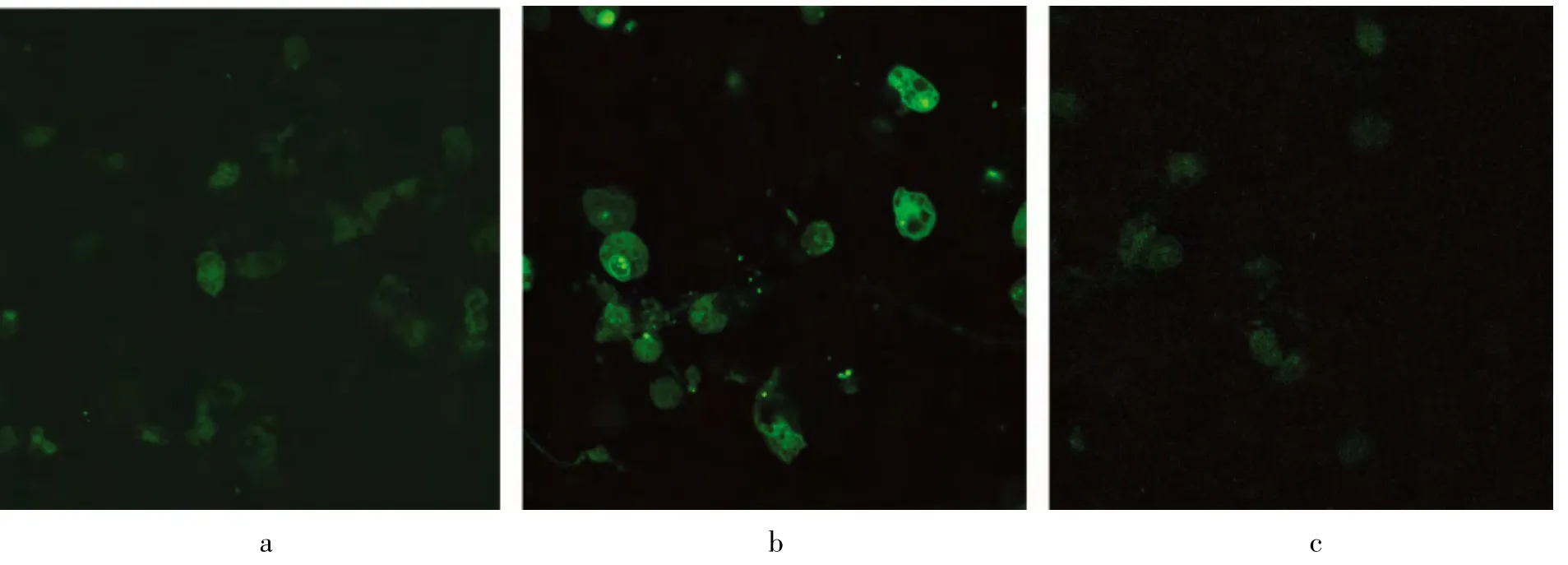
图3 dsODNs/Lipofecetamine2000比率为1∶5时不同转染时间肺泡巨噬细胞内摄取FITC标记的NF-кB decoy dsODNs。a.4h;b.6h;c.8h
讨 论
NF-кB是一种广泛存在于多种细胞基因转录调节蛋白,在静息状态下,通常以无活性的形式存在于胞浆。创伤、休克、内毒素等多种胞外刺激能够启动细胞内的信号转导途径使其活化,调控TNF-α等细胞因子、黏附分子和炎症相关的酶及蛋白质的表达,介导SIRS诱发的脏器损伤。NF-кB是多种信号转导途径的汇聚点,是调控炎症细胞因子基因表达的瓶颈[9]。如果在NF-кB识别靶基因的кB序列的关键环节上采取特异性措施来干预、抑制靶基因的转录表达,势必能为我们筛选特异性药物、阻断SIRS炎症瀑布效应防治SIRS/ALI找到新的突破口。
NF-кB圈套dsODNs[10]作为一种新型的基因治疗手段,合成与кB序列相一致的双链寡聚脱氧核苷酸(dsODNs),通过载体转染入细胞,可以竞争性抑制转录因子NF-кB与顺式元件кB序列的结合,占有NF-кB的DNA结合位点,导致细胞内活化的NF-кB不能结合到靶基因的启动子区域,从而干扰转录因子的DNA结合活性及其后续基因的表达。这种方法在肿瘤、器官移植等疾病的基因治疗中已经应用。但是这需要依赖一个有效的方法提高靶细胞对NF-кB圈套dsODNs的摄取,减少细胞内核酸酶对其的降解作用。
经过大量研究证实,脂质体(LPS)介导转染法[4]是转染寡聚脱氧核苷酸理化方法中的最佳选择之一。阳离子脂质体是一种高效的核酸物质转染载体,其表面的正电荷可与核酸的磷酸根通过静电作用将DNA分子包裹入内,形成DNA-脂质体复合物,也能被表面带负电荷的细胞膜吸附,再通过细胞膜的融合或细胞内吞作用将DNA导入细胞,并且可以保护基因不被核酸酶降解。脂质体/DNA复合物进入细胞质,形成内涵体,内涵体膜破坏并释放DNA;最后DNA进入细胞核并在相应位点整合,使转染基因得以表达。影响脂质体转染的主要因素有细胞类型、细胞密度、细胞状态、脂质体组成、脂质体粒径大小、质粒DNA纯度、DNA与脂质体的比率、制备脂质体-DNA复合物所用缓冲液、转染的温度和时间等,其中DNA与脂质体的比率是决定性的影响因素。阳离子脂质体在基因治疗方面已经取得了喜人的成果,但仍存在一定的局限性,如对器官的靶向性不明显,基因转运的机制不明确等。另外,也因为其脂质的特性和表面带有大量的正电荷,会对细胞产生一定的毒性。对细胞毒性增强会影响转染效率。LDH正常情况下存在于细胞浆内,只有当细胞受损细胞膜破裂或者细胞死亡裂解时才通过损伤的细胞膜泄漏到细胞外。体外培养时进入到细胞基质中,在体内则进入血液。因此,通过检测培养液或血清中的LDH的含量可以间接了解 Lipofectamine2000对细胞的毒性。
本实验结果提示:(1)LPS刺激组更加接近于人体内环境发生内毒素血症时AM中NF-κB信号通路启动、激活的病理过程。AM损伤较对照组严重,LDH水平明显增高(P<0.01),有显著统计学差异。(2)Lipofectamine2000是带有大量正电荷的阳离子脂质体,具有细胞毒性,随着Lipofectamine2000比例的升高或转染时间的延长,培养上清液中的LDH含量升高,显微镜下培养8h后可观察到细胞形态发生改变,细胞的活力降低,并且部分细胞死亡,出现漂浮现象,此时转染的效率也下降。说明细胞毒性的增加会影响转染的效率。(3)dsODNs/Lipofecetamine2000浓度比率为1∶5,转染时间6h时转染效率最高。
综上所述,本实验通过体外摸索脂质体载体Lipofectamine2000与dsODNs的最佳比例和转染时间,为进一步的体内试验提供依据,从而在细胞分子水平为临床防治SIRS/ALI筛选精确药物靶点和寻求高效合理的治疗方案提供前瞻性的实验依据。
[1]Giangola MD,Yang WL,Rajayer SR,et al.Growth arrestspecific protein 6 attenuates neutrophil migration and acute lung injury in sepsis[J].Shock,2013,40(6):485-491.
[2]Kang P,Kim KY,Lee HS,et al.Anti-inflammatory effects of anethole in lipopolysaccharide-induced acute lung injury in mice[J].Life Sci,2013,93(24):955-961.
[3]Li H,Han W,Polosukhin V,et al.NF-κB inhibition after cecal ligation and puncture reduces sepsis:associated lung injury without altering bacterial host defense[J].Mediators Inflamm,2014.[Epub ahead of print]
[4]Liang XM,Guo GF,Huang XH,et al.Isotetrandrine protects against lipopolysaccharide-induced acute lung injury by suppression of mitogen-activated protein kinase and nuclear factor-kappa B[J].JSurg Res,2014,187(2):596-604.
[5]Li X,Zhou X,Ye Y,et al.Lyn regulates inflammatory responses in Klebsiella pneumoniae infection via the p38/NF-κB pathway[J].Eur J Immunol,2014,44(3):763-773.
[6]Wang G,Huang X,Li Y,et al.PARP-1 Inhibitor,DPQ,attenuates LPS-induced acute lung injury through inhibiting NF-κB-mediated inflammatory response[J].PLoS One,2013,8(11):e79757.
[7]Matsuda A,Yang WL,Jacob A,et al.FK866,a visfatin inhibitor,protects against acute lung injury after intestinal ischemia-reperfusion in mice via NF-κB pathway[J].Ann Surg,2014,259(5):1007-1017.
[8]陈勇,周继红,欧阳瑶.急性肺损伤实验动物模型[J].创伤外科杂志,2013,15(5):466-469.
[9]Yu C,Xu L,Chen LF,et al.PRBC-derived plasma induces non-muscle myosin type IIA-mediated neutrophil migration and morphologic change[J].Immunopharmacol Immunotoxicol,2013,35(1):71-79.
[10]Hu MM,Yang Q,Zhang J,et al.TRIM38 inhibits TNF-α and IL-1β-triggered NF-κB activation by mediating lysosome-dependent degradation of TAB2/3[J].Proc Natl Acad Sci USA,2014,111(4):1509-1514.
