基于牦牛氨态氮和尿素氮分布特征构建粗蛋白质进食量估测模型
2014-12-20仲崇亮周建伟龙瑞军
仲崇亮 周建伟 刘 浩 王 力 龙瑞军*
(1.兰州大学草地农业科技学院,兰州 730000;2.兰州大学青藏高原生态系统管理国际中心,兰州 730000)
尿素氮是反刍动物氮素循环的重要载体,对维系机体氮平衡具有重要意义;氨态氮是合成瘤胃微生物蛋白质的原料,对供给宿主动物氨基酸营养起到关键性作用。迄今为止,人们已经对反刍动物氮代谢进行了大量研究,并积累了许多有关反刍动物氨的产生、吸收、利用和尿素循环的资料。牦牛(Bos grunniens)作为能够在高寒缺氧环境中生存的大型反刍家畜,其氮代谢的相关研究相对滞后。近年来,许多学者推测,在青藏高原牧草生长期短、生物量季节变化大的严酷自然环境下,牦牛对长期的氮源缺乏可能形成了一种特殊的适应机制[1-3]。另外,过度放牧和气候变暖导致草场退化,进一步加剧了牦牛氮源供给的不足,使得牦牛的生产性能呈下降趋势[4-5]。由此可见,对牦牛开展氮代谢的相关研究显得尤为重要。据报道,牦牛比本地黄牛和其他低海拔反刍家畜能更有效地利用饲粮中的氮[6-9];特别是在氮营养胁迫条件下,牦牛肝脏合成的尿素是饲粮可消化氮的2倍之多,并且其中87%可重新进入消化道,为瘤胃微生物提供氮源[10]。这些进一步说明,长期的环境和营养胁迫,牦牛可能形成了更高效的饲粮氮消化吸收能力和强大的体内氮素循环利用能力,以调节体内氮平衡和应对季节性营养匮乏。反刍动物体内不同部位的尿素氮和氨态氮是观测氮代谢的最直观指标,而近些年来,关于饲粮氮水平对牦牛体内不同部位氨态氮和尿素氮浓度变化特征的研究鲜有报道。本试验主要研究在氮水平不同,能量水平一致的饲粮条件下,牦牛瘤胃液氨态氮(RNN)、瘤胃液尿素氮(RUN)、血浆尿素氮(PUN)、唾液尿素氮(SUN)浓度以及尿中尿素氮(UUN)、尿中氨态氮(UNN)日排泄量的变化,并进行相关性和回归分析,为进一步研究牦牛氮代谢动力学过程和机制提供理论依据,并为牦牛的科学饲养和管理提供技术支撑。
1 材料与方法
1.1 试验地点和日期
饲养试验和样品采集,于2013年11月至2014年1月在甘肃省天祝藏族自治县乌鞘岭(北纬 37°12.479',东经 102°51.695',海拔 3 154 m)实验站完成;样品实验室分析,于2014年3月至2014年4月在兰州大学青藏高原生态系统管理国际中心进行。
1.2 试验动物和饲粮
选取4头体重[(192±12)kg]相近的3岁去势健康公牦牛为试验动物。试验开始前,对牦牛作驱虫处理,并置于代谢笼内进行30 d的适应期,使其熟悉饲养条件、饲养人员和周围环境。饲粮的粗料为青稞秸秆,精料为代谢能和中性洗涤纤维含量基本一致而氮水平不同的4种颗粒料,精粗比为50∶50,由此构成4种氮水平的试验饲粮[以粗蛋白质水平(干物质基础)计,分别为6.45%、12.18%、17.81%、23.49%],其组成及营养水平见表1。通过预试验确定牦牛的干物质采食量为 3 kg/d,约为体重的 1.5%,采食能量为 1.2倍维持需要。
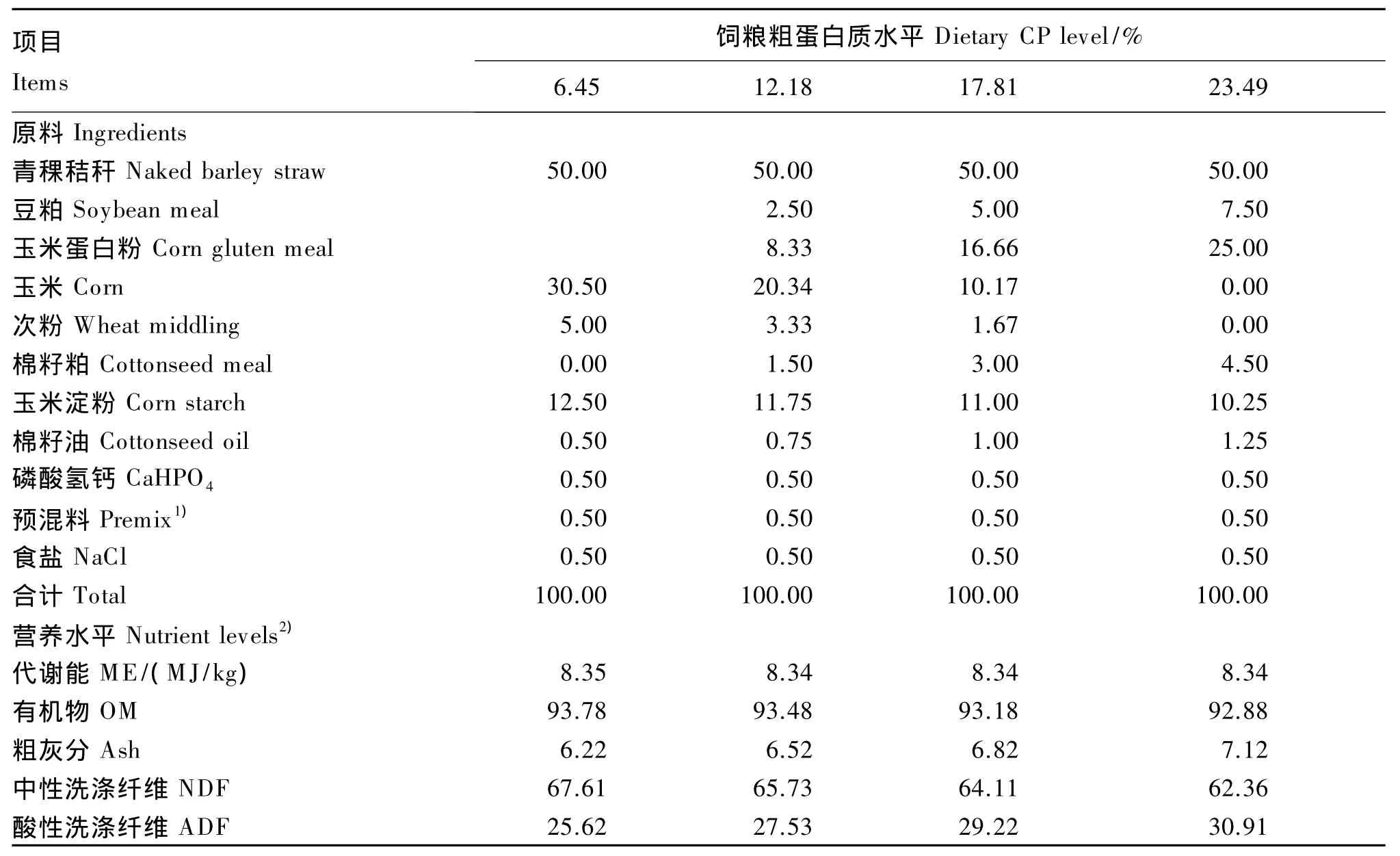
表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
1.3 试验设计与饲养管理
本试验采用4×4拉丁方设计,分4个试验期,每期21 d(包括15 d的预试期和6 d的正试期)。试验牦牛于每天08:00和18:00各饲喂1次,每次干物质饲喂量为1.5 kg(3 kg/d)。自由饮水。试验牦牛于每个正试期的第1和2天(平均值为初重)以及第5和6天(平均值为末重)空腹称重。
1.4 样品采集与分析
正试期采用全收粪尿法,连续5 d收集并记录每头牛每天的粪尿排泄量。将每天收集的尿样混匀,按总尿量的2%取样,并用50%的硫酸溶液酸化,使pH<3.0(利于固定氨态氮和抑制微生物生长),置于-20℃下保存,用于测定UUN和UNN日排泄量。将每天收集的粪样混匀,利用四分法按总粪量的5%取样;然后,将每期试验收集的5 d粪样混匀,置于-20℃保存,用于测定粪氮。
在每个正试期第6天,晨饲前(0 h)和晨饲后2、4、6、8 h(即 08:00、10:00、12:00、14:00 和16:00)采集唾液、血液和瘤胃液。采集唾液10 mL,800×g离心15 min,取上清液分装到 5 mL离心管,-20℃下保存,用于测定SUN浓度。血液采集采用注射器颈静脉抽血法,每头牛抽取10 mL血液样品,注入15 mL离心管并加入适量乙二胺四乙酸二钠(EDTA-Na2)抗凝,800×g离心15 min后,取上清液(血浆)置于若干1.5 mL离心管中,-20℃下保存,用于测定PUN浓度。用瘤胃管抽取100 mL瘤胃液后,4层纱布过滤,分装到5 mL离心管中,并加入1~2滴饱和HgCl2溶液灭活,800×g离心15 min,取上清液置于若干1.5 mL离心管中,-20℃下保存,用于测定RUN和RNN浓度。
饲粮粗蛋白质、有机物、粗灰分、中性洗涤纤维和酸性洗涤纤维含量参照《饲料分析与检测》[12]中的方法测定;粪中氮含量,采用凯氏定氮法测定[13];UUN 日排泄量和 SUN、PUN、RUN 浓度采用二乙酰一肟法[14]测定;UNN日排泄量和RNN浓度采用Broderick等[15]的比色法测定。氮进食量根据干物质采食量和饲粮粗蛋白质含量计算得出;可消化氮进食量为氮进食量和粪中氮排出量之差。
1.5 数据分析
试验数据采用Excel软件进行初步统计处理,并采用SPSS 21.0中的 Mixed Model模块进行差异显著性分析和多重比较;采用双变量相关分析(Pearson)模块进行各变量间的相关性分析,并应用回归分析中的一元线性、多元线性和曲线回归模块分析和建立数学模型。
2 结果与分析
2.1 不同饲粮氮水平下牦牛体内氨态氮和尿素氮浓度的变化特征
由表2和表3可知,饲粮氮水平对UUN、UNN日排泄量以及RNN、PUN、SUN浓度均有极显著影响(P<0.01),且都随着饲粮氮水平的升高而增加;对RUN浓度无显著影响(P>0.05),但有随着饲粮氮水平升高而增加的趋势(P<0.10)。
2.2 晨饲后不同饲粮氮水平下牦牛体内氨态氮和尿素氮浓度的动态变化
由表3可知,1)晨饲后时间对RNN浓度有极显著影响(P<0.01);晨饲后,各组RNN浓度迅速升高,在2 h到达最高,后缓慢降低。2)晨饲后时间对SUN浓度有显著影响(P<0.05);采食后,各组SUN同样呈现先升高后降低,但浓度高峰出现在4 h,且饲粮氮水平越低,变化曲线越平缓。3)晨饲后时间对PUN和RUN无显著影响(P>0.05)。

表2 不同饲粮氮水平下牦牛尿中尿素氮和尿中氨态氮日排泄量Table 2 Daily excretions of UUN and UNN in yaks under different dietary N levels g/d

表3 不同饲粮氮水平和晨饲后时间对牦牛瘤胃液氨态氮、血浆尿素氮、唾液尿素氮及瘤胃液尿素氮浓度的影响Table 3 Effects of different dietary N levels and time after morning feeding on concentrations of RNN,PUN,SUN and RUN in yaks mg/dL
2.3 牦牛不同部位氨态氮和尿素氮指标间相关性及相关数学模型的建立
2.3.1 牦牛不同部位氨态氮和尿素氮指标间的相关性
由表4可知,RUN浓度与RNN、PUN、SUN浓度以及UNN日排泄量之间相关性均不显著(P>0.05);而其他各氨态氮和尿素氮指标间均存在显著或极显著的正相关性,如RNN浓度与SUN浓度(r=0.971,P<0.01),SUN 浓度与 UUN 日排泄量(r=0.943,P<0.01),UUN 日排泄量与 UNN 日排泄量(r=0.902,P<0.01)均有极显著正相关性。
2.3.2 相关数学模型的建立
通过回归分析 RNN、RUN、PUN、SUN浓度(mg/dL),UUN、UNN 日排泄量(g/d),粗蛋白质进食量(CPI,g/d)以及可消化粗蛋白质进食量(DCPI,g/d)等指标,可建立以下数学模型。
2.3.2.1 估测牦牛RNN和PUN浓度的模型

2.3.2.2 估测牦牛CPI的一元和多元变量模型

2.3.2.3 估测牦牛DCPI的一元和多元变量模型

表4 牦牛不同部位氨态氮和尿素氮指标间的相关性Table 4 Correlations between indexes of NH3-N and urea-N at different parts in yaks
3 讨 论
3.1 不同饲粮氮水平下牦牛体内氨态氮和尿素氮浓度的变化特征
一般认为,反刍家畜瘤胃微生物生长的RNN浓度耐受范围为 6~30 mg/dL[16],而本试验饲喂粗蛋白质水平为 6.45%、12.18%和 17.81%的饲粮的结果(分别为 1.02、3.06 和 5.66 mg/dL)都低于这个范围。据韩兴泰等[17]报道,饲喂粗蛋白质水平为 8.01%和 11.76%的饲粮(代谢能分别为 9.62和9.66 MJ/kg,干物质基础)时,生长期牦牛 RNN浓度分别为3.3和5.9 mg/dL,也低于上述耐受范围。相似饲粮条件下,本试验结果低于其他反刍动物(表 5[18-25])。另外,据韩兴泰等[26]的报道,与其他反刍动物相比,牦牛瘤胃细菌具有较低的粗蛋白质水平,使得MCP的合成效率仅为69 g/kg(每千克可消化有机物合成粗蛋白质的量),低于其他反刍动物的平均值169 g/kg,但对干物质和有机物的复胃消化率并无显著影响[17]。综上,牦牛具有较低的RNN浓度和较低的MCP合成效率,但对干物质和有机物的复胃消化率并没有显著影响,这可能与牦牛对营养胁迫的适应性有关。
反刍动物RUN主要来自饲粮和内源尿素氮[29]。本试验饲粮中没有添加尿素,瘤胃中的尿素氮主要来自SUN和由血液经瘤胃壁进入瘤胃的尿素氮。在本试验中,虽然SUN和PUN浓度都随着饲粮氮水平的提高而极显著增加,但饲粮氮水平对RUN并没有显著影响,而且相对较低(表2)。这可能是因为,瘤胃中的脲酶降解尿素的能力是微生物利用氨氮能力的5倍[30],高活性的脲酶使瘤胃液中的尿素能够迅速降解为氨和CO2,从而使其浓度在一定程度内不受饲粮氮水平和采食后时间的影响,而且可以保持相对较低的水平。
3.2 晨饲后不同饲粮氮水平下牦牛体内氨态氮和尿素氮浓度的动态变化
本试验中,各组牦牛在采食后,1)RNN浓度,先升高然后逐渐降低,浓度的高峰出现在采食后2 h,这与Kim等[31]的研究结果一致。其机理可能是,牦牛采食后,瘤胃微生物使进入瘤胃的含氮物质和碳水化合物不断降解[32],但在短时间内可降解氮相对于能量处于过剩状态,释放出的氨没有被及时吸收,使采食后2 h氨态氮浓度迅速升高;随氨态氮被瘤胃微生物利用和瘤胃壁吸收,氨态氮浓度逐渐下降。2)SUN浓度同样呈现先升高后降低,但浓度高峰出现在采食后4 h,比RNN浓度的高峰晚2 h。这可能是由营养物质在机体内吸收利用的空间效应和时间效应引起的。3)在本试验所设的各饲粮氮水平梯度下,PUN浓度随着采食后时间的推移,基本保持平稳,这可能与血液系统自身的稳恒机制有关。

表5 不同反刍动物的瘤胃液氨态氮浓度Table 5 RNN concentration of different ruminants
牦牛和其他反刍动物相比(表6),1)在低氮和中低氮水平下,牦牛的PUN浓度要高于荷斯坦小母牛和肉牛;2)各氮水平下,牦牛SUN浓度高于荷斯坦小母牛;3)在4个氮水平下(由低至高),牦牛 SUN/PUN 为 98.14%、87.54%、94.13% 和99.31%,也高于荷斯坦小母牛。在较低的饲粮氮水平下,较高的PUN和SUN浓度反映了在长期的氮胁迫条件下牦牛可能形成了更高效的内源氮素循环利用能力,以维持机体的氮平衡。
3.3 牦牛不同部位氨态氮和尿素氮指标间相关性及相关数学模型的建立
一般认为,尿素在机体各部分的体液中是顺浓度转运的,最终达到一种动态平衡的状态[33],因此机体各部分的尿素浓度以及氨态氮浓度应该具有明显的正相关关系。本试验测得的RNN、PUN、SUN浓度以及UUN、UNN日排泄量间两两极显著正相关也证实了这个理论。理论上讲,RUN浓度与这5个指标应该也有显著正相关性,但由于瘤胃微生物所产生的脲酶具有极强的活性,使得RUN浓度一直维持在较低的水平。通过一元、多元线性和曲线回归分析各个指标,发现估测牦牛RNN和PUN浓度的最佳指标为SUN浓度,由其建立的线性模型(模型①)和曲线模型(模型②)拟合优度(R2)最接近1.000。RNN和PUN浓度是反映反刍动物氮代谢最重要的2个指标,而其测定往往较困难,在生产实践中可以通过测定SUN浓度,估测RNN和PUN浓度。
在放牧生产中,测定牦牛采食量往往费时费工,而且受许多因素的影响,使得测定放牧牦牛蛋白质实际进食量水平有一定难度[34]。因此,有必要建立数学模型去简捷地反映牦牛蛋白质进食水平。在本试验测得的各指标中,估测CPI的最佳指标是RNN和RUN浓度,而估测DCPI的最佳指标是PUN浓度和UUN日排泄量。在生产实践中,可以通过测定牦牛RNN、RUN和PUN浓度以及UUN日排泄量,估测牦牛的CPI以及DCPI,从而为牦牛的放牧和管理提供参考。由于本试验数据有限(n=16),且是牦牛舍饲条件下得到的数据,因此数学模型有待进一步验证和优化。

表6 不同反刍动物的血浆尿素氮和唾液尿素氮浓度Table 6 Concentrations of PUN and SUN in different ruminants
4 结论
①RNN、PUN、SUN 浓度以及 UUN、UNN日排泄量均随着饲粮氮水平的升高而极显著增加;且这5个指标间两两极显著正相关。
② 在本试验测得的指标中,估测RNN和PUN浓度的最佳指标是SUN浓度,由此建立的数学模型拟合度较好。
③ RNN、RUN、PUN浓度以及UUN日排泄量与牦牛蛋白质摄入水平密切相关,由此建立的数学模型可为估测放牧牦牛CPI及DCPI提供参考。
[1] 董世魁,龙瑞军,胡自治.不同采食水平下舍饲干奶牦牛能量转化、氮、钙、磷代谢的研究[J].草业学报,2000,9(2):32-37.
[2] 张莹,郭旭生,龙瑞军,等.饲粮氮水平对牦牛瘤胃发酵及营养物质消化代谢特征的影响[J].动物营养学报,2011,23(6):1-7.
[3] WANG H C,LONG R J,LIANG J B,et al.Comparison of nitrogen metabolism in yak(Bos grunniens)and indigenous cattle(Bos taurus)on the Qinghai-Tibetan plateau[J].Asian-Australasian Journal of Animal Sciences,2011,24(6):766-773.
[4] WANG M P,ZHAO C Z,LONG R J,et al.Rangeland governance in China:overview,inpacts on Suan county in Gansu province and future options[J].The Rangeland Journal,2010,32:155-163.
[5] 米见对,郭旭生,周建伟,等.日粮氮水平对牦牛瘤胃发酵参数和氮组分的影响[J].中国农业科学,2011,44(22):4678-4686.
[6] LONG R J,DONG SK,CHEN X B,et al.Preliminary studies on urinary excretion of purine derivatives and creatinine in yaks[J].The Journal of Agricultural Scinece,1999,133(6):427-431.
[7] LONG R J,DONG S K,HU Z Z,et al.Digestibility,nutrient balance and urinary purine derivative excretion in dry yak cows fed oat hay at different levels of intake[J].Livestock Production Science,2004,88(1/2):27-32.
[8] LONG R J,DONG SK,WEI X H,et al.The effect of supplementary feeds on the bodyweight of yaks in cold season[J].Livestock Production Science,2005,93(3):197-204.
[9] WANG H C,LONG R J,ZHOU W,et al.A comparative study on urinary purine derivative excretion of yak(Bos grunniens),cattle(Bos taurus),and crossbred(Bos taurus×Bos grunniens)in the Qinghai-Tibetan plateau,China[J].Journal of Animal Science,2009,87(7):2355-2362.
[10] GUO X S,ZANG Y,ZHOU J W,et al.Nitrogen metabolism and recycling in yaks(Bos grunniens)offered a forage-concentrate diet differing in N concen-tration[J].Animal Production Scinece,2012,52(5):287-296.
[11] 中国饲料数据库情报中心.中国饲料成分及营养价值表(2013年第 24版)[J].中国饲料,2013(22):38-42.
[12] 陈桂银.饲料分析与检测[M].北京:中国农业大学出版社,2008.
[13] AOAC.Official methods of analysis of the association of official analytical chemists[S].15th ed.Washington,D.C.:Association of Official Analytical Chemists,1990.
[14] 叶应妩,王毓.三全国临床检验操作规程[M].南京:东南大学出版社,1991:226-228.
[15] BRODERICK G A,KANG JH.Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J].Journal of Dairy Science,1980,63(1):64-75.
[16] 冯仰廉.反刍动物营养学[M].北京:科学版社,2004:241.
[17] 韩兴泰,陈杰,韩正康.饲喂不同蛋白水平日粮的牦牛瘤胃氮代谢与十二指肠各氮组分流量[J].动物营养学报,1998,10(1):34-43.
[18] 李静,张晓明,莫放,等.饲料级缩二脲作为反刍动物非蛋白氮饲料的安全性与有效性系列研究(3)[J].饲料研究,2008(1):53-56.
[19] 王文娟.瘤胃灌注小肽对肉牛瘤胃发酵与营养物质消化代谢的影响[D].硕士学位论文.泰安:山东农业大学,2011:25-26.
[20] 李文,黄应祥,王聪,等.戊酸对西门塔尔牛瘤胃氨态氮及尿嘌呤衍生物浓度的影响[J].粮食与饲料工业,2006(8):42-43.
[21] 王聪,刘强,董宽虎,等.包被铜对西门塔尔牛瘤胃pH、VFA 和氨态氮的影响[J].新饲料,2007(11):39-40.
[22] PRADHAM K.Rumen ecosystem in relation to cattle and buffalo nutrition[C]//Proceedings of the first A-sian Buffalo Association Congress.Khon,Kaen:[s.n.],1994:221-243.
[23] 陈喜斌,冯仰廉.糊化淀粉对尿素的缓释效果的研究[J].饲料博览,1995(3):5-7.
[24] 孙德成,赵智力,魏曼琳,等.不同精粗料比全混合日粮对奶牛瘤胃指标的影响[J].饲料研究,2008(10):47-50.
[25] 王春梅,孙龙生,赵国琦,等.日粮蛋白质水平对湖羊胃肠道内pH值、氨态氮和菌体蛋白的影响[J].饲料工业,2009,30(13):27-29.
[26] 韩兴泰,胡令浩,谢敖云,等.牦牛瘤胃细菌中核糖核酸含量及其与细菌总氮比值的研究[J].动物营养学报,1998,10(2):35-39.
[27] MARINI J C,VAN AMBURGH M E.Nitrogen metabolism and recycling in Holstein heifers[J].Journal of Animal Science,2003,81(2):545-552.
[28] 黄洁,申跃宇,姜军,等.日粮蛋白质进食量对杂交育成母牛氮代谢的影响[J].中国畜牧杂志,2012,48(11):52-54.
[29] 刘哲,张昌吉,郝正里,等.饲喂含不同秸秆的全日粮颗粒料对绵羊瘤胃及血液代谢参数的影响[J].中国饲料,2005(11):12-14.
[30] 张昌吉,刘哲,郝正里,等.含不同秸秆的全饲粮颗粒料对绵羊瘤胃代谢参数的影响[J].草业科学,2008,25(1):82-86.
[31] KIM H D,HA J K,LTABASHI H,et al.Effects of popped soybean on concentration of ruminal peptide and blood amino acids in Holstein calves[J].Asian-Australasian Journal of Animal Science,1998,11(2):155-161.
[32] 陈小连,贾亚红,孙龙生,等.不同中性洗涤纤维与非纤维性碳水化合物比例日粮对山羊瘤胃和血液氮素利用的影响[J].中国畜牧杂志,2007,43(3):36-39.
[33] JONKER J S,KOHN R A,ERDMAN R A.Using milk urea nitrogen to predict nitrogen excretion and utilization efficiency in lactating dairy cows[J].Journal of Dairy Science,1998,81(10):2681-2692.
[34] 王洪荣,冯宗慈,卢德勋,等.应用瘤胃液氨氮、挥发性脂肪酸和血浆尿素氮水平检测放牧绵羊营养状况的研究[J].内蒙古畜牧科学,1997(增刊):132-137.
