持续冷热环境对肉鸡生产性能、糖代谢和解偶联蛋白mRNA表达的影响
2014-12-20苏红光张敏红冯京海胡春红
苏红光 张敏红 冯京海 吴 鑫 胡春红
(中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京 100193)
在肉鸡养殖生产中,环境温度对其生产性能有重要影响。肉鸡长期暴露于低温或高温环境,都能增加其维持能量需要[1-3],造成饲粮浪费,影响生产性能。糖是机体重要的能量来源,糖代谢水平反映了机体能量代谢水平。不同的环境温度条件下,为了维持体温恒定,机体的产热和散热水平也会发生变化。线粒体是真核细胞能量合成的场所,而位于线粒体内膜的解偶联蛋白(uncoupling protein,UCP),可将内膜外侧(膜间隙)的氢离子(H+)运回膜内侧,从而降低物质氧化过程中所形成的H+电化学梯度,使氧化过程与ADP磷酸化过程脱偶联,能量不形成ATP而以热能的形式散发,从而增加呼吸产热,降低ATP的合成,这对维持动物体温平衡有重要意义。目前在肉鸡上关于环境温度对禽类解偶联蛋白(avUCP)表达影响的报道较少。当前关于环境温度对肉鸡生产性能影响的报道多集中于热应激,同一研究中同时涵盖从低温到高温的持续环境温度处理对肉鸡生产性能的研究报道鲜见。本试验研究了10~30℃、持续14 d冷热环境暴露对肉鸡生产性能、糖代谢和avUCP mRNA表达的影响,以探索肉鸡养殖的适宜环境温度,为肉鸡养殖生产中的环境控制提供理论依据。
1 材料与方法
1.1 试验材料
试验动物:选取21日龄体重(BW)相近的爱拔益加(AA)肉仔鸡288只(公母各占1/2)随机分配到6个人工环境控制舱内饲养,每个舱作为1个温度组,按BW 和性别分为6笼,每笼(8只鸡)作为1个重复。预试期7 d,温度22℃,相对湿度60%。28日龄时开始试验,于08:00将各人工环境控制舱温度分别逐渐(1 h内)调到10、14、18、22、26和30℃,相对湿度60%,温湿度均保持恒定直至试验结束,正试期14 d。试验期内所有肉仔鸡自由采食和饮水,24 h光照。试验用基础饲粮组成及营养水平(表1)为参照NRC(1994)营养需要配制的粉状配合饲料。
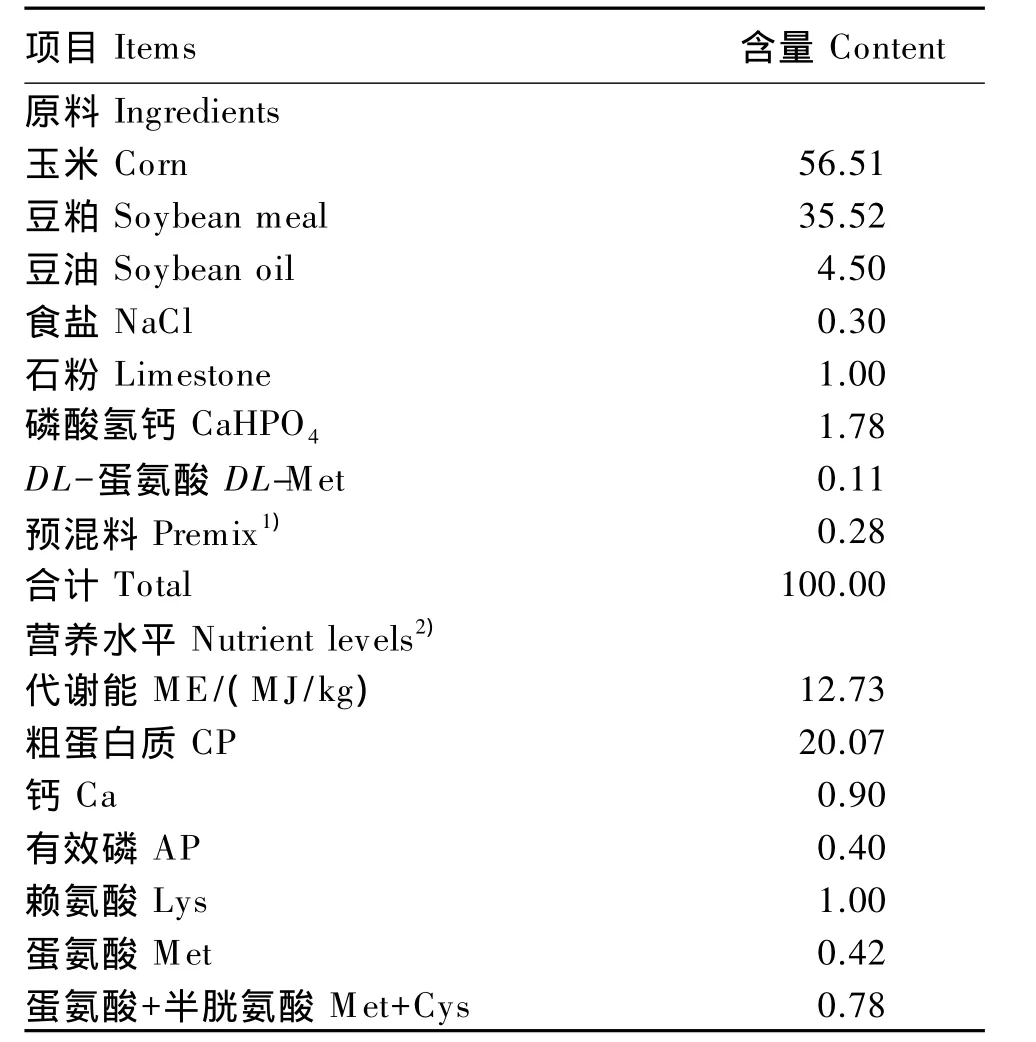
表1 基础饲粮组成及营养水平(饲喂基础)Table 1 Composition and nutrient levels of the basal diet(as-fed basis) %
1.2 试验方法
试验期间每天记录各重复鸡的采食量和饮水量。试验第1、7、14天称量BW,为避免称重时抓捕给试验鸡只造成的较大的应激,本实验室特设计了适于肉鸡环境舒适度评价研究的组合式单层试验笼具[4],此笼可在无抓捕、无压抑和无高密度应激下精准采集肉鸡生产性能。计算试验期内肉鸡的平均日增重(ADG)、平均日采食量(ADFI)、料重比(F/G)和平均日饮水量(ADWC)。
试验第7、14天每个重复随机取1只鸡,取10 mL无抗凝剂真空采血管1支,翅下静脉采血,真空采血管摆斜面静置4 h,分离析出的血清,-20℃保存。采血后迅速将试验鸡处死,分别取2 g胸肌和肝脏样品,放入冻存管中,置液氮中冻存,随后转移到-80℃冰箱中保存,用于测定肝糖原和肌糖原水平。血糖水平测定方法按照中生北控生物科技有限公司提供的葡萄糖试剂盒说明书进行,测定仪器采用日本日立7160全自动生化仪。肝糖原和肌糖原水平测定采用南京建成生物工程研究所提供的肝/肌糖原测试盒,并按其指导说明书进行。
试验第7、14天处死鸡后,打开胸部毛皮,快速取黄豆大小的胸肌浅层肌肉样品,置液氮中冻存,随后转移到-80℃冰箱中保存,用于测定avUCP mRNA相对表达量。总RNA提取按总RNA提取试剂盒(zymo research R2050)说明操作,所得 RNA检测260和280 nm处的吸光度(OD)值,计算 OD260/OD280,并进行1%琼脂糖凝胶电泳检测。各样品取1μg总 RNA,按 BiosS-cript First-Strand cDNA Synthesis Master Mix(宝赛生物技术有限公司)试剂盒说明书进行cDNA反转录。以甘油醛-3-磷酸脱氢酶(GADPH)基因为内参基因,采用实时定量PCR(real-time PCR)进行相对定量,采用2-ΔΔct法进行数据的相对定量分析。引物设计如下。
avUCP基因引物:上游为5'-ATCGGGCTCTACGACTCTGT-3';下游为 5'-TGTGTCCTTGATGAGGTCGT-3';扩增片段长度为327 bp。
内参基因GAPDH引物:上游为5'-AACTTTGGCATTGTGGAGGG-3';下游为5'-ACGCTGGGATGATGTTCTGG-3';扩增片段长度为130 bp。
1.3 数据统计分析
试验数据用平均值±标准差表示,采用SAS 9.1.3统计软件中的ANOVA过程进行单因子方差分析和Duncan氏法进行多重比较,P<0.05为差异显著。
2 结果
因10℃环控舱在试验第11天损坏,舱内温度不能维持10℃恒定,而随室温变化,第11~14天室温为15~23℃。故11 d之后10℃组对应的各指标的测定值仅作参考。
2.1 持续冷热环境对肉鸡生产性能的影响
由表2可知,试验第7天,30℃组BW 显著低于14~26 ℃组(P<0.05),10 ℃组 BW 与 14~26℃组差异不显著(P>0.05);试验第14天,10℃组 BW 显著低于18、22℃组(P<0.05),且显著高于 30 ℃组(P<0.05)。
对其他生产性能,试验1~7 d,26℃组ADFI显著低于10~22℃组(P<0.05),显著高于30℃组(P<0.05);10℃组ADG显著低于22℃组(P<0.05),显著高于 30 ℃ 组(P<0.05),与 14、18、26℃组无显著差异(P>0.05);10℃组F/G显著高于18~26 ℃组(P<0.05);随温度升高,ADWC有升高的趋势,且30℃组显著高于10~22℃组(P<0.05)。试验 7~14 d,随温度升高,ADFI有降低的趋势,且26℃组显著低于10~22℃组(P<0.05),显著高于 30 ℃ 组(P<0.05);22 ℃ 组肉鸡ADG 显著高于 10、14、26和 30 ℃ 组(P<0.05),30℃时肉鸡ADG显著低于其他组(P<0.05);随温度升高,F/G有先降低后升高的趋势,18~26℃组差异不显著(P>0.05),30℃组显著高于其他组(P<0.05);26 ℃组 ADWC 显著高于 10、14、30 ℃组(P<0.05)。试验 1~14 d,10~22 ℃组 ADFI差异不显著(P>0.05),22~30 ℃组 ADFI随温度升高而显著降低(P<0.05);22℃组ADG显著高于10、26、30 ℃组(P<0.05),22~30 ℃随温度升高而显著下降(P<0.05);F/G随着温度升高呈现先下降后升高的趋势,在22℃组最低,30℃组最高;10℃组ADWC显著低于其他组(P<0.05),其他组差异不显著(P>0.05)。

表2 持续冷热环境对肉鸡生产性能的影响Table 2 Effects of prolonged cold and hot environment on performance of broilers
2.2 持续冷热环境对肉鸡糖代谢的影响
由表3可知,试验第7天,26℃组血糖水平显著低于10℃组(P<0.05);10℃组肝糖原水平显著高于 14、26、30 ℃组(P<0.05);但肌糖原水平却在18、22和26℃组显著高于10和30℃组(P<0.05),肌糖原水平随温度升高有先升高后降低的趋势。试验第14天,26℃组血糖水平显著低于18℃组(P<0.05);肝糖原水平在各组间差异不显著(P>0.05);22℃组肌糖原水平显著低于10、26和 30 ℃组(P<0.05)。
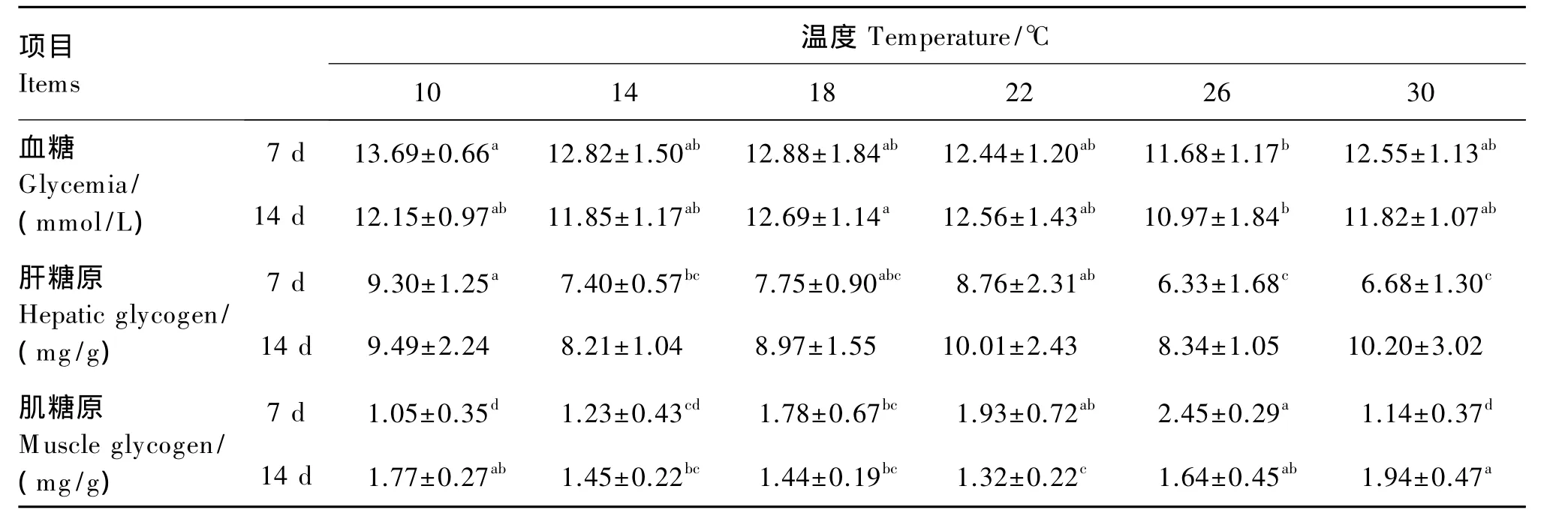
表3 持续冷热环境对肉鸡血糖、肝糖原和肌糖原水平的影响Table 3 Effects of prolonged cold and hot environment on glycemia,hepatic glycogen and muscle glycogen levels of broilers
2.3 持续冷热环境对肉鸡avUCP mRNA表达的影响
不同温度对肉鸡胸肌avUCP mRNA表达的影响结果见图1。试验第7天(图1-A),不同组胸肌avUCP mRNA相对表达量差异显著(P<0.05),其中 10、18、30℃组显著低于 14、22℃组(P<0.05),10 ℃组显著高于 30 ℃组(P<0.05)。在试验第14天(图1-B),18、22℃组avUCP mRNA 相对表达量显著高于其他各组(P<0.05),其他组间差异不显著(P>0.05)。

图1 持续冷热环境对肉鸡胸肌avUCP mRNA表达的影响Fig.1 Effects of prolonged cold and hot environment on expression of avUCP mRNA in pectoralis muscle of broilers
3 讨论
3.1 持续冷热环境对肉鸡生产性能的影响
关于环境温度对肉鸡生产性能的影响已有大量研究报道。一般是,高温条件下,肉鸡需要减少产热、增加散热以维持机体温度平衡,因采食会有体增热,故高温环境下肉鸡会通过降低采食量减少产热,高温也会降低肉鸡的饲料效率,采食量减少和饲料效率降低进而导致肉鸡ADG和BW下降。研究表明,肉鸡暴露于慢性热应激环境下采食量减少 16.4%,BW 减少 32.6%,F/G 增加25.6%[5];将 21~49 日龄的肉鸡分别饲养在于 20、25、30和35℃条件下,肉鸡采食量、BW 和饲料效率在30和35℃组均有下降,而20和15℃组间没有差别[6]。因实际生产中肉鸡遭遇高温应激较为普遍,故关于环境温度对肉鸡生长性能的影响多集中于高温环境,而相对低温环境对肉鸡生长性能的研究报道较少。本研究处理温度最低10℃,结果表明,环境温度较低的情况下,肉鸡的生长性能也受到了显著影响,BW和显著降低,F/G显著升高。因环境温度较低时肉鸡的维持能量需要增加,且采食会带来体增热,这有利于低温环境下肉鸡增加产热以维持体温。低温环境下肉鸡BW下降,F/G增加,这表明有更多的能量摄入用于肉鸡的维持,而非用于生长。
本研究表明,持续的低温或高温环境暴露,能影响肉鸡生产性能。其中,暴露前7天,低温暴露对BW、ADFI的影响不显著,而能显著降低ADG,显著增加F/G;高温能显著降低BW、ADFI、ADG,而对F/G的影响不显著。暴露后7天,10~30℃范围内的高温暴露能降低BW、ADFI、ADG,增加F/G,低温暴露能降低BW、ADG,提高F/G。而在10~30℃范围内,持续14 d的高温和低温处理对ADG的作用均迅速、持久,BW、ADFI对高温处理反应较快,F/G对低温处理反应较快,随着温度处理的持续,温度不适对各生产性能指标的负面影响才全部体现出来。
本研究表明环境温度显著影响肉鸡饮水量。因禽类在高温环境下的主要散热方式是热喘息,经呼吸道散热,造成水分消耗持续增加。研究表明,随着温度从2℃上升的35℃,蒸发散热占禽类机体产热量的比例最大能几乎达到100%[7]。所以高温状态下,禽类需要消耗更多的水分用于维持蒸发散热。21~42日龄肉鸡饮水量在处于32℃恒定温度饲养条件下的显著高于处于22℃[8];30℃条件下肉鸡的饮水量高于25℃,而25、20℃之间没有显著差别[6]。而本研究表明,在试验前7天肉鸡的ADWC在30℃高温条件下升高,这与之前的研究报道结果一致;在试验后7天ADWC对环境温度比较敏感,在14和26℃均有升高,但奇怪的是30℃条件下出现降低,其详细机制有待研究;而整个试验期内,肉鸡的ADWC仅在10℃的低温条件下有所降低,说明肉鸡的ADWC对低温较为敏感。
3.2 持续冷热环境对肉鸡糖代谢的影响
血糖水平是较早被公认的反映动物应激的指标之一,其反映了动物能量代谢状况。但是关于温度对血糖水平影响的报道结论并不一致。周杰等[9]报道,22~24日龄肉仔鸡给予高温处理,血糖水平无明显变化,若给以更高温处理血糖水平极显著下降,而对40~42日龄肉仔鸡给以(34.5±1.5)℃高温处理时血糖水平极显著下降。但郑卓夫[10]认为在急性热应激时血糖水平比适温期时升高,在慢性热应激时血糖水平才下降。Vecerek等[11]报道16日龄肉鸡体内的血糖水平随环境温度的逐渐升高而显著增加,唐丽[12]研究表明急性热应激能使肉种母鸡血糖水平显著升高,王士长等[13]报道长期慢性热应激能使3周龄肉仔鸡血糖水平显著升高。也有报道表明,热应激状态下的鸡血糖水平保持稳定[14]。而本研究结果表明,血糖水平在26℃组最低,持续的低温和高温处理均有使血糖水平升高的趋势,传统意义上来讲,26℃温度环境不会对肉鸡造成热应激,属于适温。本试验结果支持持续低温和高温处理造成的慢性应激有升高血糖水平的趋势。
热应激时血糖水平的升高或降低都均有理论支持。热应激时机体通过糖原分解直接产生可利用的能量,以增强机体对热应激的抵抗力,这可能造成血糖水平下降[15],慢性热应激还使鸡肝脏损伤,抑制糖原合成,造成血糖水平降低[16]。而高温下肾上腺髓质分泌功能增强,肾上腺素浓度升高,致肝糖原分解,血糖水平升高,这也是动物在热应激初期出现的应激反应。糖类代谢受肾上腺皮质激素的影响较大,热应激状态下下丘脑-垂体-肾上腺(HPA)轴分泌皮质酮增加,加强糖异生作用,从而升高血糖水平,这也是认为热应激状态下血糖水平升高的主要因素之一。另外,高温能刺激大脑皮层抑制促甲状腺激素分泌,降低三碘甲腺原氨酸(T3)、四碘甲腺原氨酸(T4)水平,进而减少体蛋白质合成,加强糖异生作用,促进血糖水平升高。本试验结果中,在高温暴露7 d后肝糖原和肌糖原水平均降低,但血糖水平却没有升高,这可能是由于热应激状态下对肉鸡能量需要的增加,致糖原分解,血糖的利用增强,从而引起血糖和糖原的水平均出现降低。而在持续低温暴露7 d后,肝糖原水平出现升高,这可能是由于持续低温时能量摄入增加,肝糖原的合成大于其分解。而在持续低温和持续高温暴露14 d后,肝糖原水平受温度影响不显著,肌糖原水平在低温和高温条件下均升高,与持续温度处理的7 d后的结果相反,这可能是随着低温或高温应激的持续糖异生作用加强的结果,其详细机制有待进一步研究。
3.3 持续冷热环境对肉鸡avUCP mRNA表达的影响
禽类主要有2种产热机制:寒战性产热和非寒战性产热,长期以来都普遍认为寒战性产热是主要的产热机制,但在慢性冷热环境暴露下非寒战性产热的的调节能力对一些禽类的生存能力也是至关重要的[17]。哺乳动物主要通过褐色脂肪组织(UCP大量表达的组织)进行非寒颤性产热,而禽类没有褐色脂肪组织,普遍被认为其肌肉组织很可能是一种主要的产热部位[17],研究表明冷暴露鸭的肌肉组织产热占非寒战性产热的70%[18],而且这一非寒战性产热与自由脂肪酸对线粒体的解偶联作用相关[19],这与后来发现的禽类avUCP的功能一致,表明avUCP很可能在禽类产热调节中发挥重要作用。
本研究表明,第7、14天时,肉鸡胸肌avUCP mRNA表达量在30℃组降低,这与之前Mujahid等[20]报道的急性热应激(34℃,18 h)能使肉鸡avUCP mRNA表达量降低到热中性对照组的28%,Taouis等[21]报道的将 5日龄肉仔鸡热暴露(40.0±0.5)℃ 24 h 导致胸肌 avUCP mRNA 表达降低的结果一致。表明高温条件下线粒体呼吸链解偶联作用受到抑制,减少了细胞能量以热能的形式散发和机体产热。但本研究在低温条件下并未见avUCP mRNA相对表达量显著增多,第7天时虽然14℃组avUCP mRNA相对表达量相对高于18、30℃组,但与22、26℃组没有显著差别,所以也并不能说明低温条件下avUCP mRNA相对表达量增加,甚至在14 d时低温条件下avUCP mRNA的相对表达量出现了显著的降低。这与之前Toyomizu等[22]将3周龄白来航鸡冷暴露(4~6℃)10~12 d导致胸肌avUCP mRNA表达量升高,Collin等[23]将7日龄肉仔鸡冷暴露(20℃)7 d引起腓肠肌avUCP mRNA表达量升高的研究报道不一致。这可能是低温处理程度不同,也可能是avUCP只在禽类较早期幼雏阶段对低温条件下的产热调节作用显著,随着日龄的增长,低温条件下禽类主要通过其他的机制调节产热。有研究表明肉用鹌鹑的avUCP mRNA表达量在28日龄时比7日龄时下降了67%[24]。
4 结 论
①环境温度从10℃上升到18℃时,肉鸡的BW、ADFI、ADG均已升到最高,但 F/G也较高,饲料效率较低,生产性能未达最佳。
②26℃时,虽然肉鸡ADG和ADFI均降低,但饲料效率和BW比22℃组并未显著降低;同时在26℃条件下avUCP mRNA的相对表达量较低,肉鸡摄入能量以热能形式损失较少,且血糖水平较低,反映了肉鸡在此温度条件下能量利用效率较高。
③在本研究饲养条件下,从生产性能和能量利用效率角度考虑,28~42日龄的AA肉鸡的适宜养殖温度为22~26℃。
[1] BRODY S,LARDY H A.Bioenergetics and growth[J].The Journal of Chemical Physics,1946,50(2):168-169.
[2] ARMSTRONG D G,BLAXTER K L,CLAPPERTON J L,et al.Heat production and heat emission of two breeds of sheep[J].The Journal of Agricultural Science,1960,55(3):395-401.
[3] KLEIBER M.The fire of life:an introduction to animal energetics[M].New York:Wiley,1961.
[4] 张敏红,苏红光,冯京海,等.采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置:中国,CN103404447A[P/OL].2013-11-27.
[5] SOHAIL M U,HUME M E,BYRD J A,et al.Effect of supplementation of prebiotic mannan-oligosaccharides and probiotic mixture on growth performance of broilers subjected to chronic heat stress[J].Poultry Science,2012,91(9):2235-2240.
[6] DONKOH A.Ambient temperature:a factor affecting performance and physiological response of broiler chickens[J].International Journal of Biometeorology,1989,33(4):259-265.
[7] FARRELL D J,SWAIN S.Effects of temperature treatments on the heat production of starving chickens[J].British Poultry Science,1977,18(6):725-734.
[8] DEEB N,CAHANER A.Genotype-by-environment interaction with broiler genotypes differing in growth rate.3.Growth rate and water consumption of broiler progeny from weight-selected versus nonselected parents under normal and high ambient temperatures[J].Poultry Science,2002,81(3):293-301.
[9] 周杰,骆先虎,檀其梅,等.高温对肉用仔鸡生产性能和某些血清生化指标的影响[J].畜牧与兽医,1997,29(2):57-59.
[10] 郑卓夫.减轻家禽热应激的添加剂研究进展[J].中国畜牧杂志,1992,28(4):56-58.
[11] VECEREK V,STRAKOVA E,SUCHY P,et al.Influence of high environmental temperature on production and haematological and biochemical indexes in broiler chickens[J].Czech Journal of Animal Science,2002,47(5):176-182.
[12] 唐丽.热应激对肉种母鸡繁殖性能,相关生理生化和分子指标的影响[D].硕士学位论文.北京:中国农业科学院,2013.
[13] 王士长,陈静,黄怡,等.热应激对肉鸡生产性能和血清生化指标的影响[J].中国家禽,2008,29(15):11-13.
[14] 刘铀,林红英,罗东君,等.热应激对肉鸡血液生化指标及内分泌机能的影响[J].湛江海洋大学学报,1999,19(1):61-64.
[15] 李俊杰,桑润滋,田树军,等.热应激与牛血液成分的变化[J].家畜生态,2001,22(4):56-59.
[16] 刘映娴,安立龙,许英梅,等.热应激对鸡生理机能的影响[J].饲料工业,2007,28(13):17-19.
[17] TEULIER L,ROUANET J L,LETEXIER D,et al.Cold-acclimation-induced non-shivering thermogenesis in birds is associated with upregulation of avian UCP but not with innate uncoupling or altered ATPefficiency[J].The Journal of Experimental Biology,2010,213(14):2476-2482.
[18] DUCHAMP C,BARRÉ H.Skeletal muscle as the major site of nonshivering thermogenesis in cold-acclimated ducklings[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,1993,265(5):R1076-R1083.
[19] ROUSSEL D,ROUANET J L,DUCHAMP C,et al.Effects of cold acclimation and palmitate on energy coupling in duckling skeletal muscle mitochondria[J].FEBS Letters,1998,439(3):258-262.
[20] MUJAHID A,SATO K,AKIBA Y,et al.Acute heat stress stimulates mitochondrial superoxide production in broiler skeletal muscle,possibly via downregulation of uncoupling protein content[J].Poultry Science,2006,85(7):1259-1265.
[21] TAOUIS M,DE BASILIO V,MIGNON-GRASTEAU S,et al.Early-age thermal conditioning reduces uncoupling protein messenger RNA expression in pectoral muscle of broiler chicks at seven days of age[J].Poultry Science,2002,81(11):1640-1643.
[22] TOYOMIZU M,UEDA M,SATO S,et al.Cold-induced mitochondrial uncoupling and expression of chicken UCP and ANT mRNA in chicken skeletal muscle[J].FEBS Letters,2002,529(2/3):313-318.
[23] COLLIN A,BUYSE J,VAN ASP,et al.Cold-induced enhancement of avian uncoupling protein expression,heat production,and triiodothyronine concentrations in broiler chicks[J].Gen Comp Endocrinol,2003,130(1):70-77.
[24] GASPARINO E,DEL VESCO A P,GUIMARÃES S E,et al.Age-related changes in mitochondrial UCP,ANT and COXⅢgene expression in the breast muscle of quails(Coturnix coturnix japonica)[J].Genetics Molecular Research,2012,11(3):1981-1989.
