电针对胰岛素抵抗模型大鼠GLUT4和GSK-3βmRNA 表达的影响
2014-12-19唐念珍唐成林陈晓琳
唐念珍 唐成林* 杨 辉 张 毅 田 源 谢 辉 陈晓琳
(1重庆医科大学中医药学院 重庆400016;2重庆医科大学第一临床学院 重庆400016)
胰岛素抵抗(Insulin resistance,IR)是胰岛的分泌功能正常,而胰岛素作用的主要靶器官组织(如肌肉、肝脏、脂肪组织等)对一定剂量的胰岛素所产生的生理效应低于原本正常水平的一种状态[1]。葡萄糖转运子4(GLUT4)和糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)是胰岛素信号传导下游通路上的重要影响因子,GLUT4是骨骼肌进行葡萄糖转运的主要载体蛋白,它仅能在胰岛素的刺激下,才能通过易位作用将葡萄糖转运到细胞膜上,促进葡萄糖的摄取和代谢[2]。其数目的减少,内在活性的降低或转位的障碍,均可导致骨骼肌对葡萄糖的摄取减少,胰岛素的敏感性下降,从而产生IR[3-4]。GSK-3β是一种丝氨酸/苏氨酸激酶,是胰岛素作用的关键负性调节因子,主要通过使糖原合酶磷酸化而失活,进而阻止糖原的合成,导致血糖升高,进而产生IR[5]。现阶段研究针刺治疗胰岛素抵抗大多是对胰岛素信号通路的上游因子(如PI3K等)的研究,而其对下游通路影响因子的研究相对缺乏。本课题组在此之前研究已证实,电针能够降低肥胖大鼠脂肪组织中CRP和IL-6等的表达,改善肥胖大鼠机体的炎症反应状态,而炎症反应与IR是息息相关的[6-9]。本研究通过观察胰岛素信号转导通路下游影响因子GLUT4和GSK-3βmRNA表达量的变化,探讨电针改善IR大鼠胰岛素抵抗状态。
材料和方法
1.材料
1.1 动物
健康清洁级4周龄雄性SD大鼠70只,体重80-100g,由重庆医科大学实验动物中心提供(医学动物合格证SCXK(渝)2012-0002)。
1.2 主要试剂及仪器
葡萄糖氧化酶试剂盒(中国上海荣盛生物药业公司);大鼠INS ELISA试剂盒(美国R&D公司);AU2700全自动生化分析仪(重庆医科大学生命科学院);RNA 提取试剂(Trizol);PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒(日本Takara);SYBR?倕 Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒(日本 Takara);MX3005P荧光定量PCR仪(重庆医科大学生命科学院);华佗牌针灸针(0.25mm×13mm,中国苏州医疗用品厂有限公司);SDZ-Ⅱ型电子针疗仪(中国苏州医疗用品厂有限公司)。
2.方法
2.1 胰岛素抵抗大鼠模型制备及分组
健康清洁级雄性SD大鼠70只,4周龄,体重80-100g。25℃左右恒温,湿度50%左右,明暗周期12h环境中适应性喂养1w后,随机选取10只大鼠饲以普通饲料,为普食组(common diet group,CD,n=10),其余60只饲以高脂高糖饲料,为模型组。饲料配方参考王艳军等[10]经实验验证的配方:基础饲料60%、猪油15%、蔗糖25%,基础饲料为重庆医科大学实验动物中心配制。每周同一时间各组大鼠称重一次。从第5w开始,每周对普食组和模型组大鼠从眼眶静脉窦采血1次,检测FPG、INS,并计算ISI,ISI参照李光伟等[11]方法:ISI=1/(空腹血糖×空腹胰岛素),因其为偏态分布 ,故取自然对数比较。8w后,以FPG、INS均较普食组显著升高(P<0.01),ISI显著下降(P<0.01)为胰岛素抵抗模型大鼠造模成功纳入标准,最终得到胰岛素抵抗大鼠44只。从中筛选40只随机分为4组:继续给予高脂高糖饮食的为高脂高糖1组(high-fat and high-carbohydrate diet 1,HFC 1,n=10),转为普食喂养的为高脂高糖2组(high-fat and high-carbohydrate diet 2,HFC 2,n=10),给予高脂高糖饮食和电针治疗的为电针1组(electroacupuncture 1,EA 1,n=10),给予普食和电针治疗的为电针2组(electroacupuncture 2,EA 2,n=10)。
2.2 治疗方法
每天早上9:00将各组大鼠固定于实验台上,针刺双侧足三里、三阴交,胃脘下俞,毫针匀速进针,足三里、三阴交斜刺5mm,胃脘下俞斜刺3mm,同侧足三里和胃脘下俞接通电针仪,每天一次,每次20 min,连续针刺2w。穴位定位参照李忠仁《实验针灸学》[12]大鼠穴位的定位方法:足三里(后三里)位于膝关节后外侧,在腓骨小头下约5mm处;三阴交位于后肢内踝尖直上10mm;胃脘下俞位于背部第8胸椎下,旁开5mm。电针参数的选择参照本课题组前期的研究结果:疏密波,频率20Hz,3mA(中等强度刺激)[8]。普食组、高脂高糖1组和高脂高糖2组不进行电针治疗,但进行固定,以排除大鼠应激等因素导致的实验偏差。
2.3 取材方法
各组大鼠禁食12h,10%水合氯醛(0.3ml/100g)腹腔注射麻醉,切开股四头肌皮肤及皮下,止血钳钝性分离肌肉组织,并切割为2块大小约为1.0cm×0.5cm×0.5cm的标本,置于液氮中转移至-80℃冰箱冻存待测。切开腹部,剪破膈肌,用5ml注射器直接刺入心脏取血1ml,静置20min,离心机3000r/min,离心10min,取血清待测。
2.4 检测指标
2.4.1 大鼠体重检测及日常行为活动观察
每周三上午由固定人员检测每只大鼠的体重,实验前后观察各组大鼠饮水量、进食量、大小便、精神及活动情况。
2.4.2 葡萄糖氧化酶法检测血糖浓度
严格按照葡萄糖测定试剂盒说明书进行操作。提前配制工作液:将R1试剂(苯酚)和R2试剂(磷酸盐缓冲液、4-氨基安替比林、葡萄糖氧化酶、过氧化物酶)等量混合均匀。取3支干燥试管,按照下表操作:
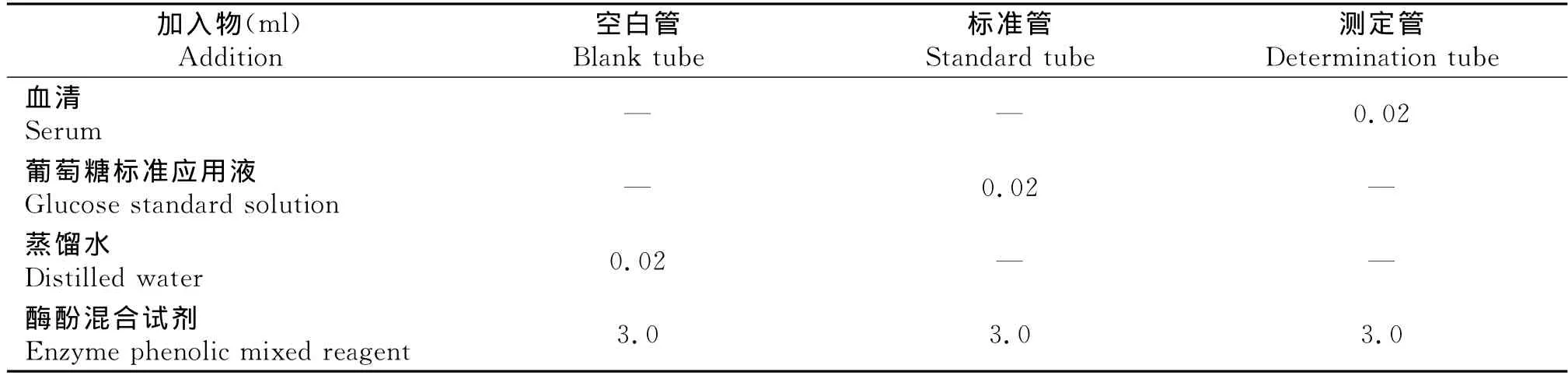
表1 葡萄糖氧化酶法加样表Table 1 Adding sample list of glucose oxidase method
充分混匀,置于37℃水浴15min,用全自动生化分析仪在波长505nm下测定标准管和测定管的吸光度值(A)。计算方法:血清葡萄糖(mmol/L)=(测定管吸光度/标准管吸光度)×5。
2.4.3 ELISA检测血清胰岛素浓度
应用生物素双抗体夹心法,按照ELISA试剂盒说明书进行操作。稀释标准品,设空白对照孔,标准品孔加标准品50μl,链霉素-HRP50μl,待测样品孔加入样品40μl,抗-INS抗体10μl,链霉素-HRP50 μl。盖上封板膜,轻轻震荡混匀,37℃温育60min。揭掉封板膜,弃去液体,甩干,每孔加满配置洗涤液,静置30s后弃去,重复5次,拍干。然后每孔先加入显色液 A 50μl,再加入显色液B 50μl,轻轻震荡混匀,37℃避光显色10min。每孔再加入终止液50μl,混匀后即刻用酶标仪在450nm波长下测定吸光度(OD值),空白孔调零,通过标准曲线计算血清中INS含量。
2.4.4 实时荧光定量PCR测GLUT4和GSK-3βmRNA表达水平
于超净工作台上,将-80℃冰箱冻存的大鼠股四头肌用液氮研磨至粉末,装入无菌EP管,按Trizol总RNA试剂提取说明书提取组织总的RNA,提取好的反应液放入紫外分光光度计测量RNA浓度及纯度,确保 OD260/OD280比值在1.8-2.0之间。按 PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书进行逆转录操作。目的基因及内参基因序列通过检索基因库获得,用Primer5设计引物,由Invitrogen Biotechnology中国公司合成。实时荧光定量PCR反应按SYBR?倕 Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒操作步骤进行,扩增反应条件:预变性95℃变性1min,循环40次,95℃15s,58℃20s,72℃20s,72℃延伸5min;溶解曲线72℃到95℃,每20s升温一次1℃。采用△△CT法计算结果:△△CT=(CT目的基因-CT内参基因)实验组-(CT目的基因-CT内参基因)对照组,目的基因的量=2-△△CT。
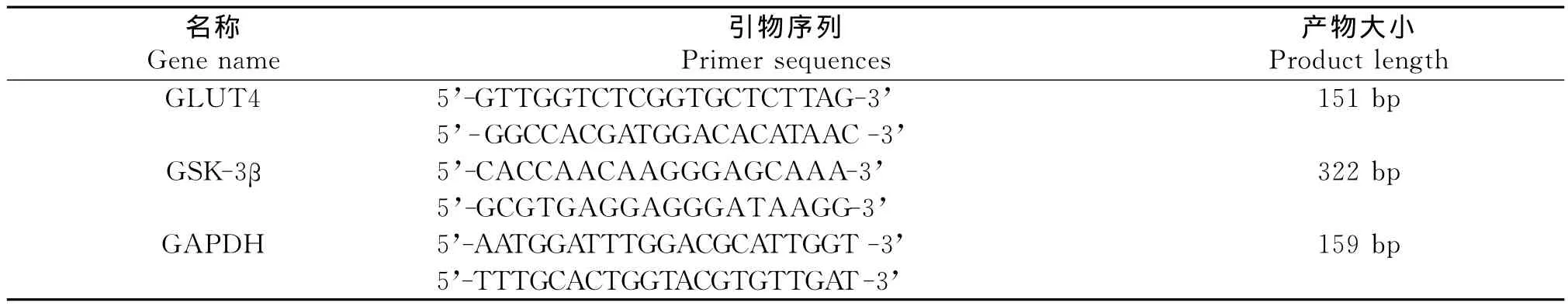
表2 目的基因与内参基因引物序列Table 2 Primer sequence of the target gene and reference gene
3.统计学处理
数据用均数±标准差(mean±SD)表示,用SPSS19.0进行统计软件进行单因素方差分析(One-way ANOVA),多组之间均数的两两比较采用Duncan多重检验。以P<0.05表示差异有统计学意义。
结 果
1.电针对胰岛素抵抗模型大鼠体重的影响
如图1所示,高脂高糖饮食喂养8w后,HFC组大鼠体重较CD组大鼠无显著差异,说明IR与体重增加并无必然联系。针刺治疗14d后,HFC1组大鼠体重治疗前后体重变化不明显(P>0.05),而HFC2组大鼠治疗前后体重减轻明显(P<0.01),说明单纯饮食控制对胰岛素抵抗大鼠体重减轻有较为显著的作用;EA1组较HFC1组体重明显减轻,EA2组较HFC组体重也明显减轻,提示电针在减轻IR大鼠体重上效果明确,在电针治疗过程中配合饮食控制更可加强其控制体重的作用。

图1 电针治疗前后胰岛素抵抗模型大鼠体重变化的比较Fig.1Effect of electroacupunctrue on body weight of the rats amongthe 5groups before and after treatmentaP<0.01vs common diet(CD)group;b P<0.01,c P<0.01vs high-fat and high-carbohydrate diet 1(HFC1)group;d P<0.01vs high-fat and high-carbohydrate diet 2(HFC2)group;e P<0.05vs electroacupuncture 1(EA1)group
2.电针对胰岛素抵抗模型大鼠血糖、胰岛素、胰岛素敏感指数的影响
如表1所示,高脂高糖组大鼠FPG、INS均较普食组明显升高,而ISI显著降低,提示大鼠有明显的胰岛素抵抗;EA组大鼠FPG、INS均较HFC组明显降低,ISI显著升高,提示电针在改善IR大鼠的FPG、INS、ISI上效果明显;HFC2组较HFC1组FPG差异无统计学意义(P>0.05),提示单纯饮食控制对胰岛素抵抗模型大鼠FPG影响不明显;HFC2组较HFC1组INS明显降低,ISI明显升高,EA2组较EA1组FPG、INS明显降低,ISI明显升高,提示在电针治疗过程中配合饮食控制可加强其改善胰岛素敏感性的作用。
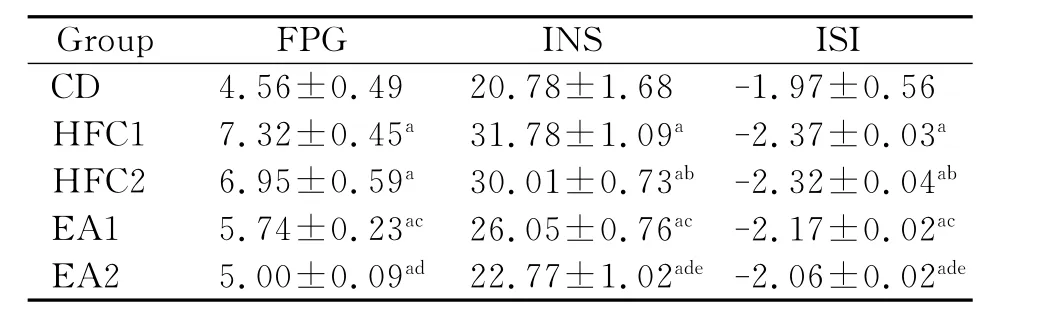
表3 电针对胰岛素抵抗模型大鼠血糖、胰岛素、ISI的影响比较Table 3 Effect of electroacupunctrue on fasting blood glucose,insulin and ISI contents among 5 groups in insulin resistance rats after treatment
3.电针对胰岛素抵抗大鼠骨骼肌GLUT4和GSK-3βmRNA表达量的影响
如图2、图3所示,HFC组GLUT4mRNA表达量明显低于CD组,GSK-3βmRNA表达量明显高于CD组,提示在IR大鼠骨骼肌中GLUT4mRNA表达量明显减少,GSK-3βmRNA表达量明显增多;EA组GLUT4mRNA表达量明显高于HFC组,EA组GSK-3βmRNA表达量明显低于HFC组,特别是EA 2组GSK-3βmRNA表达量与CD组比较无明显差异(P>0.05),提示电针在增强IR大鼠骨骼肌中GLUT4mRNA的表达和抑制GSK-3βmRNA的表达上有较显著的作用;HFC2组较HFC1组GLUT4mRNA表达量变化不明显(P>0.05),而GSK-3βmRNA表达量显著降低,提示单纯饮食控制对提高IR大鼠GLUT4mRNA的表达量无显著作用,对抑制GSK-3βmRNA的表达有较为显著的作用;EA2组较EA1组,GLUT4mRNA表达量显著升高,GSK-3βmRNA表达量显著降低,提示饮食控制与电针治疗结合可更好的改善大鼠胰岛素抵抗。

图2 电针对胰岛素抵抗模型大鼠骨骼肌GLUT4mRNA表达量比较Fig.2Effect of electroacupunctrue on the content of GLUT4mRNA in insulin resistance rat skeletal muscle among the 5groupsaP<0.01vs common diet(CD)group;b P>0.05,c P<0.01vs high-fat and high-carbohydrate diet 1(HFC1)group;d P<0.01vs high-fat and high-carbohydrate diet 2(HFC2)group;e P<0.01vs electroacupuncture 1(EA1)group
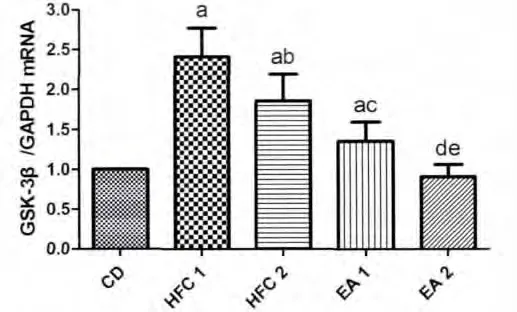
图3 电针对胰岛素抵抗模型大鼠骨骼肌GSK-3βmRNA表达量比较Fig.3Effect of electroacupunctrue on the content of GSK-3βmRNA in insulin resistance rat skeletal muscle among the 5groupsaP<0.01vs common diet(CD)group;b P<0.01,c P<0.01vs high-fat and high-carbohydrate diet 1(HFC1)group;d P<0.01vs high-fat and high-carbohydrate diet 2(HFC2)group;e P <0.01vs electroacupuncture 1(EA1)group
图4 ① 目的基因GLUT4扩增曲线;②目的基因GLUT4溶解曲线;③目的基因GSK-3β扩增曲线;④目的基因GSK-3β溶解曲线;⑤内参基因GAPDH扩增曲线;⑥内参基因GAPDH溶解曲线Fig.4①GLUT4gene amplification curve;②GLUT4gene dissociation curve;③GSK-3βgene amplificationcurve;④GSK-3β gene dissociation curve;⑤GAPDH gene amplification curve;⑥GAPDH gene dissociation curve
讨 论
胰岛素抵抗(IR)作为糖尿病的主要发病机制,近年来已经受到越来越多的关注,但是却一直欠缺良好的治疗手段。电针对胰岛素抵抗具有一定的改善作用[13],而胰岛素抵抗与炎症是相辅相成的。本课题组前期研究已经证实,电针可以减少肥胖大鼠脂肪组织中 CRP、IL-6、MCP-1、TNF-α等的表达,降低肥胖大鼠血清中TC、TG、LDL-C、FPG等的含量,从而改善肥胖大鼠机体的炎症反应状态[6-9]。
胰岛素的作用是通过胰岛素信号转导途径的正常传导来完成的。胰岛素信号转导途径目前已知至少有两条:IR-IRS-PI3K途径和MAPK途径。而实验证明了通过抑制MAPK的活性并不能降低胰岛素引起的糖转运和糖果原合成[14],在IR状态,IRIRS-PI3K途径的作用下降,MAPK介导的信号转导作用仍则正常[15]。外源性胰岛素(和)或葡萄糖刺激产生的胰岛素使胰岛细胞膜上的受体IRS活化后,与PI-3K结合使其活化,进而诱导无活性的Akt和PDK1从细胞质移位到细胞膜,使PDK1获得催化活性,使其自身磷酸化和Akt磷酸化,从而激活Akt。GSK-3β是Akt的直接底物,活化的Akt可使GSK-3β磷酸化而失活,导致糖原合成酶去磷酸化,从而糖原合成增加。GLUT4是骨骼肌和脂肪组织中最重要、受胰岛素调节的葡萄糖转运体[16]。而骨骼肌是胰岛素作用的主要靶组织,约80%胰岛素刺激的机体葡萄糖摄取是在骨骼肌进行的,机体胰岛素的敏感性极大地依赖于骨骼肌葡萄糖的摄取量[17]。GLUT4基因敲除小鼠研究证实,在基础状态下,胰岛素刺激或收缩刺激下,骨骼肌对葡萄糖转运均明显受损[18]。
当机体发生IR时,机体本身分泌胰岛素的功能正常,是其受体IRS与其结合的敏感度下降了,IRS的激活减少,从而PI3K的活化受到影响,进而引起Akt磷酸化减少,导致其下游因子GLUT4的激活也明显减少,葡萄糖的转运受损,血糖升高;而GSK-3β作为胰岛素信号转导途径的负性调节因子,可使糖原合成的关键因子糖原合成酶失活,而Akt可使其磷酸化而失活,当Akt磷酸化减少时,GSK-3β的活性增加,从而使糖原合成酶失活率增加,糖原合成减少,血糖升高。
根据经络腧穴理论,足三里为足阳明胃经之下合穴,三阴交为足太阴脾经腧穴,也是足三阴经的交会穴,脾主升清,胃主通降,为全身气机升降之枢纽。胃脘下俞为经外奇穴,位于足太阳膀胱经背部第一侧线上,大鼠第八胸椎棘突下旁开5mm。背俞穴是各内脏器官生理或病理状态时在体表背部的机能感应点。不同的背俞穴对各自所属的脏腑可产生十分明显的影响,这和背俞穴与所属脏腑之间存在密切的神经分布一致性有关。胃脘下俞主要为T8神经分布,T8主要是支配胰腺的传入神经,说明胃脘下俞与胰腺的神经分布有高度的对应性[19]。研究发现,针刺胃脘下俞有提高胰岛素含量,降低血糖水平,改善胰岛素敏感性的功效[20]。
本实验研究以电针刺激胰岛素抵抗模型大鼠“足三里”、“三阴交”、“胃脘下俞”穴为手段,以胰岛素信号通路下游因子GLUT4和GSK-3β为观测指标,探讨电针改善胰岛素抵抗模型大鼠胰岛素抵抗的机制。实验结果表明,8w后模型组IR大鼠体重并没有如预期比正常普食组大鼠体重增加明显,说明体重增加与胰岛素抵抗并无必然联系;电针治疗2周后,控制饮食的EA2组大鼠体重比HFC组IR大鼠体重明显减轻(P<0.01),说明电针治疗和(或)饮食控制对IR大鼠体重减轻有极为明显的作用。血糖、胰岛素及ISI结果显示,胰岛素抵抗大鼠体内胰岛素浓度明显升高(P<0.01),但血糖浓度并没有显著地降低,反而升高了,说明机体对胰岛素的敏感性明显降低了,而电针治疗和(或)饮食控制对其有明显的改善作用,特别是二者结合使用效果更佳。GLUT4mRNA的表达量结果显示,IR后其表达量显著降低(P<0.01),造成葡萄糖转运障碍,使血糖升高,而电针治疗和(或)饮食控制对其表达量的影响十分明显,从而有力地改善了骨骼肌葡萄糖的转运,使血糖降低。GSK-3βmRNA的表达量结果显示,IR后其表达量增加明显(P<0.01),从而对糖原合成酶的抑制作用就更加强烈,而电针治疗和(或)饮食控制有极为显著地改善作用,使糖原合成酶的抑制减少,糖原合成增加,血糖降低。
综上所述,电针改善大鼠胰岛素抵抗状态可能是通过影响胰岛素信号转导通路上的GLUT4和GSK-3βmRNA的表达量,从而影响葡萄糖摄取、转运和合成,进而改善高胰岛素血症、高血糖症,提高胰岛素敏感指数,改善胰岛素抵抗状态。
[1]秦胜花,夏宁.胰岛素受体、胰岛素受体底物-2在胰岛B细胞中的作用.广西医科大学学报,2005,22(4):644-645
[2]高磊,刘绛光.对葡萄糖转运蛋白的讨论.国外医学临床生物化学与检验学分册,1999,20(6):274-275
[3]Manreen J C,Naira G,J SkyeL.Use of GLUT4null mice to study skeletal muscle glueose uptake.Clinical and Experimental Pharmacology and Physiology,2005,32:308-313
[4]Hakam A,Adrian C,Jan F.Two Phases of palmitate-induced insulin resistance in skeletal musele:impaired GLUT4translocation is followed by a reduced GLUT4 intrinsic aetivity.Am J Physiol Endocrinol Metab,2007,293:E783-E793
[5]Nikoulina SE,Ciaraldi TP,Mudaliar S,et al.Potential role of glycogen synthase kinase-3in skeletal muscle insulin resistance of Type 2diabetes.Diabetes,2000,49(2):263-271
[6]刘祖丽,唐成林,余敏等.电针刺激对肥胖大鼠脂肪组织C反应蛋白、白细胞介素-6表达的影响.重庆医科大学学报,2011,36(4):429-432
[7]余敏,肖晓秋,唐成林等.不同强度电针对肥胖大鼠血脂、脂肪组织巨噬细胞趋化蛋白-1及肿瘤坏死因子-α的影响.针刺研究,2011,36(2):79-84
[8]郜婕,唐成林,刘仁健等.不同强度电针对肥胖大鼠附睾脂肪细胞内质网应激的影响.中国病理生理杂志,2013,29(2):354-357
[9]郜婕,唐成林,刘仁健等.不同强度电针对肥胖大鼠细胞因子信号转导抑制蛋白-3及过氧化物酶体增殖物激活受体-γmRNA表达的影响.针刺研究,2013,2(38):31-34
[10]王艳军,孙巍巍,张丽霏等.胰岛素抵抗大鼠肌肉中IRS-1、P70S6K 的表达.中国现代医学杂志,2009,19(11):1617-1624
[11]李光伟,潘孝仁,Lilliujas,等.检测人群胰岛素敏感性的一项新指数.中华内科杂志,1993,32(10):656
[12]李忠仁.实验针灸学.北京:中国中医药出版社,2007:255-257
[13]徐炳国,刘志诚.针灸对肥胖并发高血压瘦素胰岛素抵抗的影响.上海中医药杂志,2005,39(10):37-39
[14]Pessin JE,Saltiel AR.Signaling pathways in insulin action:mole-cular targets of insulinresistance.JclinInvest,2000,106(2):165-169
[15]Cusi K,Maezono K,Oaman A,et al.Insulin resistance differentiallyAffects the pi3-kinase and MAPkinase-mediated signaling in humanmuscle.JclinInvest,2000,105(3):311-320
[16]王艳军.PKB、GSK、P70S6K在胰岛素抵抗大鼠中的表达.中国医科大学,2007,04
[17]李梅.针刺调节胰岛素抵抗模型大鼠IRS-1、IRS-2和GLUT4的实验研究.广州中医药大学,2011,5
[18]Zisman A,Peroni 0D,Abel E D,et a1.Targeted disruption of theglucose transporter 4selectively in muscle causes insulin resistance and glucose intolerance.Nat Med,2000,6:924-928
[19]钟世镇.系统解剖学.北京:高等教育出版社,2003,9:349-352
[20]石锦萍,钟柏松,毛敬伟等.胃脘下俞与胰腺相关性的实验研究.中国针灸,2001,21(8):485-487
