4-乙基愈创木酚转化菌的筛选、鉴定及转化性能的研究*
2014-12-16肖澎袁华伟何桂强杨吉蓉吴重德黄钧周荣清
肖澎,袁华伟,何桂强,杨吉蓉,吴重德,黄钧,周荣清,2
1(四川大学 轻 纺与食品学院,四川 成都,610065)2(皮革化学与工程教育部重点实验室,四川成都,610065)
4-乙基愈创木酚(4-Ethylguaiacol,简称4-EG)又名4-乙基-2-甲氧基苯酚(4-Ethyl-2-methoxy-phenol),分子式为C9H12O2,分子量152 Da,具有烟熏及温和的烤肉味[1-3],属酱香型香料,是一种重要的天然呈香化合物。该化合物在酱油、酒等许多食品中得到广泛应用[4-5]。通常通过以下的方法获得:(1)从天然木油中精馏;(2)由愈创木酚或香荚兰乙酮人工合成;(3)通过生物转化。精馏提取操作复杂,成本高,而人工合成所需要的反应条件比较苛刻,且因需要剧毒的锌汞参与反应,难以工业化。生物转化法具有周期短,反应条件温和,价格低廉,无污染,生产成本低等优点,已引起各国研究者的高度关注[6]。
1995年,Duncan等[7]发现了赋予酱油烟熏气味的主要原因是Brettanomyces anomalus将小麦麸皮中的阿魏酸转化为4-EG所致。Suezawa[8]探讨了Candida属酵母在含15%NaCl胁迫环境中将阿魏酸(FA)转化为挥发性酚的途径:首先FA经脱羧酶催化转化为4-乙烯基愈创木酚(4-vinyguaiacol,4-VG),随后被还原酶催化转化为4-EG,见图1。在已发现微生物中,Pichia anomala、Pichia subpelliculosa、Debaryomyces hansenii及一些Candida属酵母及Bacillus subtilis和耐盐的Staphylococcus xylosus等细菌只是将FA转化为4-VG[9],目前一些植物乳酸杆菌和肠杆菌可将 FA 转化为4-EG[10-13]。
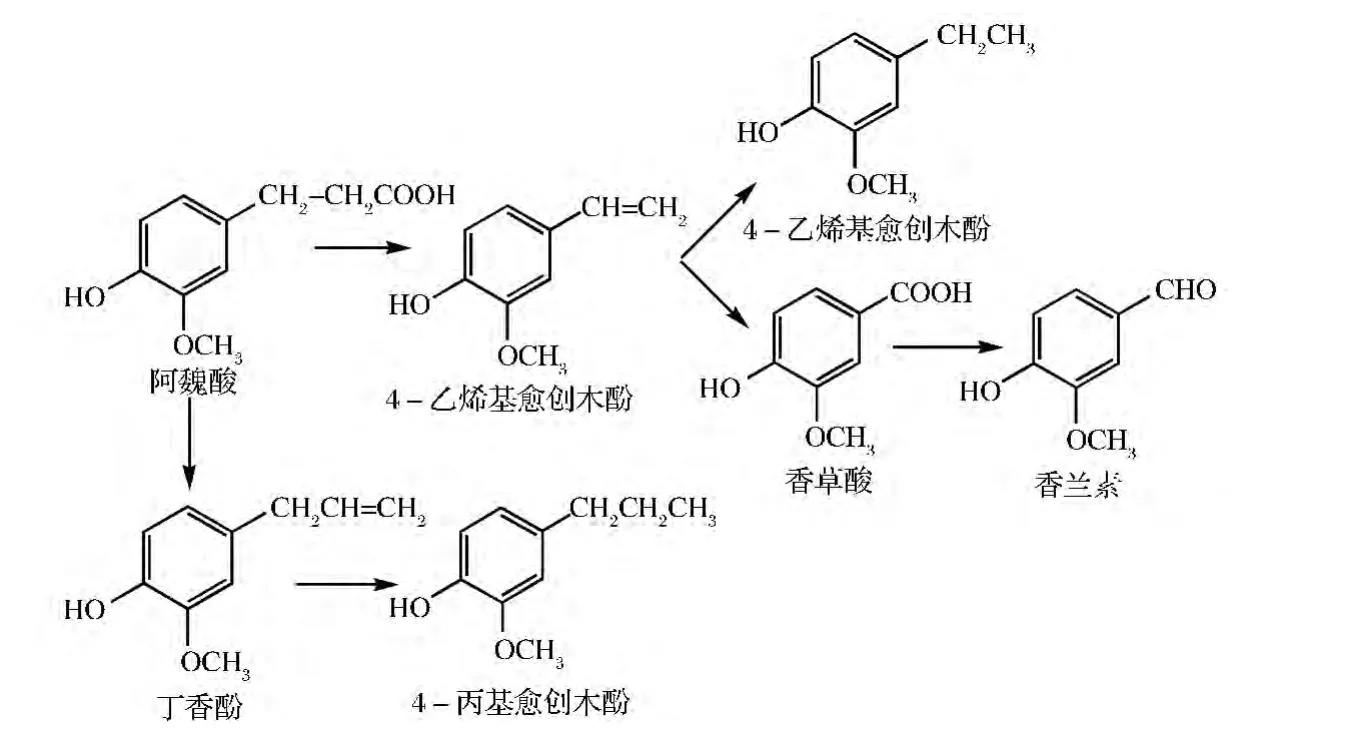
图1 4-EG生物合成途径Fig.1 Biosynthetic pathway of 4-EG
在众多食品中,4-EG是特性的呈香组分,微生物的生物转化是重要的来源之一,但除了在酱油中应用的Candida属等少数种属菌株被确认外,其余的缺乏直接证据。本研究以FA为惟一的碳源,筛选到1株能高效转化FA为4-EG的分离株,根据分离株生理生化、形态的研究并结合16S r DNA序列分析鉴定其种属关系。
1 材料和方法
1.1 材料
1.1.1 样品来源
酱香型大曲取自郎酒股份有限公司大曲车间。
1.1.2 培养基
①种子培养基:牛肉膏蛋白胨培养基;②筛选培养基:参见文献[14]所述方法将阿魏酸添加到VP培养基[13]中,使 FA 含量为 1g/L;③麸皮固体培养基[15]。
1.1.3 主要试剂和仪器
2-辛醇,美国Sigma-Aldrich公司;4-EG标准品,英国Alfa Aesar公司;FA,上海阿拉丁试剂有限公司;其他试剂均为国产分析纯。
气相色谱-质谱联用仪:TraceDSQⅡ(Thermo Fisher公司,美国)配备毛细管色谱柱(TR-5MS,Thermo Fisher公司,美国);电泳仪:PowerPac Basic(Bio-Rad,美国);凝胶成像仪:Gel Doc XR(Bio-Rad,美国);Spectrumlab22PC可见分光光度计(Perkin ElmerTM,美国);高速冷冻离心机:TGL16M(湘麓离心机仪器有限公司,长沙);光学显微镜:CX31RTSF(Olympas,日本);Biolog全自动微生物鉴定仪(Biolog公司,美国);超声波细胞粉碎机:JY-92IIN(新芝生物科技股份有限公司,宁波)。
1.2 菌种分离及筛选
称取2 g曲粉装入含有18 mL无菌水的150 mL玻珠三角瓶中,振荡打散后,置于 80℃热处理10 min,梯度稀释后涂布于种子培养基平板上,37℃培养1 d,随机挑选单菌落经划线分离为纯菌落,接种到斜面培养基上待筛选。
初筛:分离株经活化后,分别接入筛选培养基中,振荡培养(37℃、130 r/min)6 d后,过滤发酵液,以2-辛醇作为内标,通过GC/MS检测挥发组分4-EG及4-VG的相对含量,选出转化率高的菌株进行下一步复筛。
复筛:将初筛的4-EG高转化率菌株活化,培养成种子菌悬液,接入筛选培养基中,振荡培养(37℃、130 r/min)6 d后,GC/MS检测4-EG及4-VG的相对含量。
1.3 菌株鉴定
1.3.1 菌落及菌体形态观察
复筛的目的菌株,将其菌悬液梯度稀释后,涂布于牛肉膏-蛋白胨琼脂平板上,37℃培养32h,观察菌落形态;挑单个菌落分别用光学显微镜及扫描电子显微镜观察个体形态。
1.3.2 生理生化特征
①生理生化性能检测:根据Biolog全自动鉴定仪说明书的规定程序,采用革兰氏染色阳性的细菌鉴定板进行生理生化性能测定。②耐热性研究:菌悬液分别接种到牛肉膏-蛋白胨和麸皮固体培养基中,将液态培养的温度设定为30、37、45、50和55℃,培养1 d后,比浊法检测菌体浓度。固态培养的温度设定为30、37、45、55、65 和70 ℃,培养3 d 后,涂布计数法检测菌落数量。
1.3.3 菌种16S rDNA鉴定
离心收集培养至对数生长后期的菌体,采用Bacterial DNA Kit试剂盒提取总DNA。提取得到的总DNA采用0.6%琼脂糖凝胶电泳检测其纯度。采用细菌通用引物(27f:5’-AGAGTTTGATCCTGGCTCAG-3’;1492r:5’-GGCTA CCTTGTT ACGACT T-3’)对总DNA进行PCR扩增,送至上海生工公司进行测序[16]。将测序得到的16S rDNA序列在eztaxon上进行BLAST比对后,与GenBank数据库做相似性分析。
1.4 转化特性的研究
1.4.1 筛选菌株不同组分转化性能的研究
培养至对数期的培养液经冷冻离心分离(4℃,10 000 r/min)5min,分别收集上清液和菌团,分别考察菌体及胞内外组分对4-EG转化的影响:1)以含1g/L FA的无菌水为空白样。2)用含1g/L FA的无菌蒸馏水将菌团制成菌悬液(OD600=1,pH=7);3)同2)的菌悬液,经超声处理(总时间30 min,超声时间2 s,间隔时间4 s,功率390 W)破碎细胞后加入FA使其浓度为1 g/L;4)上清液中加入FA,浓度为1 g/L;5)发酵液加入FA,浓度为1g/L。分别在37℃、130 r/min条件下培养2 d,检测4-EG的含量。
1.4.2 不同组分酶活的测定
分别考察胞内组分及胞外组分中脱羧酶及还原酶的酶活力大小,反应体系由50 mmol/L磷酸盐缓冲液(pH 7.0)和1g/L FA或者1g/L 4-VG组成,分别将1.4.1中的上清液及破壁菌液浓缩3倍,以10%(V/V)加入到反应体系中,于37℃反应1 h。反应体系中4-VG及4-EG的产量由GC/MS测定。1个脱羧酶(还原酶)酶活力单位的定义:每分钟1 μmol 4-VG(4-EG)的产量。
1.4.3 发酵温度对转化的影响
培养至对数期的培养物,调节菌体浓度为OD600=1,培养基pH=7,加入FA使其质量浓度为1 g/L,分别取50 mL装入250 mL三角瓶中,置于30℃、37℃、41℃、45℃、50℃、55℃ 培养2 d,测定4-EG的含量。
1.5 代谢产物GC/MS分析
发酵液在4°C下10 000 r/min离心5 min,收集上清液,加入5倍量的二氯甲烷及一定量的2-辛醇(内标)超声萃取15min,经分液漏斗得到有机相,重复提取2次。向有机相中加5 g无水Na2SO4,12 h,过滤,在冰浴中经氮气吹扫浓缩至0.5 mL供GC/MS检测分析[12,17]。
色谱条件:进样口温度为250℃,初始温250℃;分流模式,分流比10∶1;升温程序,初始温度80℃,保持2 min,以10℃/min升到210℃;载气:高纯氦气,流速为1 mL/min。质谱条件:连接口温度:250℃;电离方式:EI;电子能量:70 eV;离子源温度:200℃;扫描范围:40~500 amu,检出物经GC/MS标准谱库(NIST05)检索及标准品的保留时间进行鉴定。
2 结果与分析 [D4]
2.1 4-EG产生菌株筛选
102株分离株接种到筛选培养基中,37℃、130 r/min振荡培养6 d,检测挥发性组分,以挥发性组分中的4-EG相对含量为基准,初筛的6株高产菌进行复筛,结果如表1。D-31菌株发酵液中的挥发性组分中4-VG及4-EG含量、4-EG摩尔转化率均较高。
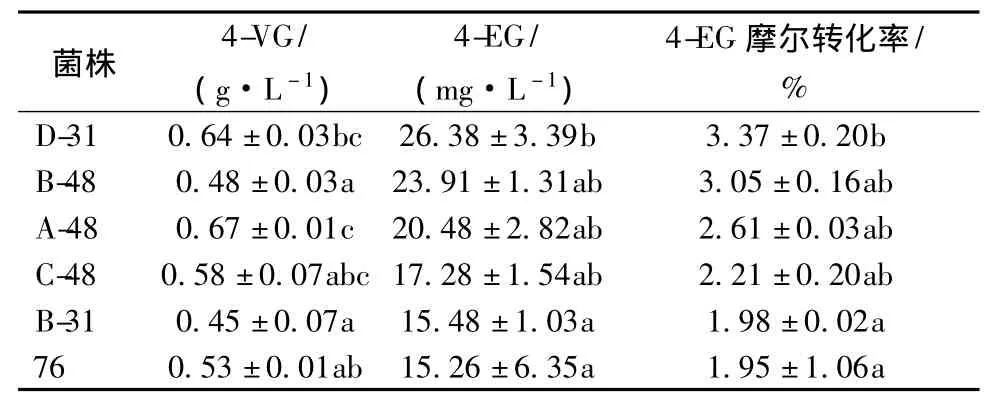
表1 菌株复筛结果Table 1 Results of strain rescreening
2.2 菌株鉴定
2.2.1 菌落及细胞形态观察
D-31经活化后,梯度稀释涂布在牛肉膏-蛋白胨琼脂培养基上,37℃培养32 h,观察菌落形态(图2B),菌落表面粘稠,边缘处乳白色一圈突起,类似火山口,呈不规则形态。菌体形态为杆状,单生,革兰氏阳性,产芽孢,芽孢中生,菌体形态的电镜图如图2A所示。

图2 D-31菌株形态Fig.2 Morphology of strain D-31
2.2.2 生理生化特征
采用95种碳源的革兰氏染色阳性细菌鉴定板对其生理生化性能测定,分析结果表明,该菌株与Bacillus subtilis相似度是100%,与其他菌属相似率均为0%,结合菌落、菌体形态观察结果并参考《伯杰氏系统细菌学手册》(第二版),初步判断为Bacillus subtilis。该菌株液体培养,最适生长温度是37℃,温度在45~50℃能生长,高于55℃时,基本停止生长(图3)。固态培养,适合生长温度范围是30~45℃之间,最适温度:37℃,同样大于55℃时,停止生长,部分菌体死亡,大部分以芽孢形式存活(表2)。
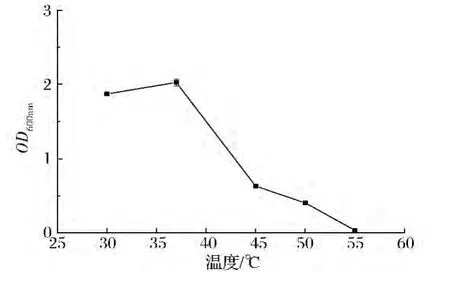
图3 液态发酵D-31菌株在不同温度下的生长情况Fig.3 Effect of temperature on the growth of D-31 strain in submerged fermentation

表2 固态发酵D-31菌株不同温度的生长情况Table 2 Effect of temperature on the growth of D-31 strain in solid fermentation
2.2.3 16S rDNA 鉴定
D-31菌株16SrDNA核苷酸序列全长为1257 bp,在GenBank中登录号为KF702383,经多序列同源性分析,得到12个有100%同源性的菌株,系统发育树中D-31菌株与Bacillus subtilis(AMXN01000021)属同一分枝 (图4),确定为 Bacillus subtilis,暂编号为D-31。

图4 菌株D-31基于16S rDNA序列构建的系统发育树Fig.4 Phylogenetic tree based on partial 16S rDNA sequences of strain D-31
2.3 转化特性的研究
2.3.1 发酵液不同组分转化能力
发酵物、活菌体和上清液均能将FA转化为4-EG(图5),但上清液的转化效率高于细胞碎片和菌体组分,而菌悬液的催化活性最高。催化组分的性质及机理需进一步研究。

图5 不同类型转化形成4-EG的情况Fig.5 Formation of 4-EG in different types
2.3.2 不同组分酶活力的测定
测定其胞内组分及胞外组分中脱羧酶及还原酶的酶活力结果如表3所示,上清液组分中的4-VG还原酶酶活力高于细胞碎片洗涤物中的。但前者的FA脱羧酶酶活小于后者,可能是胞外中间产物4-VG迅速转化为4-EG及其他代谢物,无法积累所致。该结果表明B.subtilis D-31是FA脱羧酶和4-VG还原酶共同催化FA转化为4-EG,与先前的报道一致[8]。
2.3.3 发酵温度对转化的影响
由图6可知,目的菌株转化阿魏酸生成4-EG的最适发酵温度为45℃,在30~45℃,随着温度的增加,代谢产物4-EG的产量呈递增趋势,超过45℃后,4-EG产量迅速减少。

图6 温度对4-EG转化产量的影响Fig.6 Effect of temperature on transformation of 4-EG
2.4 代谢产物分析
发酵上清液经GC/MS检测,检出19种挥发性组分,如丙酮酸甲酯、2,3-丁二醇、异丁酸、4-EG、4-VG、油酸乙酯等(见图7),占总检出峰的56.13%。其中,酯类占0.8%,醇类占1.41%,烷烃类占2.31%,酸类占0.28%,酚类物质占51.18%。这19种挥发性组分中4-VG和4-EG所占总峰比例最高,分别为45.64%[(0.64±0.03)g/L]和5.28%[(26.38±3.39)mg/L]。

表3 不同组分酶活力测定Table 3 Enzyme activity assay from different components
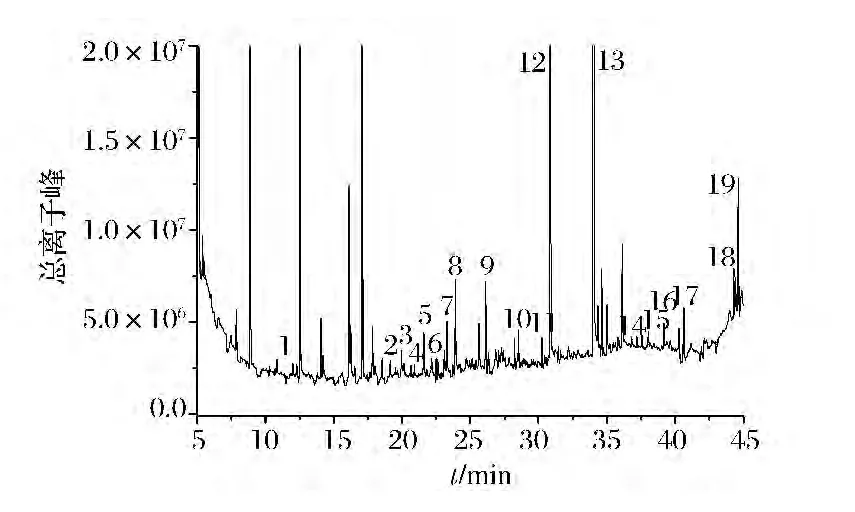
图7 D-31菌株发酵液芳香组分的总离子流图Fig.7 Total ion chromatorgraphy of aromatic components in fermentation broth
3 讨论
本研究利用FA为唯一碳源的定向培养基,以挥发性组分图谱及4-EG相对含量为基准,从酱香型大曲中分离出1株具有高效转化阿魏酸形成4-EG能力的菌株。通过菌落及菌体形态观察,以及生理生化性能的结果初步鉴定为Bacillus subtilis,16S rDNA的遗传鉴定证实。对FA转化4-EG的特性的初探结果表明,参与转化作用的是胞外上清液的某些组分。虽然已有文献报道在耐盐酵母的胞外组分是以FA脱羧酶及4-VG还原酶为主的混合物质[5],但具有转化FA为4-EG特性的Bacillus subtilis的转化机制未见报道,需要进一步研究。
[1]Moyano L,Zea L,Moreno J,et al.Analytical study of aromatic series in sherry wines subjected to biological aging[J].Journal of Agricultural and Food Chemistry,2002,50(25):7 356-7 361.
[2]Lindsay R F,Priest F G.Decarboxylation of substituted cinnamic acids by enterobacteria:the influence on beer flavour[J].Journal of Applied Microbiology,1975,39(2):181-187.
[3]Aznar M,López R,Cacho J F,et al.Identification and quantification of impact odorants of aged red wines from Rioja.GC-olfactometry,quantitative GC-MS,and odor evaluation of HPLC fractions[J].Journal of Agricultural and Food Chemistry,2001,49(6):2 924-2 929.
[4]崔云前,曹小红,王春玲,等.发酵行业4-乙烯基愈创木酚和4-乙基愈创木酚研究进展[J].中国酿造,2009(4):14-17.
[5]周恒刚.4-乙基愈创木酚[J].酿酒,1989(6):7-9.
[6]陈朋,李红玉,刘超群.微生物转化合成香兰素[J].现代生物医学进展,2010,10(2):385-388.
[7]Edlin D A,Narbad A,Dickinson J R,et al.The biotransformation of simple phenolic compounds by Brettanomyces anomalus[J].FEMS Microbiology Letters,1995,125(2-3):311-315.
[8]Suezawa Y.Bioconversion of ferulic acid and p-coumaric acid to volatile phenols by halotolerant yeasts[J].Nippon Nogeikagaku Kaishi,1995,69(12):1 587-1 596.
[9]Suezawa Y,Suzuki M.Bioconversion of ferulic acid to 4-vinylguaiacol and 4-ethylguaiacol and of 4-vinylguaiacol to 4-ethylguaiacol by halotolerant yeasts belonging to the genus Candida [J].Bioscience,Biotechnology,and Biochemistry,2007(4):1 058-1 062.
[10]Cavin J F,Andioc V,Etievant P X,et al.Ability of wine lactic acid bacteria to metabolize phenol carboxylic acids[J].American Journal of Enology and Viticulture,1993,44(1):76-80.
[11]Bloem A,Bertrand A,Lonvaud Funel A,et al.Vanillin production from simple phenols by wine-associated lactic acid bacteria [J].Letters in Applied Microbiology,2007,44(1):62-67.
[12]李雪梅,徐若飞,杨黎华,等.利用香荚兰内生菌制备天然香料及其在卷烟中的应用[J].烟草科技,2008,248(3):31-34.
[13]LI X,YANG J,LI X,et al.The metabolism of ferulic acid via 4-vinylguaiacol to vanillin by Enterobacter sp.Px6-4 isolated from Vanilla root[J].Process Biochemistry,2008,43(10):1132-1137.
[14]许美玲,王芳.链霉菌转化阿魏酸生产香草酸[J].北京化工大学学报:自然科学版,2007,34(z2):99-102.
[15]庄名扬,王仲文.酱香型高温大曲中功能菌 B 3-1菌株的分离,选育及其分类学鉴定[J].酿酒,2003,30(5):26-27.
[16]谢菲,李从虎,郑佳,陈欣,黄均,周荣清.角蛋白酶生产菌株的分离筛选与鉴定[J].微生物学报,2010,50(4):537-541.
[17]ZHU B,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].Journal of Industrial Microbiology& Biotechnology,2010,37(8):815-821.
