脂肪酶抑制剂Lipstatin的发酵罐发酵工艺优化
2014-12-16孙菲
孙菲
(福建省微生物研究所,福建福州,350007)
胰脂肪酶抑制剂Lipstatin由毒三素链霉菌(Streptomyces tocytricini)代谢产生,它通过选择性地抑制胃肠道内的胰脂肪酶减少30%的脂肪的分解和吸收,从而达到减重的目的,是目前唯一通过非中枢神经系统作用治疗肥胖症的药物[1-2],其作用机制独特,安全性高。Lipstatin的四氢衍生物Orlistat(奥利司他)已被罗氏公司成功开发为减肥药Xenical(赛尼可)。由于近年来减肥药安全问题频发,导致了一系列减肥药物退出市场[3~6]。继2010年 Sibutramine下架后,Oristat是目前市场上唯一的OTC减肥药,占据了减肥药市场80%的市场份额[7]。作为Oristat合成的关键中间体,生物合成Lipstatin的发酵备受关注。目前国内对Lipstatin发酵的研究多见于摇瓶水平的研究[8~12],发酵罐工艺方面的报道较少。
本研究前期对Lipstatin摇瓶发酵条件进行了一系列的优化并取得了较好的结果[13],但是摇瓶发酵条件和工业化发酵罐生产之间存在着差异,通常不是简单的放大。从摇瓶到发酵罐的过渡,在放大过程中往往出现随着发酵规模的扩大,目标产物的产量不断下降的放大效应[14]。目前国内能进行Lipstatin发酵生产的企业仅有两家[15],这与其在放大过程中出现的技术难点有关。本研究在前期摇瓶工作的基础上,利用10 L全自动发酵罐进行搅拌工艺、通气量及补料工艺的优化,为Lipstatin的工业化生产提供依据。
1 材料与方法
1.1 菌株
Streptomyces tocytricini FIM-1015,由福建省微生物研究所保藏。
1.2 培养基及摇瓶培养方法
1.2.1 斜面琼脂培养基及培养方法
可溶性淀粉1%,蛋白胨 0.8%,NaCl 2.0%,Mg-SO40.03%,K2HPO40.02%,琼脂 1.8%,pH 7.5,28 ℃培养7d。
1.2.2 种子培养基及培养方法
甘油2.5%,黄豆饼粉2.5%,酵母粉0.5%,葵花籽油 1.0%,KH2PO40.05%,MgSO40.05%,琼脂1.8% ,pH 7.0,装量50 mL/500 mL,28 ℃培养30 h。
1.2.3 发酵培养基及培养方法
豆油5%、甘油 1.5%,黄豆粉 2%,玉米浆粉0.85%,卵磷脂1.5%,pH 7.0,装量 50 mL/500 mL,摇床转速280 r/min,28℃培养8d。
1.3 分批发酵培养方法
发酵罐为BGZ-7智能型机械搅拌发酵罐(上海保兴生物设备),体积10 L,摇瓶种子按1.2.2培养方法制备,接种量2.5%。发酵罐内培养基装量7L,发酵温度28℃,罐压0.04 MPa,控制搅拌转速及溶氧,实时监控各项参数。
1.4 测定方法
1.4.1 Lipstatin 发酵效价测定
试样制备发酵液与无水乙醇1∶4稀释摇匀浸泡1 h,10 000 r/min离心10 min,取上清液用高效液相色谱法(HPLC)测定Lipstatin发酵效价。
HPLC色谱条件 色谱柱C18ODS(4.6 mm×250 mm,5 μm),检测器DAD(HP1100),柱温40 ℃,检测波长195 nm,流动相为乙腈∶水(85∶15),流速1 mL/min。
1.4.2 pH 测定
采用酸度计测定。
1.4.3 菌体干重测定(DCW)
取10 mL发酵液,4 000 r/min离心10 min,菌体沉淀经2次蒸馏水洗涤后,用干燥定量滤纸过滤,105℃烘干至恒重,称量菌丝体干重。
1.4.4 菌丝形态观察[16]
菌丝经石炭酸美蓝复合染色剂染色后以显微镜油镜观察。
2 结果与分析
2.1 溶氧对Lipstatin发酵的影响
摇瓶发酵过程中的溶氧是由空气通过瓶口的介质扩散来提供氧气的,通过调整摇瓶装液量及摇瓶转速控制摇瓶发酵中的溶氧水平考察溶氧对Lipstatin发酵的影响。表1为500 mL摇瓶中不同装液量对Lipstatin发酵的影响,实验结果表明摇瓶装液量对Lipstatin发酵效价的影响较大,当装液量高于50 mL/500 mL三角瓶时,其发酵效价显著下降。表2为不同摇床转速对Lipstatin发酵效价的影响,实验结果显示,当摇床转速低于280 r/min时,Lipstatin发酵效价降低,当摇床转速为200 r/min时,其相对效价仅为对照的53.1%。表1和表2的结果均表明Lipstatin发酵对溶氧的要求较高。

表1 摇瓶装液量对Lipstatin发酵效价的影响Table 1 The effect of medium volume on Lipstatin productivity

表2 摇床转速对Lipstatin发酵效价的影响Table 2 The effect of rotating speed of shaking bed on Lipstatin procuctivity
2.2 剪切力对Lipstatin发酵的影响
发酵罐采用机械搅拌方式增加溶氧水平,搅拌产生的剪切力对菌株发酵有一定的影响。在摇瓶中添加玻璃珠可以模拟发酵罐中机械搅拌对微生物发酵的影响。表3为添加直径为5mm玻珠对Lipstatin发酵效价的影响,实验结果表明添加玻璃珠个数对Lispstatin发酵效价影响较大,当添加4个玻璃珠时,其效价下降约40%,说明Lipstatin产生菌Streptomyces tocytricini FIM-1015对剪切力较为敏感,过强的剪切力易致菌丝体受到机械损伤,抑制菌体生长,不利于Lipstatin的生物合成。

表3 玻璃珠个数对Lipstatin发酵效价的影响Lable 3 The effect of glass beads number on Lisptatin productivity
2.3 Lipstatin 10 L发酵罐分批发酵工艺优化
从2.1的结果可知,Lipstatin的发酵对溶氧的要求较高,发酵罐分批发酵其溶氧水平与搅拌速度、通气量及发酵液浓度等因素相关,因此Lipstatin发酵罐分批发酵将对以上工艺进行优化。
2.3.1 搅拌工艺对Lipstatin 10 L发酵罐分批发酵的影响
鉴于Lipstatin的发酵对溶氧的要求较高,同时对剪切力较为敏感,因此制定Lipstatin 10 L发酵罐分批发酵的搅拌工艺策略为发酵前期低转速搅拌以保证菌丝体的生长,发酵中后期提高搅拌速度,改善溶氧,促进Lipstatin的生物合成。
2.3.1.1 起始搅拌速度的考察
按1.3的培养方法,设起始搅拌速度为150、200、250、300 r/min,通气量为 10 L/min,24 h 取样观察菌丝形态,比较不同起始搅拌速度下的菌体量、溶氧水平及Lipstatin产生效价。实验结果表明,当搅拌起始转速为250、300 r/min时,由于搅拌产生的剪切力过大,菌丝体断裂自溶(图1-c、图1-d),不利于菌丝体生长,发酵周期内菌体量极低(图2-a),几乎无效价产生。起始搅拌速度为150、200 r/min时,菌丝体生长健壮(图1-a、图1-b),但起始搅拌速度为200 r/min时,发酵罐溶氧水平高于搅拌速度为150 r/min时,相应地,其菌体量及发酵效价也高于搅拌速度为150 r/min(图2-a、图2-b)。因此,选择200 r/min作为Lipstatin发酵的起始搅拌速度。
2.3.1.2 搅拌终速度的考察
从2.3.1.1 的结果可知,0 ~24 h 为 Lipstatin 产生菌Streptomyces tocytricini FIM-1015的对数生长期,菌体生长24 h后菌体量增高(图2-a),对剪切力的耐受力增强,此时增加搅拌转速对菌体生长的不利影响较小。同时0~24 h间耗氧量增大,罐内溶氧量急剧下降,使得Lipstatin的发酵效价远低于摇瓶水平(图2-b)。因此,选择在发酵24 h后开始逐渐增加搅拌转速。
由图2-b可见,Lipstatin发酵效价自96 h开始大幅提高,因此,搅拌工艺选择自24 h逐渐增加至96 h达到终速度。按1.3的培养方法,设搅拌终速度为400、450、500、550 r/min,比较不同搅拌终速度对 Lipstatin发酵过程中的溶氧及发酵效价的影响。

图1 不同起始搅拌速度对菌丝形态的影响Fig.1 The effect of initiative mixing speed on mycelial morphology
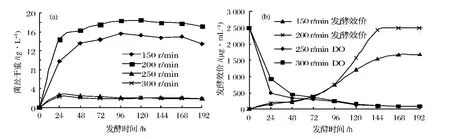
图2 不同起始搅拌速度对Lipstatin发酵的影响Fig.2 The effect of intiative mixing speed on Lipstatin productivity

图3 不同搅拌终速度对Lipstatin发酵的影响Fig.3 The effect of ultimate mixing speed on Lipstatin producitivity
图3结果表明,搅拌转速对Lipstatin发酵的溶氧水平和效价有显著影响。搅拌终转速在400~550 r/min范围内,随着搅拌终转速的增加,发酵罐溶氧水平及Lipstatin发酵效价随之提高,但搅拌终转速为500 r/min时其发酵效价与550 r/min时相差不大,因此最佳搅拌终转速为500 r/min。通过优化搅拌工艺,使Lip-statin发酵效价达到4 300 μg/mL,与摇瓶发酵水平相当。发酵时间为168 h,比摇瓶发酵时间缩短1d。
2.3.2 通气量对Lipstatin 10 L发酵罐分批发酵的影响
按1.3培养方法,采取2.3.1搅拌工艺进行Lipstatin 10 L发酵罐分批发酵,设通气量分别为8、10、12、15 L/min,比较不同通气量下的溶氧及Lipstatin发酵效价,以确定最佳通气量。
实验结果表明(图4),通气量对溶氧及Lipstatin发酵效价的影响较小。可能原因为Lipstatin发酵培养基为特殊的高油培养基,高浓度豆油与乳化剂卵磷脂作用使得培养基呈现较高的黏稠度,即使增大通气量,也不利于氧在培养基介质中的扩散。

图4 不同通气量对Lipstatin发酵的影响Fig.4 The effect of ventilatory capacity on Lipstatin producitivity
2.3.3 补料工艺对Lipstatin 10 L发酵罐分批发酵的影响
搅拌工艺的优化能显著提高24~96h间发酵罐的溶氧水平,但96 h后溶氧水平急剧下降,实验中观察发现发酵液逐渐变黏稠,即使提高转速也不能有效增加溶氧(图3-a)。这可能是由于Lipstatin发酵培养基为高油培养基,质地黏稠,发酵过程中菌丝的生长和产物的合成进一步增强发酵液的粘稠度,同时Lipstatin发酵过程中通气量大,搅拌速度快,水分易蒸发,使发酵液黏稠度进一步增高等原因导致的。采取补料工艺是改善溶氧、提高Lipstatin发酵水平的有效方法。降低基础配料中豆油的含量(从5%到3%),分别在发酵 72、96、120h 时补加 1.5%豆油,补料量是发酵液体积的0.5%。

图5 补料工艺对Lipstatin发酵的影响Fig.5 The effect of fed bacth fermentation on Lipstatin productivity
由图5-a可见,分批发酵72 h后pH持续上升,192 h pH达到8.0,这可能是因为发酵时菌体利用速效氮源产生游离NH4+引起的。分批发酵96 h后溶氧水平急剧降低,Lipstatin效价增长速度在144 h后趋缓。图5-b显示补料发酵72 h后pH缓慢下降,192 h pH为6.3,这可能是因为补料后油脂分解产生脂肪酸会中和OH-,所以发酵中后期pH较为稳定,补料发酵96h后溶氧水平保持在30%以上,溶氧水平较分批发酵显著提高,补料发酵恒定的pH环境和较高的溶氧水平大大促进了Lipstatin的合成,发酵144 h后Lipstatin效价仍以较快速度增长,168 h发酵效价达到6 446μg/mL,比分批发酵产量提高50%。
3 讨论
Lipstatin产生菌的生长及Lipstatin的生物合成对溶氧水平有较高的要求,而Lipstatin发酵培养基为特殊的高油培养基,培养基中豆油与乳化剂卵磷脂相互作用使培养基呈现较高的黏稠度,发酵过程中菌丝的生长和水分的蒸发则进一步增高发酵液的黏稠度,不利于氧在发酵液中的扩散,增大通气量不能有效提高发酵过程中的溶氧水平。
本研究根据Lipstatin发酵特点优化搅拌工艺、建立补料工艺以改善Lipstatin发酵过程中的溶氧水平。由于Lipstatin产生菌对剪切力敏感,研究建立了前期200 r/min低转速搅拌,发酵中后期提高搅拌速度,最终搅拌速度为500 r/min的工艺。发酵96 h后由于菌丝生长、水分蒸发,发酵液黏稠度高,溶氧水平急剧下降,此时提高搅拌速度不能有效改善溶氧。通过建立补料工艺,降低基础配料中豆油比例,于发酵中后期不同时间补入1.5%的豆油,既降低发酵培养基的黏稠度,发酵前期溶氧显著提高,又避免发酵中后期菌丝大量生长、耗氧过多而供养不足,使发酵溶氧水平保持在30%以上。抗生素等次级代谢产物的发酵分为菌体生长期和产物合成期2个阶段,一般在菌体生长的对数末期添加前体物质有利于次级代谢物的合成,补料工艺的建立也在Lipstatin合成阶段为其提供前体物质(豆油)。通过以上工艺的优化,Lipstatin 10 L发酵罐发酵效价达到6 446μg/mL,较摇瓶发酵效价提高约40%,发酵周期缩短1d。本研究结果为Lipstatin的工业化规模发酵奠定了基础。
[1] Weibel E K,Hadyary P,Hochuli E.Lipstatin,an inhibitor of pancreatic lipase,produced by Streptomyces toxytrcini.Ⅰ.Producing organism,fermentation,isolation and biological activity[J].J Antibiotics,1987,XL(8):1 081-1 085.
[2] Field BCT,Chaudhri O B,Bloom S R.Obesity treatment:novel peripheral targets[J].Br J Clin Pharmacol,2009,68(6):830-843.
[3] James W P,Caterson I D,Coutinho W,et a1.Effect of sibutramine on cardiovascular outcomes in overweight and obese subjects[J].N Engl J Med,2010,363(10):905-917.
[4] LI Ming-fang,Cheung B M.Rise and fall of anti-obesity drugs[J].World J Diabetes,2011,2(2):19-23.
[5] David J H,Jane G,Sharon L S.Regulatory challenges for new drugs to treat obesity and comorbid metabolic disorders[J].Br J Clin Pharmacol,2009,68(6):861-874.
[6] 袁建,肖廷超,朱照静.减肥药物不良反应文献综合分析[J].中国药业,2011,20(12):52-53.
[7] 徐铮奎.奥利司他的机遇和挑战[J].医学经济报,2012,6(5):1-2.
[8] 王永青.Lipstatin发酵工艺的优化研究[D].青岛:中国海洋大学,2013:1-72.
[9] 张雯,李成涛,李宏杰,等.Lipstatin生产菌株发酵动力学研究[J].食品工业科技,2009,30(12):115-117.
[10] 韩俊茹,陈锡永.Lipstatin高产菌株筛选[J].中国抗生素杂志 2007,32(8):459-461.
[11] 胡为民,庄英萍,王永红,等.毒三素链霉菌生产利普司他汀的发酵与提取工艺[J].中国医药工业杂志,2007,38(10):705-708.
[12] 颜震,李海军,朱希强,等.lipstatin发酵工艺的优化[J].食品与药品2007,9(12):5-7.
[13] 孙菲,郑榕.毒三素链霉菌FIM-1015产生Lipstatin发酵工艺的研究[C].成都:第十二届全国抗生素学术会议论文集,2013:183-186.
[14] 赵成建,张定丰,金志华.利福霉素B发酵放大Ⅰ从摇瓶到15L发酵罐的发酵放大[J].中国抗生素杂志,2002,27(7):398-340.
[15] 国家食品药品监督管理总局数据查询http://app2.sfda.gov.cn/.
[16] 沈萍.微生物学实验[M].北京:高等教育出版社,2004:40-42.
