离子色谱法检测香蕉中乙烯利的残留降解动态*
2014-12-16尚政张宇王明月王萌章程辉
尚政,张宇,王明月,王萌,章程辉
1(海南大学食品学院,海南海口,570228)2(海南大学环境与植物保护学院,海南 海口,570228)
3(中国热带农业科学院农产品加工研究所农业部食品质量监督检验测试中心(湛江),广东湛江,524001)
乙烯利(ethephon)又称乙烯磷,学名2-氯乙烯磷酸,为有机化合物,纯品为白色针状结晶,工业品为淡棕色液体,易溶于水、甲醇、丙酮、乙二醇、丙二醇,微溶于甲苯,不溶于石油醚,是一种低毒性的植物生长调节剂,具有促进果实成熟,刺激伤流,调节性别转化等。在农业生产实际中,对于外运的水果,为便于运输,在成熟前收获,采用少量、低浓度乙烯利催熟是常用的方法。适量的乙烯利处理也有积极意义,会使得接近成熟的水果加快成熟,一般不会对人体造成危害[1-3]。
香蕉是我国重要的消费水果。香蕉由于其产地及运输销售原因,需要在上市前进行催熟,乙烯利在香蕉催熟产业上应用相当广泛且技术成熟,但是其残留情况在我国未见相关研究报告,并且目前我国对于该农药在香蕉上的残留限量也没有具体标准[4-6]。为了进一步摸清乙烯利在香蕉中的残留动态情况,确定该农药在香蕉上的使用剂量、安全采收间隔期等,笔者于2012年11月至2013年4月在湛江对乙烯利在香蕉上进行了消解动态和最终残留量试验,以期为科学评价乙烯利在香蕉上应用的残留风险及制定最大残留限量标准提供依据。
1 材料与方法
1.1 试验时间与地点
催熟保藏实验在中国热带农业科学院农产品加工研究所进行。
残留检测是在广东省湛江市农业部食品质量监督检验测试中心(湛江区)进行。
时间为2012年11月至2013年4月。
1.2 实验材料
40%乙烯利水剂,上海华谊集团华原化工有限公司。
1.3 实验方法
1.3.1 实验设计
1.3.1.1 消解动态试验
在香蕉收获期间,从批发市场购买七成熟的香蕉,除去烂果、病果及表皮受损的果实,然后选择大小均一的果实分成小束,依据农业行业标准NY/T 788-2004,用高剂量1 500 mg/kg(267倍40%乙烯利水剂)浓度的药液浸果30 s,取出后自然晾干,然后再用大塑料袋包装,分自然和冷藏2种条件(常温22℃和低温16℃,相对湿度80%~90%)进行贮藏。采样间隔期分别为施药后1(即原始沉积量)、6、12 h、1、2、3、5、7、10、14、21、28、35 d 等(视腐烂程度确定最后一次取样时间)。测定部位为全蕉样品。
1.3.1.2 最终残留试验
在香蕉收获期间,从批发市场购买7成熟、8成熟、9成熟香蕉果实,除去烂果、病果及表皮受损的果实,然后选择大小均一的果实分成小束,依据农业行业标准 NY/T 788-2004,分别用低剂量(400倍1 000 mg/kg)和高剂量(267倍1 500 mg/kg)浸果,30 s,取出后自然晾干,然后再用大塑料袋包装,分自然和冷藏2种条件(常温22℃和低温16℃,相对湿度80%~90%)进行贮藏。采样间隔期分别为香蕉刚成熟和最佳食用期,测定部位为全蕉样品和果肉。
1.3.1.3 采样方法
残留动态样品:采集香蕉样本,每个重复采集1 kg香蕉,不少于6条,切碎。用四分法缩分,分取200 g样品2份,分别装入封口样品容器中,贴好标签,放入-20℃低温冰柜中贮存。每次取样后分别取均匀的3~4条香蕉,称取果皮和果肉的重量,并记录。同时取对照样品。
最终残留量采样:采集香蕉样本,每个重复采集1 kg香蕉,不少于6条,一半计数并称量后,切碎,用四分法缩分,分取200 g样品2份,另一半计数并称量后,分别收集果皮。收集果肉,称其质量后切碎,用四分法缩分,分取200 g样品2份,分别装入封口样品容器中,贴好标签,放入-20℃低温冰柜中贮存。同时取对照样品。
1.3.2 检测方法
1.3.2.1 试验仪器
离子色谱仪:瑞士万通882离子色谱仪(配备858自动进样器);高速冷冻离心机,组织捣碎机、氮吹仪、快速混匀器;色谱柱:Metrosep A Supp 4(250 mm ×4.0 mm)。
1.3.2.2 实验试剂
乙烯利标准品(Sigma-Aldrich);甲酸;丙酮;三氟乙酸;甲醇;石墨化碳黑柱(250 mg/6 mL)和离子交换柱固相萃取柱(100 mg/6 mL);超纯水(电阻率18.2 MΩ·cm)。
1.3.2.3 乙烯利的残留检测
样品提取净化:称取5.0 g左右的香蕉样品,置于离心管中,加入20 mL 1%甲酸-丙酮溶液,涡旋震荡1 min,以4℃ 10 000 r/min离心20 min,将上清液转移至50 mL塑料容量瓶中,合并上清液并定容至50 mL。分取10 mL提取液在40℃水浴中氮吹,除去大量丙酮后,加入5 mL水,待净化。石墨化碳柱先用3 mL甲醇,3 mL水活化;将待净化溶液上样,接收流出液;用2 mL甲醇冲洗石墨化碳柱,同时接收洗脱液,与流出液合并,待进一步净化。离子交换柱先用5 mL甲醇,5 mL水活化;将上一步待净化溶液上样,用5 mL水、5 mL甲醇淋洗,再用10 mL 1%TFA-丙酮溶液洗脱,收集,缓慢氮吹至近干,用超纯水定容至10 mL,待测。
离子色谱测定:色谱柱为 Metrosep A Supp 4(250 mm×4.0 mm);检测器为离子色谱仪自带的电脑检测器;流动相为1.8 mmol Na2CO3+1.7 mmol NaHCO3流速为1 mL/min;进样量为20 μL。保留时间为 13.20 min[7-16]。
2 结果与分析
2.1 检测方法的验证
2.1.1 标准曲线
采用外标法峰面积定量。用超纯水配制500 mg/L乙烯利标准贮备液,用超纯水逐级稀释成1、5、10、20、50 mg/L 标准溶液,进样量20 μL,在1.3.2 条件下,注射标准工作系列溶液,绘制乙烯利标准曲线,得回归方程为Y=-0.036 546 6+1.258 44E-3X,r2=0.999 1,证明在试验条件范围内仪器响应信号与乙烯利的浓度成良好的线性关系;标准品谱图见图1。
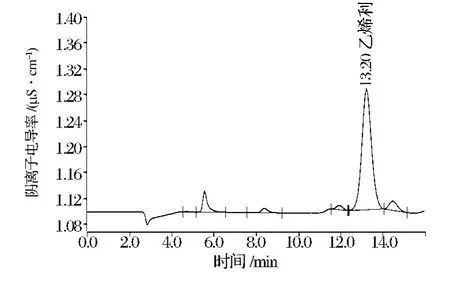
图1 乙烯利标准工作液谱图Fig.1 HPLC chromatogram of ethephon standard solution
2.1.2 方法最低检出限(LOD)和方法定量限(LOQ)、最小检出量
本方法对乙烯利的最低检出限0.03 kg/kg,方法定量限为0.1 mg/kg,最小检出量为0.2ng/kg。
2.1.3 添加回收率与相对标准偏差
取空白对照区的香蕉样品做添加回收率试验,添加浓度分别为0.02、0.2、2 mg/kg,每个浓度做5个平行试验,试验结果见表1,从试验结果可知,该方法的准确度和精密度符合残留试验准则要求。
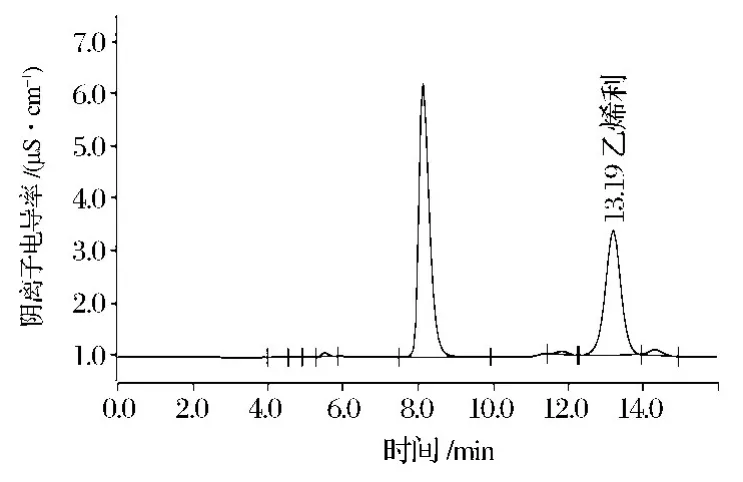
图2 香蕉全蕉样品工作液谱图Fig.2 chromatogram of banana whole fruit
2.1.5 残留量计算公式
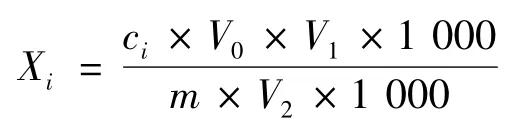
式中:Xi,样品中的乙烯利残留量,mg/kg;ci,样品上机溶液浓度,mg/L;V0,提取溶剂体积,mL;V1,样品定容的体积,mL;V2,分取体积,mL;m,样品质量,g(以鲜重计)。

表1 40%乙烯利水剂在香蕉中的添加回收率Table 1 Recoveries of 40%ethephon in banana
2.2 乙烯利在香蕉中的消解动态
(1)储藏温度为22℃条件下,施药后1 h乙烯利在香蕉上原始沉积量为172.47 mg/kg,残留量按C=147.91e-0.4888x降解;半衰期为1.4 d。结果详见表2和图3。
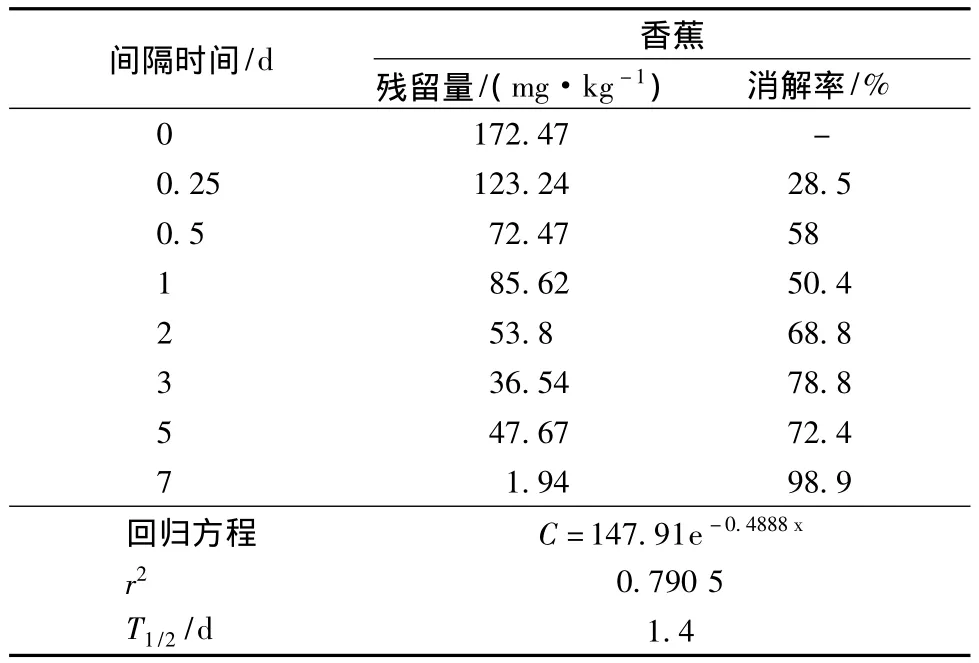
表2 40%乙烯利水剂在香蕉中的消解动态(22℃)Table 2 degradation dynamics of 40%ethephon water-based in banana(22℃)

图3 40%乙烯利水剂在香蕉上消解曲线(22℃)Fig.3 degradation curve of 40%ethephon water-based in banana(22℃)
贮藏温度为16℃条件下,施药后1 h乙烯利在香蕉上原始沉积量为216.15 mg/kg,残留量按C=193.74e-0.2159x降解;半衰期为3.2 d。结果详见表3和图4。

表3 40%乙烯利水剂在香蕉中的消解动态(16℃)Table 3 degradation dynamics of 40%ethephon water-based in banana(16℃)
(2)试验结果表明:乙烯利在香蕉上施药后,在两个不同温度下的残留消解都完全符合一级反应动力学方程式,半衰期为1.4 d和3.2 d。施药后,乙烯利的残留消解速率很快,22℃条件下第7 d消解近99%,16℃条件下第14 d消解95.3%
(3)果肉的硬度是香蕉品质判定的重要指标[17-18]。对2种温度下贮藏的香蕉进行感官测定,22℃条件下香蕉果肉硬度从最初的9.63kg/cm2下降至2.26kg/cm2;16℃条件下香蕉果肉硬度从最初的9.26kg/cm2下降至1.95kg/cm2。表明果实已经成熟软化,并且香蕉果皮无腐烂黑斑,色泽好,完全可食用。
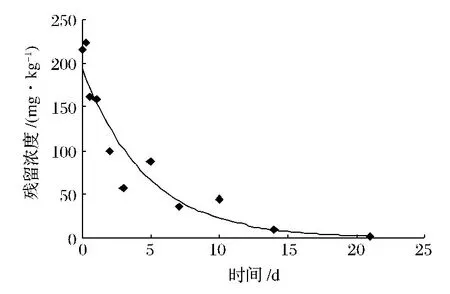
图4 40%乙烯利水剂在香蕉上消解曲线(16℃)Fig.4 degradation curve of 40%ethephon water-based in banana(16℃)
(4)不同贮藏温度条件下,乙烯利在香蕉中的消解半衰期存在一定差异。温度越高,乙烯利的降解速度越快;乙烯利容易分解,随着贮藏时间在香蕉中的残留量会下降。由于采用浸果方式施药,故全蕉乙烯利的残留量比蕉肉中高。
2.3 乙烯利在香蕉中的最终残留量
(1)香蕉中最终残留实验结果表明:40%乙烯利水剂以施药剂量1 000、1 500 mg/kg,分别施药1次,储藏温度为22℃条件下,七成熟香蕉全蕉中乙烯利的最高残留量82.217 mg/kg,最低残留量为15.768 mg/kg,蕉肉中乙烯利的最高残留量42.6 mg/kg,最低残留量为0 mg/kg;八成熟香蕉全蕉中乙烯利的最高残留量61.983 mg/kg,最低残留量为23.036 mg/kg,蕉肉中乙烯利的最高残留量51.425 mg/kg,最低残留量为1.363 mg/kg;九成成熟香蕉全蕉中乙烯利的最高残留量82.0 mg/kg,最低残留量为27.333 mg/kg,蕉肉中乙烯利的最高残留量61.833 mg/kg,最低残留量为0.258 mg/kg;储藏温度为16℃条件下,七成熟香蕉全蕉中乙烯利的最高残留量108.223 mg/kg,最低残留量为14.796 mg/kg,蕉肉中乙烯利的最高残留量53.945 mg/kg,最低残留量为0 mg/kg;八成熟香蕉全蕉中乙烯利的最高残留量127.137 mg/kg,最低残留量为33.46 mg/kg,蕉肉中乙烯利的最高残留量49.961 mg/kg,最低残留量1.86 mg/kg;九成成熟香蕉刚全蕉中乙烯利的最高残留量92.319 mg/kg,最低残留量为20.251 mg/kg,蕉肉中乙烯利的最高残留量61.079 mg/kg,最低残留量为1.449 mg/kg;由此得出,在2种催熟温度下,1 000 mg/kg的喷药浓度时,七、八、九成熟的香蕉用来催熟都是安全的,1500 mg/kg的喷药浓度时,七成熟的香蕉用来催熟是安全的;总体可看出,七成熟的香蕉用来催熟是最安全的。结果详见表4和表5。

表4 40%乙烯利水剂的最终残留测定结果(22℃)Table 4 The final residual determination results of 40%ethephon water-based(22℃)
(2)以上试验结果表明,施药剂量越大残留量越大,随着时间的推移,乙烯利残留量总体呈下降趋势。此外还可看出,乙烯利在香蕉蕉肉中的残留量比其在香蕉全蕉中的残留量低。在各种施药因子中,施用的原始浓度对其在不同时间的残留浓度有较大关系,但并不是全部正相关关系,这可能还受到浸泡效果,香蕉个体差异等因素的影响。
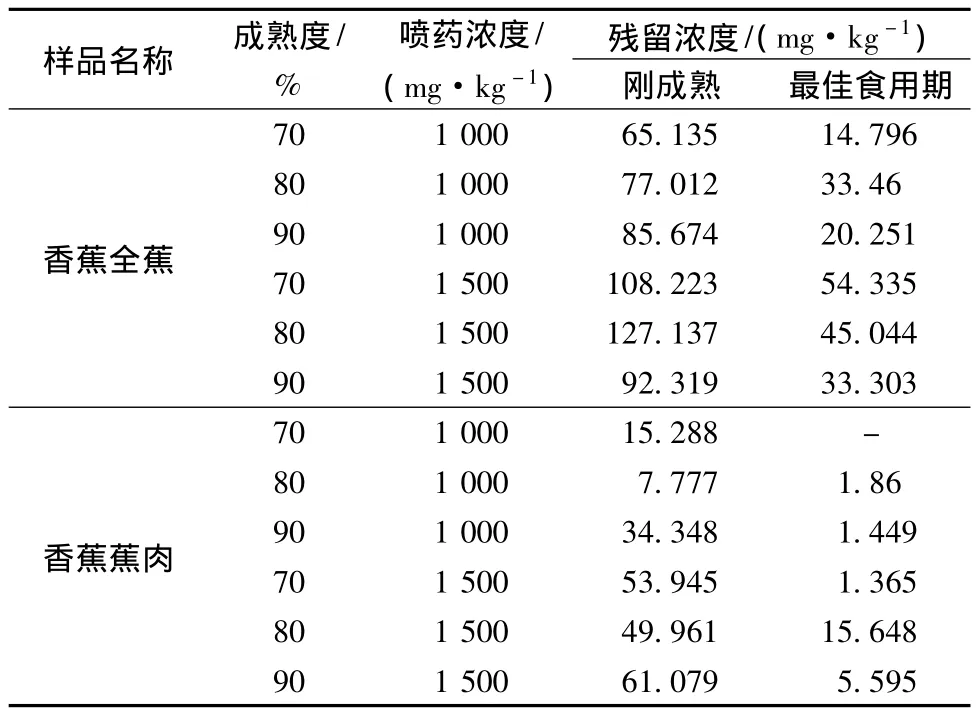
表5 40%乙烯利水剂的最终残留测定结果(储藏温度为16℃)Table 5 The final residual determination results of 40%ethephon water-based(16℃)
3 结论
目前我国对于乙烯利在香蕉中的最高残留限量还未有明确规定量,只是宽泛的规定在热带水果中的限量不得超过2 mg/kg,日本具体规定了乙烯利在香蕉中的最大残留量为2 mg/kg,,而根据上述的实验结果来看,2种浓度的施药剂量在香蕉果肉上的残留基本上都低于2 mg/kg,参考人体每日允许摄入的乙烯利的量(ADI)为0.05 mg/kg体重,以及中国居民每天摄入香蕉的量,建议将MRL值定在2 mg/kg,并且根据实验结果,建议乙烯利在香蕉催熟的合理使用方法为1 000 mg/kg的乙烯利水剂进行浸泡催熟,22℃时施药与食用间隔期为7 d。16℃时施药与食用间隔期为18~21 d。从各个国家对于乙烯利在香蕉中的最大残留限量标准来看,此药按照建议的使用方法来处理香蕉是安全的。
[1] 刘乾开,朱国念.新编农药使用手册[M].上海:上海科技出版社,1999:591.
[2] 叶钟音.现代农药应用技术全书[M].北京:中国农业出版社,2002:462.
[3] 周继汤.新编农药使用手册[M].哈尔滨:黑龙江科技出版社,1998:431.
[4] 李仁茂,陈 蓉,肖志成.粤西地区四种香蕉皮的成分分析[J].湛江师范学院学报,2001,22(6):42-45.
[5] 王建立,管正学,张学予.香蕉资源的加工利用研究[J].资源科学,1995(1):57-62.
[6] 贾冬英,李 尧,姚 开,等.香蕉皮中多酚的提取工艺条件研究[J].四川大学学报,2005,37(6):53-55.
[7] 中华人民共和国农业行业标准.NY/T 788-2004.农药残留实验准则[S].
[8] 周艳明,牛森,许仁骥.水果、蔬菜中乙烯利残留量的检测方法[J].食品科学,2006,27(3):176-178.
[9] 郭潇,孙昌梅,田益玲,等.乙烯利在果蔬中残留量的快速检测方法[J].食品研究与开发,2008,(2):116-118.
[10] 颜金良,王立.离子色谱法快速测定瓜果中乙烯利含量研究[J].中国卫生检验杂志,2008,(8):1 544-1 545.
[11] 李丽华,郑玲.固相微萃取-气相色谱联用技术测定芒果原浆中乙烯利的残留量[J].分析实验室,2007(26):287-289.
[12] 储晓刚,雍炜,蔡慧霞,等.用顶空气相色谱法快速测定浓缩菠萝汁中乙烯利的残留量[J].色谱,2001,19(3):286-288.
[13] 中华人民共和国农业部.NY/T1016-2006.水果蔬菜中乙烯利残留量的测定-气相色谱法[S].
[14] 曾素香,张碧秋.利用气相色谱仪及气体采样快速检测农产品中益收生长素残留量[J].药物食品分析(台湾),2000(3):213-217.
[15] Shigeyuki T.New method for ethephon((2-chlorethyl)phosphonic acid)residue analysis and detection of residual in the fruit and vegetables of western Japan[J].J Agric Food Chem,2002,50:7 515-7 519.
[16] Marin J M,Pozo O J,Beltran J,et al.An ion-pairing liquid chromatography/tandem mass spectrometric method for the determination of ethephon residues in vegetables[J].Rapid Commun Mass Spectrom,2006,20(3):419-426.
[17] 张昭其,庞学群.南方水果贮藏保鲜技术[M].南宁:广西科学技术出版社,1998:24-32.
[18] 陈维信,苏美霞,王振永,等.香蕉催熟生理和技术研究[J].华南农业大学学报,1993,14(2):102-106.
