灵芝子实体多糖提取方法优化及不同来源赤芝子实体的多糖分子质量比较*
2014-12-16孙小梅戴军陈尚卫朱松
孙小梅,戴军,陈尚卫,朱松
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
灵芝在我国作为传统的药食两用真菌已有2 000多年历史,是中华医药学宝库中的珍品。国内外诸多研究表明,灵芝的药理活性归因于其含有的多糖、三萜类、腺苷类、生物碱、甾醇和氨基酸等,它们在灵芝的药用保健功能中发挥着很重要的作用[1]。许多文献报道灵芝多糖具有调节免疫[2-5]、抗肿瘤[6-7]、抗氧化[8-9]、抗肝炎[10]以及抗糖尿病[11]等生物活性,被认为是灵芝中活性最大、效用最高的成分。
我国分布有大量的不同种类灵芝,而同一个灵芝品种在不同的环境中生长,其子实体的营养成分含量,组成及结构等也会有较大的差异[12-15]。而不同来源的灵芝的多糖分子质量分布、糖组成及结构不同,其生物活性也不相同。据报道,灵芝多糖分子质量大于1×104时,显示强抑制肿瘤活性[10]。而不同提取方法提取得到的灵芝多糖,其分子质量分布和结构不尽相同,活性也有差异。活性强弱与其相对分子质量、溶解度、多糖链的分支程度及支链上羟基取代的数量、糖苷键的类型、以及多糖的立体构型等有关[16]。现今,市场上各类灵芝类保健品越来越多,人们对其保健功效质量优劣的要求也越来越高,对灵芝以及灵芝产品的质量检测与控制也尤为重要。为了建立快速有效且可靠的分析检测方法,以及避免在实际生产应用中灵芝多糖的生物活性受到影响,选择合适的多糖提取方法也十分重要。本研究拟采用4种提取方法提取灵芝子实体多糖,通过比较多糖得率以及所得多糖的分子质量分布来选择最优提取方法。
1 材料与方法
1.1 材料与设备
1.1.1 样品与试剂
乙醇(分析纯);超纯水;浓H2SO4(分析纯);苯酚;NaNO3(分析纯);葡萄糖对照品;Dextran系列葡聚糖标准品;11个赤芝子实体样品,分别收集自山东、福建、浙江、辽宁等地区。
1.1.2 仪器与设备
Waters 600高效液相色谱仪,配置Waters 600四元泵,2410示差折光检测器,7725i进样阀,Empower 2色谱工作站;721N型可见光分光光度计,上海精密科学仪器有限公司;KQ-250DB型数控超声波清洗器,昆山市超声仪器有限公司;CEM-MARS5型微波消解系统,美国CEM公司;ASE100加速溶剂萃取仪,美国DIONEX中国有限公司;5415D小型高速离心机;QT-1漩涡混合器,上海琪特分析仪器有限公司;RE52-2旋转蒸发仪,上海沪西分析仪器厂;SHZ-3循环水多用真空泵,上海沪西分析仪器厂;HH-S数显恒温水浴锅,江苏省金坛市医疗仪器厂;Avanti J-E多用高效冷冻离心机,美国贝克曼库尔特公司。
1.2 实验方法
1.2.1 灵芝多糖的提取
将收集的不同的灵芝子实体样品置真空干燥箱中35℃烘干,切片粉碎。准确称取灵芝子实体样品约5.00 g,加纯水浸泡过夜,再分别在超声波、微波、加速加压或者回流等辅助条件下提取,经浓缩、醇沉、离心、洗涤、离心、干燥等,得粗多糖水溶液。
1.2.2 多糖含量的测定
采用苯酚-硫酸法,以葡萄糖为标准品绘制标准曲线。
多糖得率/%=[提取液中多糖含量(g)/灵芝粉样品质量(g)]×100
1.2.3 高效体积排阻色谱法分析多糖分子量分布
(1)色谱条件。色谱柱:Waters UltrahydrogelTM Linear 2根串联(7.8 mm×300 mm);检测器:示差折光检测器(RID);流动相:0.1 mol/L NaNO3;流速:0.6 mL/min;柱温:45℃。
(2)分子质量标准曲线。将不同分子质量的葡聚糖标准品配置成约3 mg/mL的溶液,进样分析。根据每个标样的保留时间和对应分子质量的对数值,由GPC软件自动作出分子量标准曲线。
(3)样品分子质量分布分析。对上述1.2.1中提取得到的多糖溶液,分别进样分析。根据上述得到的分子量标准曲线,由GPC软件自动计算出每个样品的色谱图中各个峰的相对分子质量。
2 结果分析
2.1 不同提取方法多糖提取率比较
2.1.1 超声波辅助提取
单因素实验优化超声波辅助提取时间、温度以及料液比等对灵芝多糖提取的影响,结果见图1。超声功率额定为250 W,图1-a显示随着提取温度升高,多糖得率不断增大。图1-b表明超声时间越长,多糖得率越高,60 min时得率最大,之后有下降趋势,可能是由于长时间超声作用使多糖降解,得率反而下降。图1-c显示料液比对多糖得率的影响相对不大,随着提取溶剂比例增加,得率也变大,但变化幅度较小。
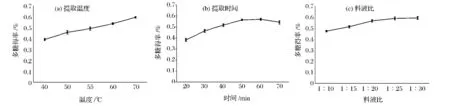
图1 超声辅助提取灵芝子实体多糖单因素实验Fig.1 Single factor experiments of ultrasonic-assisted extraction method
在以上单因素实验的基础上进行正交试验优化最佳提取条件,正交试验结果见表1。
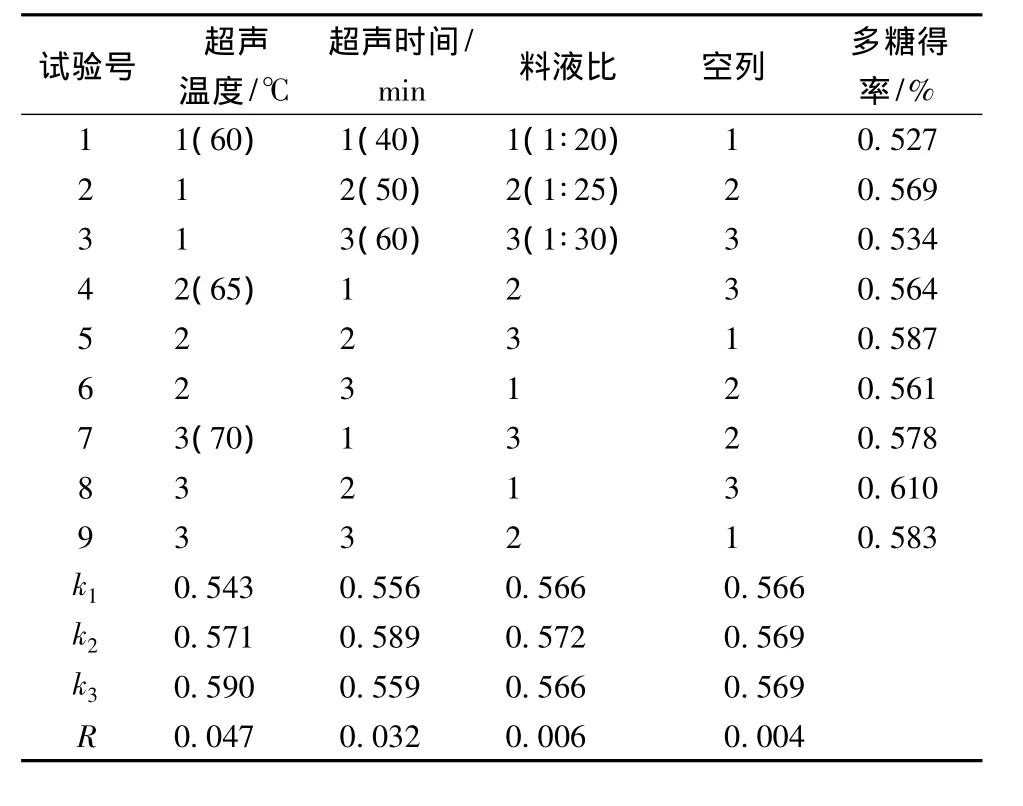
表1 超声辅助提取正交试验结果Table 1 Results of ultrasonic-assisted extraction orthogonal tests
比较超声时间、温度以及料液比3个因素的极差R:R(超声温度)>R(超声时间)>R(料液比),可见超声温度是关键的影响因素。超声波辅助提取的最优条件为:料液比 1∶20,70 ℃,50 min,提取率为0.610%。在选择的最佳条件下,进行3次重复的验证实验,所得的多糖得率分别为0.634%、0.621%、0.617%,说明选择的超声辅助提取条件基本稳定。
2.1.2 微波辅助提取
单因素实验结果见图2。微波温度对多糖得率的影响明显,温度升高,多糖得率也增大;随着微波时间增加,多糖不断被提取出来,但得率增长幅度不大,可能是因为大分子质量的多糖不能被提取出来,也可能是因为微波能破坏多糖结构,使多糖得率较小。同样,提取溶剂比例增大,多糖得率也逐渐变大。
在单因素实验的基础上进行正交试验,结果见表2。表2极差分析结果显示:R(提取温度)>R(料液比)>R(提取时间),发现温度的影响最为显著。由正交试验结果选择最优的提取条件为:料液比1∶25,提取温度110℃,提取时间20 min,得率为0.515%。同时在此条件下,进行3次重复的验证实验,多糖得率分别为0.534%、0.512%、0.522%,表明所选择的微波辅助提取条件基本稳定。
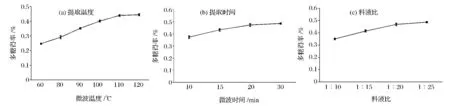
图2 微波辅助提取灵芝子实体多糖单因素实验Fig.2 Single factor experiments of microwave-assisted extraction method
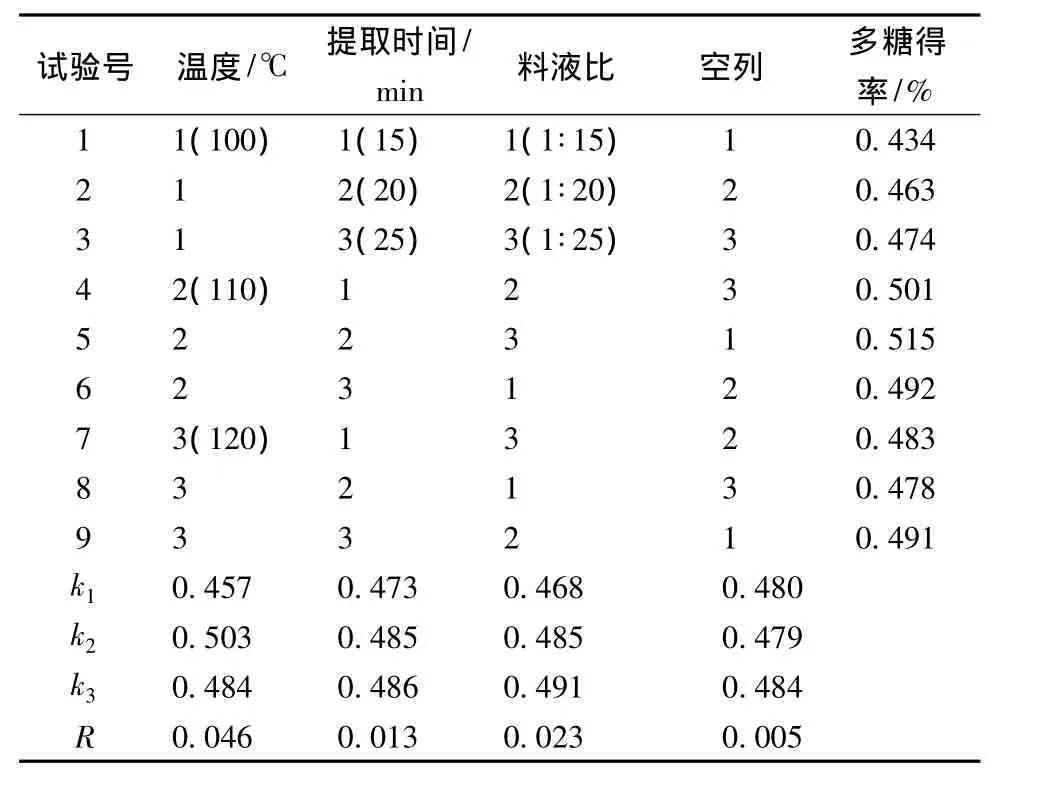
表2 微波辅助提取正交试验结果Table 2 Results of microwave-assisted extraction orthogonal tests
2.1.3 加速溶剂萃取
分别考察萃取时间和温度对子实体多糖的得率的影响,结果见图3。随着萃取温度升高,多糖得率不断升高,在考察的水平范围内,多糖得率没有出现下降的趋势,但不能肯定温度继续升高是否对多糖提取有负影响。故选择提取温度为130℃。静态提取时间也对多糖的提取有影响,在5~15 min多糖得率持续升高,但提取时间增加到20 min时,有稍许下降,可能是由于多糖被破坏降解,也可能是存在实验误差。故选择静态提取时间为15 min。
由于仪器条件限制,且此萃取方法所需溶剂(纯水)用量少,不好控制,故未能对其进行优化。故选用较优的提取条件为萃取温度130℃,静置15 min,提取2次,提取率为0.654%。
2.1.4 水浴回流提取
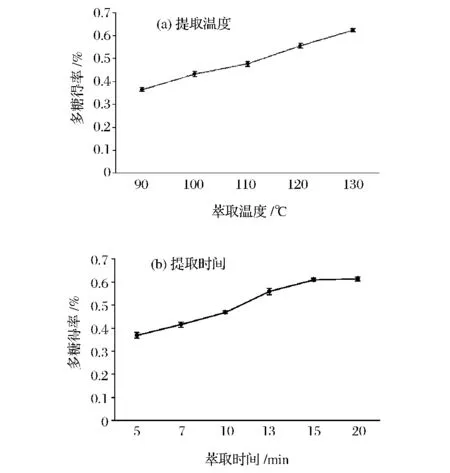
图3 加速溶剂萃取灵芝子实体多糖单因素实验Fig.3 Single factor experiments of accelerated solvent extraction
单因素实验结果如图4所示,图4-a显示水浴温度与多糖得率呈现正相关关系,温度达到90℃时,多糖得率增大明显,而继续升到100℃时,得率仍有增加。图4-b表明提取时间延长,多糖得率也不断增加。由图4-c可知料液比对多糖得率的影响较小,随着提取溶剂比例增加,多糖溶出有增加但是增加的幅度较小。
在上述单因素实验基础上进行正交试验优化最佳条件,结果见表3。分析结果显示:R(水浴温度)>R(水浴时间)>R(料液比),表明温度是较关键的影响因素。故选择正交试验中最优的提取条件为:料液比1∶20,100℃,6 h,多糖提取率为 0.671%。并在此条件下,进行3次重复实验进行验证,结果显示多糖得率分别为0.664%、0.678%、0.683%,说明选择的 水浴回流提取提取条件基本稳定。
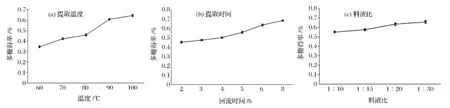
图4 水浴回流提取灵芝子实体多糖单因素实验Fig.4 Single factor experiments of heating reflux extraction method
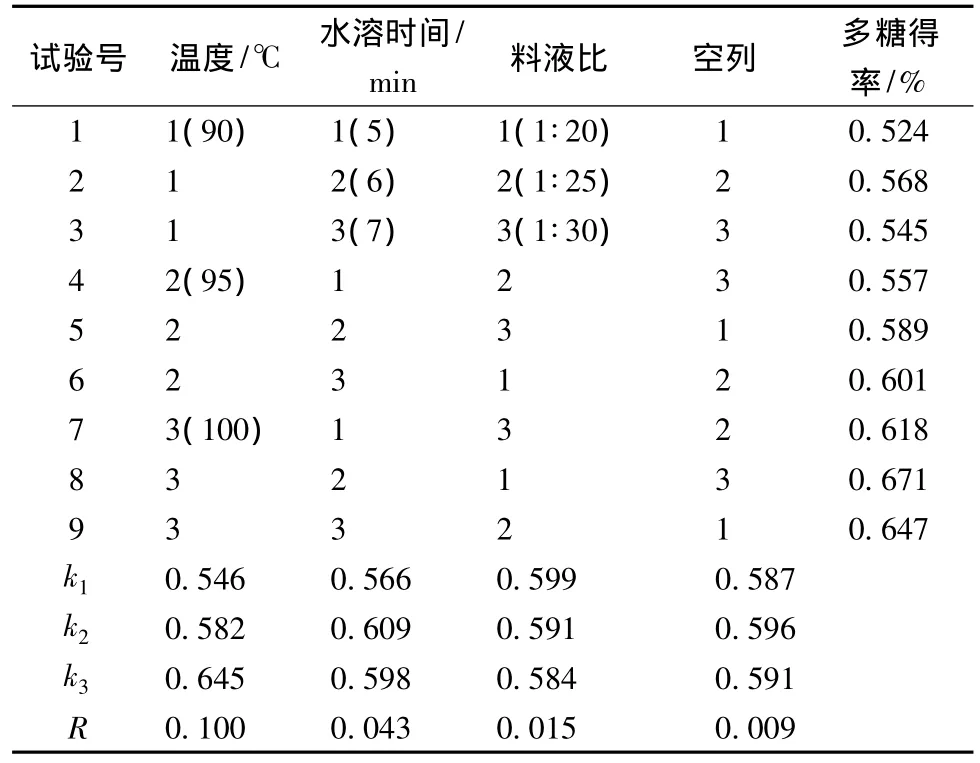
表3 水浴回流提取正交试验结果Table 3 The results of heating reflux extraction orthogonal test
以上结果表明,多糖得率大小:水浴回流提取>加速溶剂萃取>超声波辅助提取>微波辅助提取。由此可见,水浴回流提取和加速溶剂萃取的多糖得率较高,前者温度高,能耗高,时间长,后者在高温高压条件下快速萃取多糖,效率高,条件温和。而超声波和微波的能量高,能破坏细胞壁使多糖溶出,但同时也可能会使得溶出的多糖被降解,在醇沉时被弃去,从而使得测定的多糖得率低。但比较而言,超声波辅助提取的多糖得率相对较高,方法也更简便实际。
2.2 不同提取方法多糖分子量分布比较
用高效体积排阻色谱法对4种方法最佳提取条件下提取得到的灵芝子实体多糖进行分子质量分布分析,其分子质量分布的情况如图5所示。
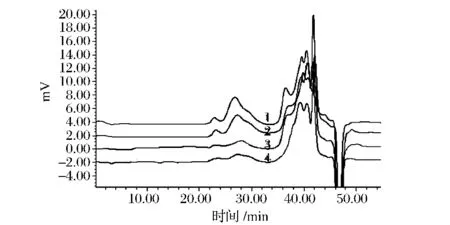
图5 四种不同的提取方法得到多糖的分子质量分布Fig.5 Molecular weight distribution of G.lucidum fruiting bodies polysaccharides extracted with four different extraction methods
表4显示水浴回流提取、加速溶剂萃取以及超声波辅助提取所得的多糖分子量大于10 kDa级分含量相差不大,分别是50.50%、51.92%及49.17%(图5中1、2、3号图谱),表明3种提取方法对多糖结构的破坏均不大。而微波辅助法提取的多糖分子量大于10 kDa的级分含量相对较低(图5中4号图谱),可能是因为微波对多糖结构的破坏作用相对较大。加速溶剂萃取法的提取成本较高且普及率较低,超声波辅助法与加速溶剂萃取法的提取效果差异较小,且具有更好的实际应用性,故选用超声波辅助法提取灵芝子实体多糖。
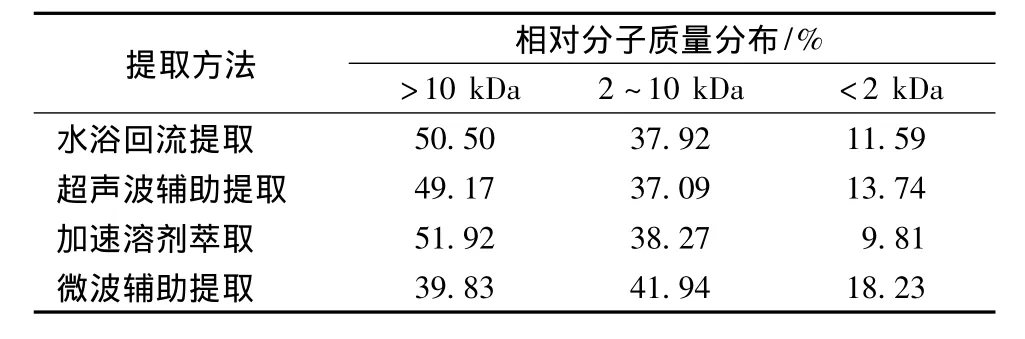
表4 不同提取方法提取的多糖分子质量分布Table 4 Molecular weight distribution of polysaccharides under different extraction conditions
2.3 不同来源的赤芝子实体多糖的分子量分布比较
表5显示了超声波辅助提取的11个赤芝子实体多糖分子量分布情况。从表5可见,其中3个子实体样品多糖分子质量在100~1 000 kDa范围的级分的相对含量较高,而其他子实体多糖分子质量100~1 000 kDa的级分的相对含量却很少甚至没有。比较不同样品的菌株,产地等,发现菌株、栽培方式及产地等对灵芝多糖的分子质量分布都有影响。4号、5号和10号样品分别是收集自不同地区的段木栽培的同种菌株的赤芝子实体(如图6-a)。这3个样品菌株来源相同,相同提取方法下得到的多糖的分子质量分布相似。1号和2号子实体是相同地区不同批次的代料栽培的赤芝子实体,两者分子质量差异也很小,以分子质量小于10 kDa的级分为主(如图6-b);3、6、8、9和11号子实体是不同产地的相同菌株的段木栽培的赤芝子实体,以分子质量在2~10 kDa以及10~100 kDa 2个级分为主,7号样品的菌株与以上5种子实体不同,但多糖也以分子质量在2~10 kDa和10~100 kDa 2个级分为主。由此可见,影响灵芝多糖分子质量分布的因素较多,关系也较复杂,仍有待进一步研究。
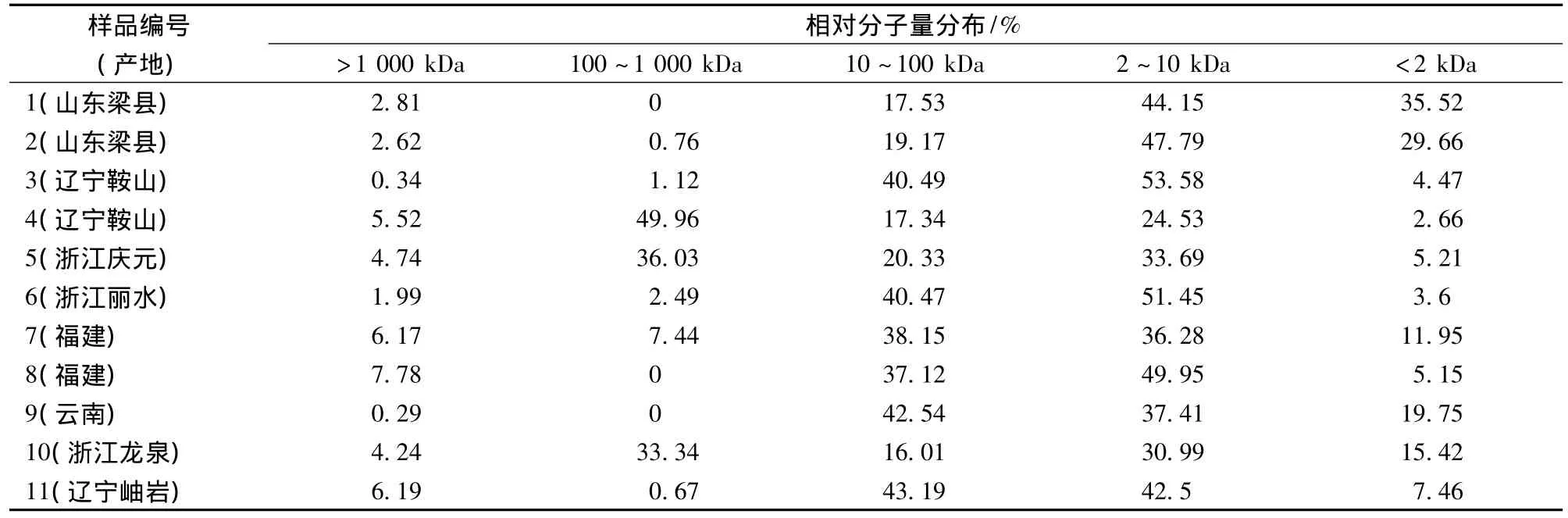
表5 超声波辅助提取不同的赤芝子实体多糖分子量分布Table 5 Molecular weight distributions of different G.lucidum fruiting bodies polysaccharides under ultrasonic-assisted condition
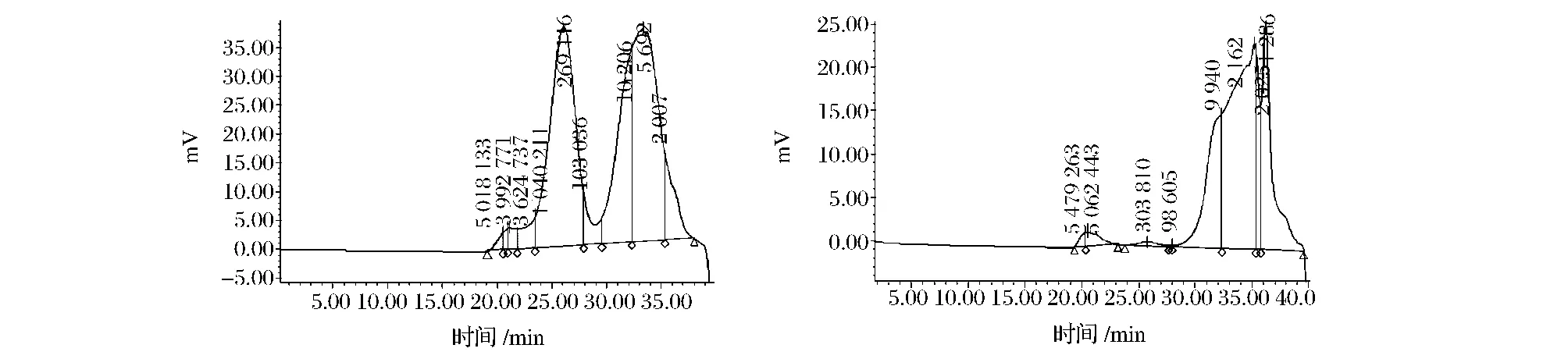
图65 号(a)和2号(b)赤芝子实体多糖的分子量分布Fig.6 Molecular weight distribution of polysaccharides of sample 5(a)and sample 2(b)
3 结论
比较了4种不同的赤芝子实体多糖提取方法,综合考虑多糖得率以及提取所得多糖的分子质量分布情况,同时结合实际生产应用的情况,选择超声波辅助提取法,并确定最佳条件为超声功率250 W,70℃,超声50 min,料液比1∶20。此外,比较了超声辅助法提取的不同来源的赤芝子实体的多糖分子质量分布情况,发现不同菌株、不同栽培方式以及不同产地等都会对多糖分子量产生一定的影响。灵芝多糖的分子量分布作为可以简单直接评价灵芝质量的重要指标之一,仍需要进一步深入地研究。
[1] 陈国良,陈晓清.灵芝有效成分研究综述[J].中国食用菌,1995,4(4):7-9.
[2] BAO X F,WANG X S,DONG Q,et al.Structural fea-tures of immunologically active polysaccharides from Ganoderma lucidum[J].Phytochemistry,2002,59:175-181.
[3] CHEN W Y,YANG W B,WONG C H,et al.Effect of Reishi polysaccharides on human stem/progenitor cells[J].Bioorganic& Medicinal Chemistry,2010,18(24):8 583-8 591.
[4] HUANG S Q,NING Z X.Extraction of polysaccharide from Ganoderma lucidum and its immune enhancement activity[J].International Journal of Biological Macromolecules,2010,47(3):336-341.
[5] LAI C Y,HUNG J T,LIN H H,et al.Immunomodulatory and adjuvant activities of a polysaccharide extract of Ganoderma lucidum in vivo and in vitro [J].Vaccine,2010,28:4 945-4 954.
[6] ZHANG M,CUI S W,CHEUNG P C K,et al.Antitumor polysaccharides from mushrooms:A review on their isolation process,structural characteristics and antitumor activity[J].Trends in Food Science & Technology,2007,18(1):4-19.
[7] 王冠英,张洁,王德友.松杉灵芝子实体抗肿瘤活性多糖的提取、分离与鉴定[J].中国老年学杂志,2011,3(31):838-839.
[8] LIU W,WANG H Y,PANG X B,et al.Characterization and antioxidant activity of two low-molecular-weight polysaccharides purified from the fruiting bodies of Ganoderma lucidum[J].International Journal of Biological Macromolecules,2010,46:451-457.
[9] YU R M,YANG W,SONG L Y,et al.Structural characterization and antioxidant activity of a polysaccharide from the fruiting bodies of cultured Cordyceps militaris[J].Carbohydrate Polymers,2007,70:430-436.
[10] LI Y Q,FANG L,ZHANG K C.Structure and bioactivities of a galactose rich extracellular polysaccharide from submergedly cultured Ganoderma lucidum[J].Carbohydrate Polymers,2007,68:323-328.
[11] Seto S W,Lam T Y,Tam H L,et al.Novel hypoglycemic effects of Ganoderma lucidum water-extract in obese/diabetic(+db/+db)mice[J].Phytomedicine,2009,16:426-436.
[12] 林志彬.灵芝的现代研究[M].北京:北京医科大学出版社,2001:3-19.
[13] 徐新春,徐鸿华,丁平,等.不同栽培因素对灵芝化学成分含量的影响[J].时珍国药研究,1997,8(5):465-467.
[14] 徐凌川,许昌盛.18种不同来源灵芝的多糖含量测定[J].世界科学技术:中医药现代化,2004,6(2):57-60.
[15] 邢增涛,郁琼花,张劲松,等.不同品种灵芝中三萜类化合物的比较研究[J].中药材,2004,27(8):575-576.
[16] YE L B,ZHANG J S,YE X J,et al.Structural elucidation of the polysaccharide moiety of aglycopeptide(GLPCW-II)from Ganoderma lucidum fruiting bodies[J].Carbohydrate Research,2008,343(4):746-752.
