5种天然多酚类化合物抗氧化活性的比较*
2014-12-16范金波蔡茜彤冯叙桥侯宇于晓凤姜沫
范金波,蔡茜彤,冯叙桥,侯宇,于晓凤,姜沫
(渤海大学食品科学研究院,辽宁省食品安全重点实验室,辽宁锦州,121013)
流行病学研究表明,日常饮食与营养对于一些疾病的预防和治疗发挥着重要的作用[1]。据报道摄入足量的果蔬制品可以降低心脑血管、癌症等疾病的发病率,已被证实上述功能活性主要源于果蔬中丰富多样的多酚成分[1]。果蔬中的多酚成分作为天然的抗氧化剂能够阻止活性氧和活性氮的增加,调节机体内氧化剂和抗氧化剂的稳态,防止或减弱生物大分子的氧化损伤,从而达到降低许多慢性疾病的发病率以及延缓衰老的作用[2]。此外,多酚成分能够形成食品中的苦味、涩味、香味、颜色以及氧化稳定性等,是果蔬、谷物等食品感官质量和营养质量的决定因素[3]。
多酚类化合物指芳香烃中苯环上一个或多个氢原子被羟基取代所生成的化合物,是植物的重要次生代谢产物,主要包括酚酸、黄酮类、芪、单宁和木脂素类,其中酚酸又包括羟基肉桂酸和羟基苯甲酸类,黄酮类又分为黄酮醇、黄酮、黄烷醇(儿茶素)、黄烷酮、花青素和异黄酮类[4]。天然来源的多酚成分具有多样的生物学活性,如抗氧化、抗辐射、抗癌、降血压等,对人类的健康起着非常重要的作用[5]。
多酚类物质的抗氧化性一直是国内外研究的热点,但主要以多酚混合体系的研究为主,对多酚类物质单体的抗氧化能力研究相对较少[6]。本文选用羟基肉桂酸、芪和黄酮的典型代表咖啡酸、白藜芦醇和芦丁以及根皮素和根皮苷等常见多酚类物质的单体作为研究对象,并以VC、BHT和EDTA等为对照,研究其总抗氧化能力、DPPH和ABTS自由基清除活性、铁离子还原能力以及金属离子螯合能力等,通过多种体外体系对上述几种多酚类物质的抗氧化活性进行综合评价,分析各多酚类化合物的抗氧化机理,为其进一步的开发应用提供科学依据。
1 材料与方法
1.1 仪器和试剂
UV-2700紫外-可见光分光光度计,日本 SHIMADZU公司;JA5003电子天平,上海舜宇恒平科学仪器有限公司;Centrifuge 5804 R冷冻离心机,德国eppendorf公司;HH-6数显恒温水浴锅,国华电器有限公司;VORTEX-6电动振荡器,上海其林贝尔有限公司;FE-20实验室pH计,美国梅特勒-托利多仪器(上海)有限公司。
咖啡酸、芦丁、白藜芦醇、根皮素、根皮苷、2,2-联苯基-1-苦基肼基(DPPH),百灵威科技有限公司;2,2'-联氨-双 (3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)、菲洛嗪(Ferrozine),合肥博美生物有限公司;K3Fe(CN)6、四水合钼酸铵,国药集团化学试剂有限公司;2,4,6-三吡啶基三嗪(TPTZ),阿拉丁试剂有限 公 司;乙 醇、FeCl3、FeCl2、冰 醋 酸、K2S2O8、NaH2PO4、Na2HPO4等试剂均为分析纯。
1.2 总抗氧化能力
总抗氧化能力(TAC)的测定运用钼酸铵法,抗氧化物质可以将Moボ还原为Moブ,并且在酸性条件下形成绿色Moブ的磷酸盐。配制钼酸铵反应体系:分别称取2.13 g Na3PO4、0.99 g四水合钼酸铵、6.67 mL浓H2SO4溶于200 mL水中,使其浓度依次为28 mmol/L、4 mmol/L和 0.6 mol/L,混和均匀。配制0.1 mg/mL的样品溶液及0.01~0.09 mg/mL的VC溶液,将0.3 mL待测物加入到3 mL的钼酸铵反应体系中,将混合液混匀并于95℃恒温水浴90 min,反应液冷却后,于695 nm处测定吸光值,以不加样品的空白试剂调零[7]。被测物的总抗氧化能力以VC的当量来表示[7]。
1.3 DPPH自由基清除活性
DPPH·在有机溶剂乙醇中是一种稳定的自由基,其孤对电子在517 nm附近有强吸收,自由基清除剂可与孤对电子进行配对,使吸收消失或减弱,测定吸收减弱的程度即可反映自由基清除剂的活性[8]。称取9.85 mg DPPH以无水乙醇定容至250 mL作为DPPH工作液,在反应体系中,于10 mL试管中加入200 μL不同浓度的样品溶液,再加入2 mL DPPH工作液,振荡摇匀,于室温下避光静置30 min,测定517 nm处的吸光值,以加入等量的超纯水作为空白对照[9]。以样品浓度为自变量,自由基清除率为因变量作图并进行线性拟合,计算IC50值,其中IC50值定义为清除率为50%时所需抗氧化剂的浓度,所需浓度越低,表明该物质抗氧化性越强[10]。
DPPH自由基清除率/%=(1-AS/A0)×100
其中:AS为样品管的吸光值;A0为对照管的吸光值。
1.4 ABTS自由基清除活性
称取0.192 0 g ABTS、0.033 1 g K2S2O8于烧杯中,并用去离子水定容至50 mL,使ABTS浓度为7 mmol/L,过硫酸钾的浓度为2.45 mmol/L,将该溶液于室温下暗处静置12~16 h。将生成的ABTS自由基溶液用磷酸缓冲液(PBS,0.01 mol/L,pH 7.4)稀释至734 nm处吸光值为0.70[11]。反应体系中,于10 mL试管中加入20μL不同浓度的样品,再加入2 mL ABTS反应液,振荡摇匀,室温下静置10 min,测定反应液在734 nm处的吸光值,以不加入样品的ABTS自由基溶液为空白对照,并计算IC50值。
ABTS自由基清除率/%=(1-AS/A0)×100
其中:AS为样品管的吸光值;A0为对照管的吸光值。
1.5 铁离子还原能力(FRAP)
称取0.93 g三水合乙酸钠加入4.8 mL冰醋酸,以超纯水定容至300 mL;称取0.093 7 g TPTZ,加入99 μL浓HCl,以超纯水定容至30 mL;称取0.162 1 g FeCl3,加入30 mL超纯水溶解摇匀。将以上3种溶液混合即得FRAP工作液。以超纯水配制0.05 mg/mL样品、BHT和VC溶液,于10 mL试管中分别加入0、100、200、300、400 μL(分析时换算成浓度)的待测物,再加入2mL FRAP工作液,振荡摇匀,37℃下静置10 min,测定593 nm 处吸光值[12]。
1.6 金属离子螯合能力
以待测物对二价铁离子(Fe2+)的清除活性来评价其金属离子螯合能力。Fe2+可与菲咯嗪(ferrozine)反应生成紫红色的Fe2+-ferrozine络合物,并于562 nm处有最大吸收,当反应体系中存在具有金属螯合能力的物质时,Fe2+-ferrozine络合物的形成受到抑制,表现为吸光值的降低[13]。参照Chung等的测定方法[14],向2.4 mL不同浓度的样品溶液中依次加入现配的 30 μL 2 mmol/L 的 FeCl2溶液和 60 μL 5 mmol/L的菲咯嗪溶液,混合均匀后室温静置10 min,测定混合液在562 nm处的吸光值,以等量的超纯水代替样品溶液作为空白对照。
金属离子螯合率/%=(1-AS/A0)×100
其中:AS为样品管的吸光值;A0为对照管的吸光值。
1.7 统计学分析
所有实验重复测定3次,各项指标的数据均用Origin 8.5软件处理作图,并采用SPSS 19.0软件进行统计学分析。测量数据均以Mean±S.D.表示,P<0.05认为有显著差异,P<0.01认为具有极显著差异。
2 结果与讨论
2.1 总抗氧化能力
VC的标准曲线及各种多酚类物质的VC当量,如图1-a、图1-b所示。由图1-a可知,标准曲线在所选浓度范围内有较好的线性关系R2=0.991 2,如图1-b所示,几种多酚类物质在浓度为0.1 mg/mL时,总抗氧化能力大小依次为咖啡酸>白藜芦醇>芦丁>根皮苷>根皮素,且上述5种多酚类物质总抗氧化能力的差异极显著(P<0.01),其中咖啡酸的抗氧化能力最高,达到(1.873±0.022)mg VCeq/mg;其余多酚类物质的VC当量依次为(0.810±0.015)、(0.684±0.018)、(0.414±0.037)、(0.199±0.012)mg VCeq/mg。

图1 VC标准曲线(a)和5种多酚类化合物的VC当量(b)Fig.1 The standard curve of VC(a)and VCequivalent of five polyphenols(b)
咖啡酸和白藜芦醇的分子结构中均含有苯乙烯基结构,且均含有3个羟基,差别在于咖啡酸相比于白藜芦醇少一个苯环,相同质量浓度的咖啡酸比白藜芦醇具有更多的羟基和乙烯基,表现为咖啡酸具有更强的总抗氧化能力。芦丁分子结构中含有10个羟基,根皮苷有7个羟基,根皮素有4个羟基,相同质量浓度条件下,羟基数目大小依次为芦丁>根皮苷>根皮素,与3种物质总抗氧化能力相一致。由此可见,多酚类物质的总抗氧化能力与乙烯基和羟基的数目有着一定的关系。Sokół- ɬętowska 等报道[15],多酚类化合物的性质和应用都根源于其独特的化学结构,其中酚羟基结构是多酚类化合物的有效基团之一,与本研究结果相符。
2.2 DPPH自由基清除活性
以各样品浓度为自变量,自由基清除率为因变量的线性拟合曲线如图2所示。如图2-a~图2-f所示,咖啡酸、芦丁、白藜芦醇、根皮素和根皮苷以及2个阳性对照BHT和VC在所选浓度范围内均有较好的线性关系,根据拟合曲线所求得各抗氧化剂的IC50值如表1所示。
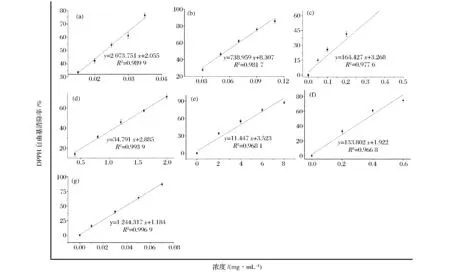
图2 不同浓度的咖啡酸(a),芦丁(b),白藜芦醇(c),根皮素(d),根皮苷(e),BHT(f)和VC(g)对DPPH自由基的清除能力及它们的线性拟合结果Fig.2 Dose-dependent inhibitions of caffeine acid(a),rutin(b),resveratrol(c),phloretin(d),phlorizin(e),BHT(f)and VC(g)on DPPH free radicals and their linearity correlation
如表1所示,在DPPH自由基清除实验中,各抗氧化剂均具有较强的清除DPPH自由基的能力,大小依次为:咖啡酸≈VC≈芦丁>白藜芦醇>BHT>根皮素>根皮苷,通过邓肯式方差分析得到,咖啡酸、VC、芦丁在统计学上没有显著差异(P>0.05),其余各样品之间均存在显著差异(P<0.05)。Karaman等[16]研究表明植物多酚可以作为还原剂、氢原子供体和氧自由基清除剂,个别的多酚类物质还具有金属离子螯合能力;Vignoli等[17]报道咖啡饮料中酚酸的含量与DPPH自由基的清除能力呈极显著的正相关性;Hou等[18]研究表明分子中羟基的位置与其自由基清除活性有关;Huang等[19]报道生物系统中的pH和代谢产物均可使多酚类化合物的结构发生改变,从而影响其抗氧化活性。由此可见,多酚类化合物具有清除自由基的能力,且清除能力大小受多种因素控制。
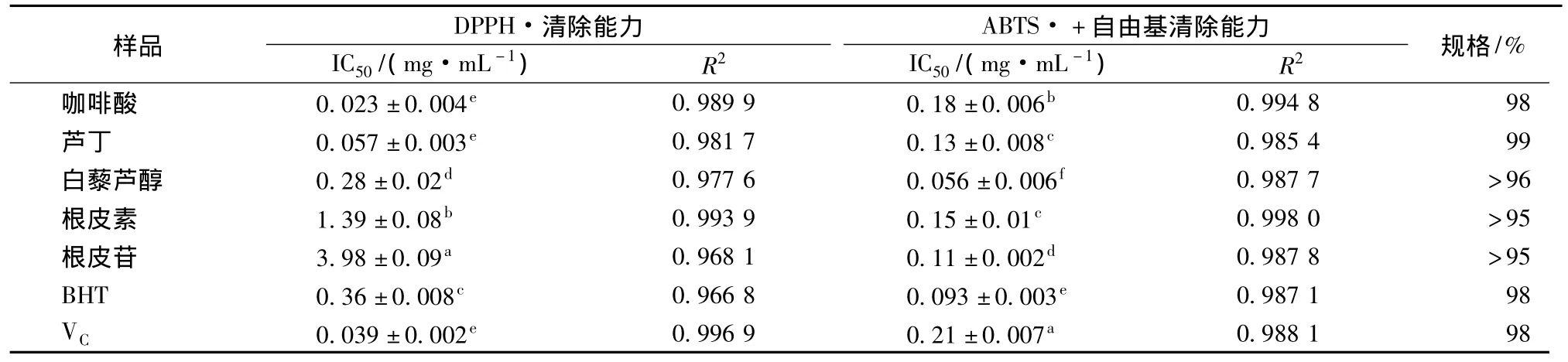
表1 5种多酚化合物,BHT和VC清除DPPH和ABTS自由基的IC50值Table 1 IC50values of five phenolic compounds,BHT and VCdetermined by DPPH assay and ABTS assay
2.3 ABTS自由基清除活性
本实验利用过硫酸钾将ABTS氧化成相对稳定的蓝绿色ABTS水溶性自由基,ABTS自由基既是亲水型化合物又是亲脂型化合物,所以较DPPH自由基更容易反应,ABTS+·的清除是电子转移过程,体系中的抗氧化剂与其反应将会使溶液褪色,表现为吸光值的降低[20]。
以各抗氧化剂浓度为自变量,自由基清除率为因变量的线性拟合曲线如图3所示。
从图3中可以看出各抗氧化剂在选定的浓度范围内均有较好的线性关系。根据拟合曲线所求得各抗氧化剂的IC50值见表1。
在ABTS自由基清除实验中,各样品均具有较强的ABTS自由基清除能力,大小依次为:白藜芦醇>BHT>根皮苷>芦丁≈根皮素>咖啡酸>VC,通过方差分析得到白藜芦醇清除ABTS自由基能力最强,极显著高于阳性对照BHT和VC(P<0.01);芦丁和根皮素之间没有显著差异(P>0.05),其他样品之间均存在显著差异。通过SPSS相关性分析可知5种多酚对上述两种自由基的清除能力相关性较低(R2=0.1),Wootton-Beard 等[21]研究 23 种果蔬饮料对ABTS自由基和DPPH自由基清除能力,发现二者相关性较低(R2=0.45),与本实验研究结果一致。张逸波等[22]得到BHT清除ABTS的IC50值为(246.9±10.5)μmol/L即(0.054±0.002)mg/mL,与本实验结果相近,实验结果的差异可能是由于氧化体系不同所致。
2.4 还原能力
由图4可知,随着样品浓度的增加,吸光度值逐渐升高,即铁离子还原能力逐渐升高,由方差分析可知,当浓度为0.002 mg/mL时,咖啡酸与VC之间抗氧化性并没有显著差异(P>0.05),但二者均极显著高于其他多酚类化合物和BHT(P<0.01);当浓度为0.004、0.006、0.008 mg/mL 时,各抗氧化剂之间均存在极显著差异(P<0.01)。各样品铁离子还原能力大小依次为:VC>咖啡酸>BHT>白藜芦醇>芦丁>根皮素>根皮苷,通过相关性分析可知5种多酚类化合物FRAP与TAC相关性较高(R2=0.81),且与DPPH自由基清除能力相关性较低(R2=0.64)与Wootton-Beard 等[21]研究结果相近。
2.5 金属离子螯合能力
人体内过量的金属离子可引起脂质过氧化,并进一步诱导自由基和脂质过氧化物的产生,因此,螯合金属离子可通过间接的途径达到抗氧化和抗自由基的目的[23]。研究中发现,咖啡酸、根皮素和根皮苷不具有金属离子螯合能力,随其浓度的改变,吸光值之间差异不显著(P>0.05),芦丁和白藜芦醇的金属螯合能力如图5所示。
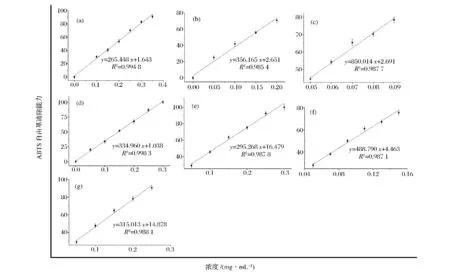
图3 不同浓度的咖啡酸(a),芦丁(b),白藜芦醇(c),根皮素(d),根皮苷(e),BHT(f)和VC(g)对ABTS自由基的清除能力及它们的线性拟合结果Fig.3 Dose-dependent inhibitions of caffeine acid(a),rutin(b),resveratrol(c),phloretin(d),phlorizin(e),BHT(f)and VC(g)on ABTS free radicals and their linearity correlation
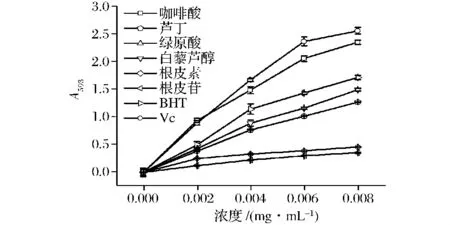
图4 不同浓度咖啡酸,芦丁,白藜芦醇,根皮素,根皮苷,BHT和VC的铁离子还原能力Fig.4 Dose-dependent ferric reducing ability of caffeine acid,rutin,resveratrol,phloretin,phlorizin,BHT and VC
从图5中可以看出芦丁和白藜芦醇都有一定的螯合金属离子的能力,且芦丁的金属离子螯合能力高于白藜芦醇,由于继续增加浓度清除率增加缓慢,所以不利于IC50值得计算,考虑可能是多酚的溶解性限制了其金属螯合能力的发挥。阳性对照BHT和VC具有较强的金属离子螯合能力,IC50值分别达到了(6.9±0.02)μg/mL(R2:0.981)和(5.1±0.05)μg/mL(R2:0.993),与 Gulcin等人研究结果基本一致[24]。Ebrahimzadeh 等[25]报道,果蔬提取物中酚酸和黄酮类成分与铁离子螯合能力相关性较弱(R2=0.4),Ghasemi等[26]研究表明一些多酚提取物与金属离子螯合能力具有很好的线性关系,但也存在一些多酚提取物无金属离子螯合能力。可见金属离子螯合能力与黄酮和酚酸的整体结构以及羟基的位置等有关,并不是黄酮或酚酸等多酚类化合物的共性。
3 结论
以5种体外体系对咖啡酸、芦丁、白藜芦醇、根皮素和根皮苷等多酚类化合物的抗氧化活性进行评价。结果表明咖啡酸具有极强的总抗氧化能力,0.1 mg/mL时达到(1.873±0.022)mg VCeq/mg;很强的DPPH自由基清除能力[IC50(0.023±0.004)mg/mL],极显著高于阳性对照BHT;很强的铁离子还原能力,极显著高于BHT。白藜芦醇具有极强的ABTS自由基清除能力[IC50(0.056±0.006)mg/mL],极显著高于阳性对照BHT和VC。芦丁金属离子螯合能力最强,白藜芦醇次之,但远不及阳性对照BHT和EDTA,其余3种多酚化合物不具有金属离子螯合能力。

图5 不同浓度芦丁(a)和白藜芦醇(b)的金属离子螯合能力Fig.5 Dose-dependent ferrous ions chelating activity of rutin(a)and resveratrol(b)
[1] Johnson I.New approaches to the role of diet in the prevention of cancers of the alimentary tract[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2004,551(1):9-28.
[2]Gülçin˙I,Mshvildadze V,Gepdiremen A,et al.The antioxidant activity of a triterpenoid glycoside isolated from the berries of Hedera colchica:3‐O‐(β‐d‐glucopyranosyl)-hederagenin [J]. PhytotherapyResearch,2006,20(2):130-134.
[3] Naczk M,Shahidi F.Phenolics in cereals,fruits and vegetables:Occurrence,extraction and analysis[J].Journal Of Pharmaceutical And Biomedical Analysis,2006,41(5):1 523-1 542.
[4] LIU R H.Potential synergy of phytochemicals in cancer prevention:Mechanism of action[J].Journal Of Nutrition,2004,134(12):3 479-3 485.
[5] Popa V I,Dumitru M,Volf I,et al.Lignin and polyphenols as allelochemicals[J].Industrial Crops And Products,2008,27(2):144-149.
[6] 王俏,邹阳,钟耕,等.多酚类单体物质抗氧化活性的研究[J].食品工业科技,2011,32(1):137-145.
[7] 周方,赵宏飞,杨洋,等.高丛蓝莓品种花青素含量与抗氧化能力比较[J].西南林业大学学报,2011,31(5):53-57.
[8] 余丹丹,张昊,丁庆波,等.咖啡酸与乳蛋白结合的光谱特性及结合物抗氧化活性变化[J].光谱学与光谱分析,2012,32(4):1 061-1 067.
[9] Sharma V,Vijay Kumar H,Jagan Mohan Rao L.Influence of milk and sugar on antioxidant potential of black tea[J].Food Research International,2008,41(2):124-129.
[10] Boath A S,Stewart D,McDougall G J.Berry components inhibit alpha-glucosidase in vitro:Synergies between acarbose and polyphenols from black currant and rowanberry[J].Food Chemistry,2012,135(3):929-936.
[11] Ozgen M,Reese R N,Tulio A Z,et al.Modified 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS)method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power(FRAP)and 2,2'-diphenyl-1-picrylhydrazyl(DPPH)methods[J].Journal Of Agricultural And Food Chemistry,2006,54(4):1 151-1 157.
[12] Almajano M P,Delgado M E,Gordon M H.Changes in the antioxidant properties of protein solutions in the presence of epigallocatechin gallate[J].Food Chemistry,2007,101(1):126-130.
[13]Gülçin˙I,Elias R,Gepdiremen A,et al.Antioxidant activity of bisbenzylisoquinoline alkaloids from Stephania rotunda:cepharanthine and fangchinoline[J].Journal Of Enzyme Inhibition And Medicinal Chemistry,2010,25(1):44-53.
[14] CHUNG Y C,CHANG C T,CHAO W W,et al.Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1[J].Journal Of Agricultural And Food Chemistry,2002,50(8):24 54-2 458.
[15] Sokół-Łętowska A,Oszmiański J,Wojdyło A.Antioxidant activity of the phenolic compounds of hawthorn,pine and skullcap[J].Food Chemistry,2007,103(3):853-859.
[16] Karaman Ş,Tütem E,Sözgen Başkan K,et al.Comparison of total antioxidant capacity and phenolic composition of some apple juices with combined HPLC-CUPRAC assay[J].Food Chemistry,2010,120(4):1 201-1 209.
[17] Vignoli J A,Bassoli D G,Benassi M T.Antioxidant activity,polyphenols,caffeine and melanoidins in soluble coffee:The influence of processing conditions and raw material[J].Food Chemistry,2011,124(3):863-868.
[18] HOU W C,LIN R D,CHENG K T,et al.Free radicalscavenging activity of Taiwanese native plants[J].Phytomedicine,2003,10(2):170-175.
[19] Huang D,Ou B,Prior R L.The chemistry behind antioxidant capacity assays[J].Journal Of Agricultural And Food Chemistry,2005,53(6):1 841-1 856.
[20]Gülçin˙I.Antioxidant activity of l-adrenaline:A structure-activity insight[J].Chemico-Biological Interactions,2009,179(2):71-80.
[21] Wootton-Beard P C,Moran A,Ryan L.Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and after in vitro digestion measured by FRAP,DPPH,ABTS and Folin-Ciocalteu methods[J].Food Research International,2011,44(1):217-224.
[22] 张逸波,郑文杰,黄峙,等.硒杂环化合物SPO清除DPPH和ABTS自由基的光谱学研究[J].光谱学与光谱分析,2010,30(07):1 866-1 871.
[23]Bursal E,Köksal E,Gülçin˙I,et al.Antioxidant activity and polyphenol content of cherry stem(Cerasus avium L.)determined by LC-MS/MS[J].Food Research International,2013,51(1):66-74.
[24] Gulcin I,Bursal E,Sehitoglu M H,et al.Polyphenol contents and antioxidant activity of lyophilized aqueous extract of propolis from Erzurum,Turkey[J].Food And Chemical Toxicology,2010,48(8-9):2 227-2 238.
[25] Ebrahimzadeh M,Nabavi S,Nabavi S.Correlation between the in vitro iron chelating activity and poly phenol and flavonoid contents of some medicinal plants[J].Pakistan Journal of Biological Sciences,2009,12(12):934-938.
[26] Ghasemi K,Ghasemi Y,Ebrahimzadeh M A.Antioxidant activity,phenol and flavonoid contents of 13 citrus species peels and tissues[J].Pakistan Journal Of Pharmaceutical Sciences,2009,22(3):277-281.
