牡蛎蛋白分离组分的酶法改性*
2014-12-16张晶晶郑惠娜章超桦郝记明张静范朝泳
张晶晶,郑惠娜,章超桦,郝记明,张静,范朝泳
(广东省水产品加工与安全重点实验室,广东普通高等学校水产品深加工重点实验室,国家贝类加工技术研发分中心(湛江),广东海洋大学食品科技学院,广东湛江,524088)
牡蛎属软体动物门,双壳纲,珍珠贝目,牡蛎科,俗称蚝,别名蛎黄、蚝白、海蛎子。牡蛎是一种珍贵的海产软体动物,它不仅是一种著名的海产贝类,而且是一种天然保健食品。我国每年牡蛎产量居全球首位,2012年牡蛎产量达394.88×104t,占贝类养殖产量的 32.68%[1]。
蛋白质会对食品的质构、风味和加工性状产生重大影响,这主要是因为蛋白质具有不同的功能性质。首先判断蛋白质是否具有潜在应用价值的一个指标就是蛋白质的溶解性,起始溶解性较大的蛋白质,有利于蛋白质其他功能性质的提高。水产蛋白的热稳定性和化学稳定性较低,容易变性,在牡蛎蛋白提取过程中也有不同程度的变性,其中冷冻干燥的影响最大,导致其溶解性和乳化性不佳,不能完全满足食品加工的需求,所以在食品加工中的应用受到限制。因此,对牡蛎蛋白进行改性,提高牡蛎蛋白制品营养成分的生物有效、利用性成为食品加工业亟待解决的问题。
酶法改性是一种常用的改性方法,可以得到功能特性优良的蛋白[2]。酶水解程度不同导致牡蛎蛋白结构等方面的改变也不同,通过酶改性可得到满足不同需求的功能性牡蛎蛋白质,从而拓宽牡蛎蛋白在食品工业中应用的范围[3]。目前,国内外学者在蛋白的改性研究方面做了许多工作[4-5]。Adler-Nissen和Olsen[6]研究发现,大豆分离蛋白经碱性蛋白酶和中性蛋白酶有限酶解后,溶解性和乳化性都有很大的提高。Qi Hettiarachchy 和 Kalapathy[7]同样证明酶法改性的效果,研究证明适当的酶解蛋白可以提高蛋白的溶解性、乳化性、乳化稳定性和起泡能力。然而,有关酶法改性的研究大多数是以鱼蛋白为对象,而对贝类的酶法改性研究,报道较少。
本研究在前期对牡蛎蛋白进行分离并研究其功能特性中发现,水溶性蛋白和盐溶性蛋白的溶解性和乳化性均不佳,故分别使用了胰蛋白酶和碱性蛋白酶对3种牡蛎蛋白分离组分进行水解,并对牡蛎蛋白各个时间段的酶解产物的溶解性和乳化性的变化趋势进行了比较,获取具有更佳功能特性的蛋白,为进一步利用牡蛎蛋白提供理论参考。
1 材料和方法
1.1 试剂材料
胰蛋白酶(trypsin),活力单位25万 U/g,购于Simga公司;碱性蛋白酶(Alcalase)Alcalase 2.4 L,活力单位20万U/g,购于诺维信公司。金龙鱼特香花生油为食品级,益海嘉里食品营销有限公司产品。试剂均为分析纯。
1.2 实验仪器
PHS-25数显pH计,上海康仪仪器有限公司;BL-6205精密电子天平,上海市岛津制作所;CR22G高速冷冻离心机,日本Hitachi公司;TJ12-A绞肉机,广东番禹恒联食品机械厂;T25高剪切乳化分散机德国IKA;UV-2102PC紫外分光光度计,尤尼柯(上海)仪器有限公司。
1.3 实验方法
1.3.1 牡蛎蛋白的制备
牡蛎蛋白组分的制备参考文献[8]的制备方法。
1.3.2 酶法改性
配制质量浓度为5%的蛋白溶液,用1 mol/L NaOH调pH至8.0,分别加入胰蛋白酶和碱性蛋白酶(加酶量 E/S=1∶200)分别反应 10、20、30、40、50、70、110、150、200 min,采用甲醛滴定法测定水解度。反应结束后,100℃灭酶10 min,冷却后离心(4℃,5 000 r/min,15 min),取上清液调 pH至7.0。对照样在不加酶的情况下同上操作。
1.3.3 水解度的测定[6]
吸取5 mL样液,置于100 mL容量瓶中,加水至刻度,混匀后吸取20 mL,置于200 mL烧杯中,加60 mL水,开动磁力搅拌器,用0.05 mol/L NaOH滴定至酸度计显示pH=8.2,记下消耗的NaOH体积,加入10 mL甲醛混匀,再用NaOH继续滴定至pH=9.2,记下消耗的NaOH体积:

式中:X4为样品中氨基态氮含量(以氮计),g/100 mL;V4为滴定样品稀释液消耗0.05 mol/L NaOH标准滴定溶液的体积,mL;V3为空白试验消耗0.05 mol/L NaOH标准滴定溶液的体积,mL;V5为样品稀释液用来,mL;C3为NaOH标准滴定溶液浓度,mol/L;0.014为1.00 mL NaOH标准滴定溶液相当于氮的质量,g。
1.3.4 溶解性的测定[9]
考马斯亮蓝法测定上清液蛋白质含量

1.3.5 乳化性的测定[10]
取蛋白浓度为0.5%(w/v)的蛋白液9 mL于25 mL量杯中,加入3 mL花生油,分别调节pH值为7,均质1 min(固定一个位置,转速约12 000 r/min)。迅速从量杯底部取20 μL清液加入到5 mL 0.1%(w/v)的SDS溶液中,摇匀,立即在500 nm波长下比色(以0.1%SDS为空白)测定0 min的吸光值(A0),放置10 min后再取样同上检测吸光值(Al)。以A1表示乳化活力指数(EAI),乳化稳定性指数(ESI)表示为:
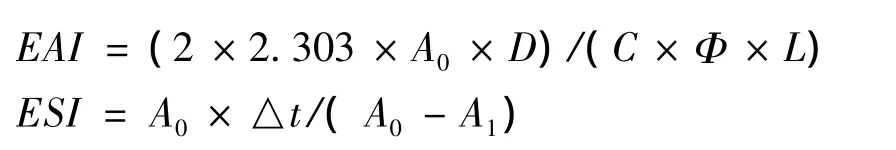
式中:D为稀释倍数,D=250;C为蛋白质浓度,g/mL;Φ为油相所占的比例,Φ=1/4;L为比色皿的厚度,L=1 cm;△t=10 min。
1.3.6 数据分析
采用Excel作图,实验数据用SPSS软件进行多重比较分析,结果用不同字母表示显著性差异(P<0.05),数据均为3次数值的平均值。
2 结果与讨论
2.1 胰蛋白酶水解3种蛋白组分的水解情况比较
按照1.4.2的方法,用胰蛋白酶对水溶性蛋白、盐溶性蛋白和不溶性蛋白进行可控酶解,酶解过程中水解度随时间变化如图1所示。

图1 胰蛋白酶水解牡蛎水溶性、盐溶性和不溶性蛋白的水解度比较结果Fig.1 The degree of hydrolysis of oyster water-soluble,salt soluble and insoluble protein hydrolysated by trypsin(不同字母表示具有显著性差异(P<0.05))
反应起始阶段,底物浓度大,肽链的断裂速度较快,在前70 min内水解速度较快,之后水解度仍在增大但增加的速度趋于平缓,比较而言,水溶性蛋白最容易被水解,其次是盐溶性蛋白和不溶性蛋白。反应进行200 min后,胰蛋白酶水解水溶性蛋白的产物的水解度可达15.69%。胰蛋白酶是属于丝氨酸蛋白酶中的一种,切开肽键羧基端的精氨酸和赖氨酸,肽链长度适中。这主要是因为随着水解的进行,分子变小,每个分子中酶可作用的位点减少,因而酶将分子切断成更小的分子的速度变慢。水解度越高就表示肽键被切断的数目越多,越多的游离氨基酸和小肽的生成。但是水解度过高时,暴露了肽链中的疏水性氨基酸而产生苦味肽,影响蛋白质的功能性质[11]。水溶性蛋白由于其本身易溶于水的性质,分子量较小,肽链较短,在短时间内蛋白酶就能达到很好的剪切效果。盐溶性蛋白主要是肌原纤维蛋白,而胰蛋白酶对肌原纤维蛋白有较好的水解能力。任娇艳[12]用木瓜蛋白酶、菠萝蛋白酶、Neutrase1.5 MG、Alcalase2.4L和PTN6.0分别水解罗非鱼的肌浆蛋白和肌原纤维蛋白,发现相同蛋白酶作用于肌原纤维蛋白所得酶解产物的水解度略低于肌浆蛋白酶解产物,这也与肌原纤维蛋白的结构特点有关。这与牡蛎水溶性蛋白和盐溶性蛋白的结果相似。不溶性蛋白的主要成分是基质蛋白,由于基质蛋白的结构性质,不溶性蛋白相对难以被水解。随着水解时间的延长,水解度一直增加,在反应200 min后最高达到10.93%。
2.2 碱性蛋白酶水解3种蛋白组分的水解情况比较
按照1.4.2的方法,水溶性蛋白、盐溶性蛋白和不溶性蛋白经碱性蛋白酶水解的水解情况如图2所示。
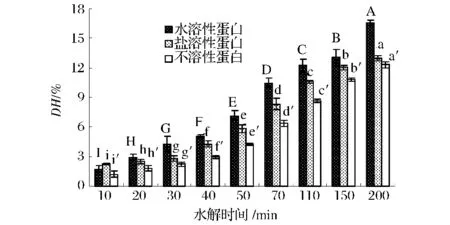
图2 碱性蛋白酶水解牡蛎水溶性、盐溶性和不溶性蛋白的水解度比较结果Fig.2 The degree ofhydrolysis of oyster water-soluble,salt soluble and insoluble protein hydrolysated by alcalase(不同字母表示具有显著性差异(P<0.05))
碱性蛋白酶对3种蛋白的酶解情况与胰蛋白酶的水解度的变化趋势基本相似。蛋白酶对蛋白的不同水解特性主要与其专一性有关。碱性蛋白酶是一种非特异性肽键内切酶,主要作用于含疏水性羟基的肽键,释放的肽链更短,产率高。由图1和2的对比,发现3种样品在相同酶解时间下,碱性蛋白酶水解产物的水解度都比胰蛋白酶水解产物的水解度高,反应200 min碱性蛋白酶水解产物的水解度最高可达16.56%。施雪[13]用碱性蛋白酶、风味蛋白酶、中性蛋白酶和胰蛋白酶在最适条件下对鲤鱼肉蛋白分别进行酶解,结果表明在所有的水解样品中,碱性蛋白酶水解产物的水解度最高。同时在水解初期水解度都很低,同样由于碱性蛋白酶的强水解蛋白的能力,相对应碱性蛋白酶酶解产物的水解度高于胰蛋白酶的。任增超[14]用六种蛋白酶对罗非鱼下脚料蛋白酶解后,也发现碱性蛋白酶的水解效率最高。
2.3 酶法改性对溶解性的影响
图3所示为不同水解度下水溶性蛋白、盐溶性蛋白和不溶性蛋白的碱性蛋白酶和胰蛋白酶水解产物溶解性的变化。由图3可知,2种蛋白酶酶解产物随水解度的变化趋势基本相似。随着水解度的增加,水溶性蛋白、盐溶性蛋白和不溶性蛋白酶解产物的溶解性也增加,其后随着时间的延长呈缓慢的增加趋势,且均高于牡蛎各蛋白组分本身的溶解性。比较而言,碱性蛋白酶酶解产物的溶解性较好。可能由于酶法水解后,蛋白质的结构被破坏进而疏水基团暴露,分子量减小,亲水性增加,蛋白的结构发生了有利于提高溶解性的变化[15]。正如 Gbogouri GA 等[16]用 Alcalase(R)蛋白酶水解三文鱼的研究结果,都表明水解度越高。溶解性越好。王素雅[17]等同样发现水解菜籽蛋白后,随着水解度的增加,溶解性也增加。
在pH7.0时,水溶性蛋白的溶解性由原来的48.50%提高到82.71%,提高了1.7倍,水解度在达到8%之前,溶解性变化较小。盐溶性蛋白的溶解性提高了2.3倍,最高达91.04%,水解度3%前溶解性变化较小,随后急剧增加。由此看出酶解作用对盐溶性蛋白的溶解性的提高显著强于水溶性蛋白。不溶性蛋白由于其溶解性质,几乎不溶解,但是经过两种酶水解后,结果表明,碱性蛋白酶和胰蛋白酶的水解产物分别最高为46.71%和46.25%,水解度3%时,溶解性变化不大,之后溶解性呈平缓的增加趋势,较不溶性蛋白的溶解性质,有很明显的改善。Quaglia[18]研究比较沙丁鱼的水解产物与本身蛋白的溶解性,也表明酶解能显著提高溶解性。大麻分离蛋白经酶解后,发现水解度在2.3% ~6.7%显著提高蛋白的溶解性[19],这与牡蛎盐溶性蛋白和不溶性蛋白在水解度3%后溶解性提高的结果相近,但与小麦蛋白酶解产物不同[20]。
2.4 酶法改性对乳化性的影响
由图4总体来看,牡蛎3种蛋白胰蛋白酶和碱性蛋白酶水解产物的乳化活性和乳化稳定性是呈先升高后降低的趋势。随着水解度的增大,对维持蛋白质稳定结构的氢键、范德华力、离子键等键破坏程度也越来越大,包裹在油滴表面的肽段越来越小,使油滴表面的保护层越来越薄,最终导致了乳化性的降低,也导致了乳化稳定性的降低[16]。
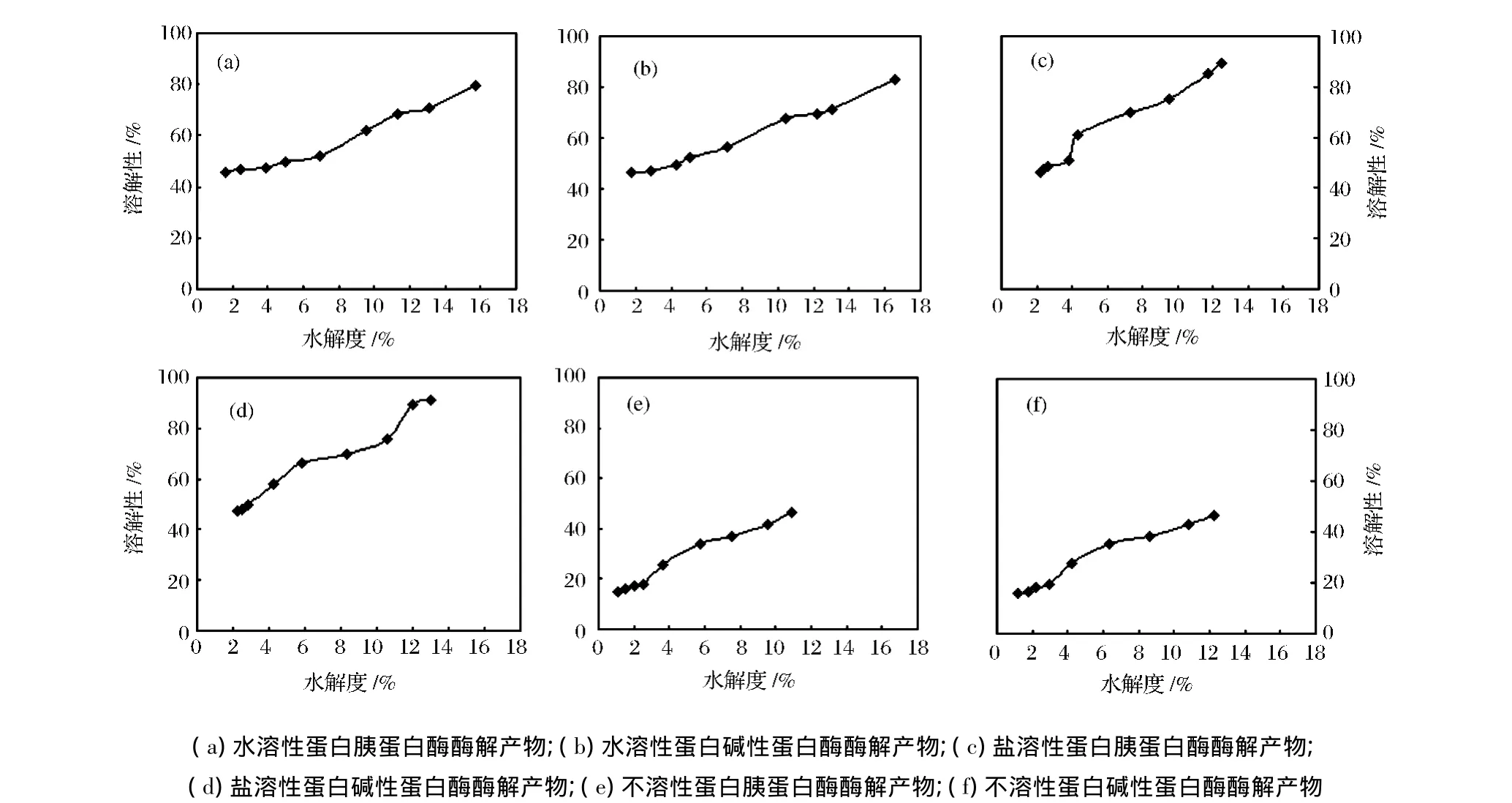
图3 牡蛎水溶性、盐溶性和不溶性蛋白酶解产物的溶解性Fig.3 The solubility of oyster water-soluble,salt soluble and insoluble protein hydrolysates by different proteases
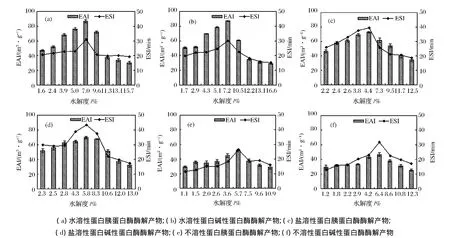
图4 牡蛎水溶性、盐溶性和不溶性蛋白酶解产物的乳化性和乳化稳定性Fig.4 The EAI and ESI of oyster water-soluble,salt soluble and insoluble protein hydrolysates by different proteases
水溶性蛋白胰蛋白酶和碱性蛋白酶的水解产物在反应50 min时,此时水解度为7.0%和7.2%时,乳化活性达到最高分别为86.63 m2/g、87.11 m2/g,乳化活力提高了1.8倍,乳化性明显好于罗非鱼下脚料,随着水解度增加,酶解产物的乳化性低于原料本身。水解产物的乳化稳定性大多数低于水溶性蛋白本身的乳化稳定性,但乳化稳定性高于大豆分离蛋白。碱性蛋白酶的水解产物的水解度较高于胰蛋白酶的,而胰蛋白酶的水解产物乳化稳定性较好。盐溶性蛋白胰蛋白酶和碱性蛋白酶的水解产物在水解度为4.4%和5.8%时,乳化活性达到最高,相比原料本身的乳化活力,提高了1.8倍,乳化稳定性提高了2.4倍,水解产物的乳化性和乳化稳定性一直高于盐溶性蛋白本身。不溶性蛋白的胰蛋白酶和碱性蛋白酶酶解产物分别在水解度5.7%和6.4%时,乳化活力和乳化稳定性均达到最高,且胰蛋白酶酶解后的乳化性较好,碱性蛋白酶的乳化稳定性较好。Sathivel等[21]对红鲑鱼进行酶解实验,研究表明酶解程度加深,溶解性增加,水解度在一定程度上,产物的乳化性最好。杨东等[22]研究鲢鱼水解蛋白同样表明一定程度的酶解提高乳化性,水解度增加反而降低乳化性。Chabanon等[23]报道从油菜籽蛋白中分离出的白蛋白和球蛋白经有限的水解处理后,乳化活力增加,当水解度过高时乳液的稳定性降低。同样Taha[24]发现油料子蛋白酶解处理后水解度与溶解性有直接的关系,低水解度的水解后乳化性有所提高。牡蛎蛋白经水解后的乳化性和乳化稳定性变化情况与这些研究结果相似,也充分证明了有限的水解能改善乳化性,这可能归因于疏水蛋白质的暴露提高吸附力从而形成一个有凝聚力的界面膜,加强疏水残基与油滴、水的交互作用[25]。
3 结论
牡蛎水溶性蛋白、盐溶性蛋白和不溶性蛋白随胰蛋白酶和碱性蛋白酶水解的进行,溶解性呈上升趋势,水解时间越长(DH越大),溶解性越好。蛋白酶水解对乳化性的影响与分子大小密功相关,适当水解度可以提高乳化活力,但水解度过大,对乳化活力起反作用,碱性蛋白酶水解物的水解度较高,对蛋白乳化性的反作用更大些影响。水溶性蛋白在水解度7%左右时(反应时间50 min)乳化活力和乳化稳定性较好;盐溶性蛋白经胰蛋白酶酶解后水解度在4.4%时乳化活力较高,经碱性蛋白酶酶解后水解度5.8%时乳化活力高;不溶性蛋白在水解度6%附近时(反应时间60 min)有较强的乳化活力。
[1] 农业部渔业局.中国渔业统计年鉴2013[M].北京:中国农业出版社,2013:28-29.
[2] Martin A M,Porter D.Studies on the hydrolysis of fish protein by enzymatic treatment [J].Food Chemistry,1995,37(8):1 395-1 404.
[3] Van Hekken,D L,Strange E D.Functional properties of dephosphorilated bovine whole casein[J].Journal of Dairy Science,1993,76(11):3 384-3 391.
[4] Vieira G H F,Martin A M,Sakersampaiao S,et al.Studies on the enzymatic hydrolysis of Brazilian Lobster(Panulirus spp.)processing wastes[J].Journal of the Science of Food and Agriculture,1995,69(1):61-65.
[5] Mcnairney J.Modification of a novel protein product[J].Journal of Chemical Technology and Biotechnology,1984,34(3):206-214.
[6] Adler Nissen J,Olsen H S.The influence of peptide chain on taste and functional properties of enzymatically modified soy protein[J].Abstracts of papers of the American Chemical Society,1978,175(3):125-146.
[7] Qi M,Hettiarachchy N S,Kalapathy U.Solubility and emulsifying properties of soy protein isolates modified by pancreatin[J].Journal of Food Science,1997,62(6):1 110-1 115.
[8] 张晶晶,郑惠娜,章超桦,等.牡蛎蛋白分离及其基本组成分析[J].食品与发酵工业,2013,39(9):147-151.
[9] Wu W U,Hettiarachchy N S,Qi M.Hydrophobicity,solubility,and emulsifying properties of soy protein peptides prepared by papain modification and ultrafiltration [J].Journal of the American Oil Chemists Society,1998,75(7):845-850.
[10] Miroljub Barac,Slavica Cabrilo,Sladjana Stanojevic,et al.Functional properties of protein hydrolysates from pea(Pisumsativum L.)seeds[J].International Journal of Food Science and Technology,2012,47(7):1 457-1 467.
[11] Iskender Arcan,Ahmet Yemenicioglu.Effects of controlled pepsin hydrolysis on antioxidant potential and fractional changes of chickpea proteins[J].Food Research International,2010,43(1),140-147.
[12] 任娇艳.草鱼蛋白源抗疲劳生物活性肚的制备分离及鉴定技术研究[D].广州:华南理工大学博士学位论文,2008:47-53.
[13] 施雪,孔保华,刘骞.酶水解制备鲤鱼肉蛋白抗氧化肽[J].东北农业大学学报,2011,42(11):32-38.
[14] 任增超.罗非鱼下脚料蛋白酶法改性的研究「D].广州:广东海洋大学硕士学位论文,2009:15-19.
[15] Das K P,Kinsella J E.Stability of food emulsions:physicochemical role of protein and non protein emulsifiers[J].Advances in Food and Nutrition Research,1990,34(1):81-129.
[16] Gbogouri G A,Linder M,Fanni J,et al.Influence of hydrolysis degree on the functional properties of salmon by-products hydrolysates [J].Journal of Food Science,2009,69(8):615-622.
[17] 王素雅,刘胜,鞠兴荣,等.中性蛋白酶限制性水解对高温菜籽粕蛋白功能性质的影响[J].食品与发酵工业,2010,36(1):56-59.
[18] Quaglia G,Orban E.Infiluence of the degree of hydrolysis on solubility of the protein hydrolysates from sardine(Sardina pilchardus)[J].Journal of the Science of Food and Agriculture,1987,38:271-276.
[19] Shou Wei Yin,Chuan He Tang,Jin Song Cao,et al.Effects of limited enzymatic hydrolysis with trypsin on the functional properties of hemp(Cannabis sativa L.)protein isolate[J].Food Chemistry,2008,106(3):1 004-1 013.
[20] Severin S,Xia W S.Enzymatic hydrolysis of whey protein by two different proteases and their effect on the functional properties of resulting protein hydrolysates[J].Journal of Food Biochemistry,2006,30(1):77-97.
[21] Sathivel S,Amiley S,Prinyawiwatkul W.Functional and nutritional properties of red salmon(Oncorhynchus nerka)enzymatic hydrolysates[J].Food Chemistry and Toxicology,2005,70(6):401-406.
[22] 杨东,王慥.水解鱼蛋白及其功能特性的研究[J].食品科学,1999,10(11):23-26.
[23] Chabanon G,Chevalot I,Framboisier X,Chenu S,Marc I.Hydrolysis of rapeseed protein isolates:Kinetics,characterization and functional properties of hydrolysates[J].Process Biochemistry,2007,42(10):1 419-1 428.
[24] FS Taha,MA Ibrahim.Effect of degree of hydrolysis on the functional properties of some oilseed proteins[J].Grasasy Aceites,2002,53(3):273-281.
[25] Phillips R D,Beuchat,LR.Enzyme modification of proteins[J].Protein Functionality in Foods,1981,13(3):275-298.
