miR-26a靶向EZH2抑制涎腺腺样囊性癌ACC-M细胞的增殖活性
2014-12-16刘春喜郅克谦王志瑜西安交通大学口腔医院颌面外科西安70004西安市第四医院口腔科西安交通大学校医院口腔科通讯作者mailliuchx70004com
刘春喜,王 仪,郅克谦,王志瑜(西安交通大学口腔医院颌面外科,西安 70004;西安市第四医院口腔科;西安交通大学校医院口腔科;通讯作者,E-mail:liuchx70004@6.com)
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)约占涎腺恶性肿瘤的 27% 左右[1],具有极强的侵袭性,早期即可侵犯血管和神经,而且还易发生远处转移,以肺转移最为常见,转移率高达40%。目前临床对于SACC的治疗主要采取手术联合放疗,但远期疗效仍不甚理想。近年来多数研究认为SACC的形成是由多种肿瘤相关基因的异常表达所引起,但具体的分子机制仍不清楚[2,3]。miRNAs是一类小分子非编码RNA,主要通过转录后水平调控下游靶基因的mRNA的3’UTR(3’-非编码区),目前研究已经证实多数miRNAs位于抑癌基因或致癌基因相关染色体区域,其异常表达很容易激发肿瘤的发生[4]。miR-26a在多种人类肿瘤中均呈下调趋势,miR-26a的过表达可以通过抑制多个下游靶基因的表达来调控肿瘤细胞的增殖和转移[5,6]。本研究采用生物信息学的方法预测出miR-26a与EZH2(Enhancer of zeste homolog 2)的3’UTR区域存在良好的碱基互补关系,在此基础上构建miR-26a和EZH2相应真核表达载体,并通过荧光实时定量PCR(qRT-PCR)、MTT、双荧光素酶报告基因检测和Western blot方法检测miR-26a对腺样囊性癌ACC-M细胞增殖能力的影响及其对下游EZH2的靶向作用。
1 材料和方法
1.1 材料
涎腺腺样囊性癌细胞株ACC-M、E.coli DH5α、pcDNATM6.2和pmirGLO真核表达载体均来源于西安交通大学实验中心,Hin dⅢ、Eco RⅠ、SacⅠ和XhoⅠ四种限制性内切酶,T4 DNA连接酶,逆转录试剂盒和SYBR荧光染料均购自Takara公司(中国),质粒抽提及凝胶回收试剂盒购买自QIAGEN(北京)公司(中国),脂质体转染试剂LipofectamineTM2000(美国)和TRIzol购自Invitrogen公司(美国),MTT购自Sigma公司(美国),双荧光素酶报告基因检测系统购自Promega公司(美国),蛋白裂解液(RIPA)、10×annealing Buffer和 SDS-PAGE凝胶均购自碧云天生物技术公司,PVDF膜和蛋白发光液购自 Millipore公司(美国),DMEM/F12培养基、胎牛血清购自 Hyclone公司(中国),兔抗人EZH2(#5246)购自Cell Signaling公司(美国),小鼠抗人β-actin抗体购自Santa Cruz公司(美国),二抗羊抗兔(小鼠)抗体均购自北京中杉金桥公司。
1.2 方法
1.2.1 miR-26a和EZH2真核表达载体构建 首选于 miRbase网站(http://www.mirbase.org/)检索hsa-miR-26a的前体pre-miR-26a的颈环序列(GUGGCCUCGUUCAAGUAAUCCAGGAUAGGCUGUGCAG GUCCCAAUGGGCCUAUUCUUGGUUACUUGCACGG GGACGC),将所有“U”均变为“T”,同时设计该序列的互补链,在两条序列两段添加Hin dⅢ和Eco RⅠ酶切位点。此外,采用TARGETSCAN-VERT(http://www.targetscan.org/)证实 miR-26a 与备选靶基因 EZH2(ACUUUGAAUAAAGAAUACUUGAA)具有良好的碱基互补配对关系,在该序列及其互补序列两侧添加SacⅠ和XhoⅠ双酶切位点。同时将miR-26a与EZH2互补的种子区进行碱基突变。碱基序列由上海生物工程股份有限公司合成,annealing Buffer 95℃,4 min退火成双链。将 pcDNATM6.2-GW质粒采用Hin dⅢ和Eco RⅠ进行双酶切,pmirGLO质粒采用SacⅠ和XhoⅠ双酶切,然后回收酶切后的大片段,采用T4 DNA连接酶连接pre-miR-26a与 pcDNATM6.2大片段构建 pcDNATM6.2-pre-miR-26a重组载体;同时应用 T4 DNA连接酶将EZH2野生型(EZH2-WT)和突变型(EZH2-MT)载体与pmirGLO大片段链接为pmir-GLO-EZH2-WT和pmirGLO-EZH2-MT重组载体,16℃过夜。将连接产物转化至E.coli DH5α感受态细胞,挑取单克隆、扩增、提取重组质粒,送至上海生物工程股份有限公司测序鉴定。
1.2.2 荧光实时定量 PCR(qRT-PCR)检测 miR-26a在腺样囊性癌ACC-M细胞中的表达及其对EZH2的影响 腺样囊性癌ACC-M细胞用含10%胎牛血清的DMEM/F12培养,5%CO2,37℃,恒温细胞培养箱中培养。取对数期ACC-M细胞进行消化,将其种于6孔板,每孔约4×105个细胞,将ACC-M细胞分为两组,其中一组不进行任何处理设为对照组,另一组按照LipofectamineTM2000脂质体转染试剂说明书将pre-miR-26a转染至ACC-M细胞,4 h后更换培养基,24 h采用Trizol提取总RNA,逆转录条件为RNA 500 ng,37 ℃ 15 min,85 ℃ 5 s 10 μl体系,扩增条件为95℃ 10 min,1 min预变性,95℃ 15 s,60℃30 s,72 ℃ 45 s,重复40 个循环,20 μl体系,检测 premiR-26a在ACC-M细胞中的转染效率,其中miR-26a的逆转录引物为:GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGACAGCCTAT,上游引物为 ATCCAGTGCGTGTCGTG,下游引物为TGCTTTCAAGTAATCCAGG,U6设为内参。此外,将ACC-M细胞分为两组分别转染pcDNATM 6.2空载体(Neg-miR)和 pcDNATM6.2-pre-miR-26a重组质粒(pre-miR-26a),采用上述qRT-PCR的方法检测miR-26a对EZH2 mRNA表达量的影响,其中EZH2的上游引物为5’-GGGAAGAAATCTGTGTGTTGGAA-3’,下游引物为:5’-TGTGTTGGAAAATCCAAGTCA-3’,β-actin作为内参。qRT-PCR的结果分析采用 2-ΔΔCt计算方法。
1.2.3 采用 MTT法分析 miR-26a对 ACC-M 细胞增殖的影响 将(3-5)×103个ACC-M细胞接种于96孔板,根据LipofectamineTM2000操作说明分别转染Neg-miR和pre-miR-26a,4-6 h更换培养基,37℃孵育,分别于24 h、48 h和72 h对各孔加入20 μl MTT(5 mg/ml)孵育4 h后弃掉上清,加入150 μl DMSO检测各孔的OD值,各组设3个复孔。
1.2.4 双荧光素酶报告基因检测miR-26a与EZH2的靶向关系 将对数期ACC-M细胞以每孔(3-5)×103个种于96孔板中,将其分为四组Neg-miR+EZH2-WT,Neg-miR+EZH2-MT,pre-miR-126+EZH2-WT,pre-miR-126+EZH2-MT。37℃孵育24 h后弃掉上清,根据Promega公司双荧光素酶基因检测试剂盒说明书向各孔内加入萤火虫和海肾荧光素酶试剂,检测各孔的荧光活性。
1.2.5 Western blot检测 miR-26a对 EZH2 蛋白水平的影响 将转染Neg-miR和pre-miR-26a质粒24 h后的ACC-M细胞胰酶消化离心,PBS洗2遍,按照RIPA裂解液说明书提取ACC-M总蛋白,并测定其浓度。采用10%的SDS-PAGE凝胶,蛋白上样量为20 μg,采用湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉封闭,EZH2(1∶1 000)4℃过夜孵育,二抗(1∶3 000)室温孵育1.5 h,TBST 洗膜10 min ×3次,Millipore蛋白液发光观察EZH2蛋白表达情况,β-actin作为内参蛋白。
1.2.6 统计学分析 采用SPSS 13.0统计软件进行数据处理。细胞实验重复3次,采用t检验进行数据分析,Iamge J分析蛋白表达量,P<0.05为差异有统计学意义。
2 结果
2.1 miR-26a与EZH2重组质粒构建成功
如图1A所示,将构建的pre-miR-26a重组质粒测序报告,通过NCBI BLAST进行比对后证实载体构建成功,并未见碱基突变或缺失。同时将构建的pre-miR-26a转染入ACC-M细胞,采用qRT-PCR方法发现转染pre-miR-26a的ACC-M细胞中miR-26a的表达要显著高于未转染细胞(P<0.001,图1B),提示构建的pre-miR-26a具有较高的转染效率,可用于后续试验。此外,对pmirGLO-EZH2-WT和pmir-GLO-EZH2-MT重组质粒也进行BLAST序列比对,无碱基缺失或突变,均构建成功(图1C、D)。

图1 miR-26a与EZH2重组质粒的表达及测序结果Figure 1 The expression of recombinant plasmids of miR-26 and EZH2 and sequencing results
2.2 miR-26a抑制ACC-M细胞的增殖活性
采用MTT方法分别检测转染Neg-miR和premiR-26a的ACC-M细胞在24 h、48 h和72 h后的OD值。转染pre-miR-26a的ACC-M细胞在48 h(P=0.015)和72 h(P <0.001)的增殖活性要显著低于转染空质粒组(见图2)。提示miR-26a能够显著抑制ACC-M细胞的增殖活性。
2.3 miR-26a靶向调控EZH2的表达
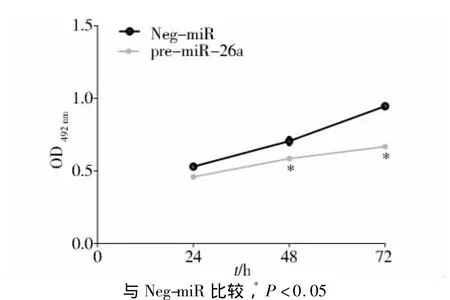
图2 miR-26a对ACC-M细胞增殖活性的影响Figure 2 The effect of miR-26a on proliferation of ACC-M cells
采用生物信息学的方法,在Targetscan网站提示miR-26a与EZH2之间存在良好的碱基互补靶向关系,同时在此基础上对互补的种子区进行突变,设计EZH2的突变型载体(图3A)。将pre-miR-26a分别与EZH2-WT和EZH2-MT载体共转染ACC-M细胞,双荧光素酶报告基因检测结果显示共转染premiR-26a+EZH2-WT的ACC-M细胞其荧光活性显著降低(P=0.001,图3B)。此外,采用qRT-PCR和Western blot的方法分别检测了转染 Neg-miR和pre-miR-26a的ACC-M细胞中EZH2的mRNA和蛋白水平,转染pre-miR-26a的ACC-M细胞其EZH2的mRNA水平(P=0.001,图3 C)和蛋白表达显著低于对照组(P=0.006,图 3D)。

图3 miR-26a与EZH2的靶向关系Figure 3 The target relationship between miR-26 and EZH2
3 讨论
目前已经证实多种肿瘤相关基因的异常表达可引起涎腺腺样囊性癌(SACC)的发生,并且与预后密切相关。正如Brazão-Silva等学者[7]发现金属硫蛋白在转移性SACC患者的表达显著高于非转移者,该基因的高表达与患者的恶化程度和不良预后密切相关。另外在SACC中发现跨膜丝氨酸蛋白酶4(TMPRSS4)的高表达与患者的TNM分期、淋巴结转移及远处转移均有关,并且可以作为整体生存率和无病生存率的独立预后指标[8]。近年来越来越多的研究发现miRNAs的异常表达也与SACC的发生发展有关。miR-181a能够通过直接靶向MAPKSnai2抑制SACC细胞的迁移、侵袭和增殖,并且体内实验进一步发现miR-181a除抑制肿瘤生长外,还能抑制 SACC细胞的肺转移[2]。然而目前有关miRNAs在SACC中的研究仍然很少。
miR-26a作为抑癌基因在多种人类肿瘤中呈低表达状态,目前有关miR-26a在肿瘤发生过程中的作用机制研究主要是采用构建miR-26a过表达载体实现的。过表达的 miR-26a可以通过直接靶向Lin28B、Zcchc11或FGF9抑制不同肿瘤细胞的生长及转移,并且通过对临床标本的检测可以发现miR-26a表达下调与患者临床分期、淋巴结转移和不良预后密切相关[5,9]。SACC 以往的机制性研究多集中在肿瘤细胞的侵袭、转移方面,而对其增殖方面的研究甚少,尤其是miR-26a目前在SACC中尚未见相关报道。本研究成功构建了miR-26a过表达载体,将其转染入ACC-M细胞后,MTT分析显示miR-26a的过表达可以显著抑制ACC-M细胞的增殖活性,但是在调控过程涉及哪些相关蛋白的表达尚不确定。
本研究采用生物信息学的方法预测出miR-26a的候选靶基因EZH2(enhancer of Zeste homolog 2),EZH2属于PcG(Polycomb group)家族成员之一,在多种肿瘤中呈高表达,可以促进肿瘤细胞的增殖及瘤细胞的转化[10,11]。EZH2既可以通过抑制 TIMP-3(metalloproteinase-3)的表达抑制非小细胞肺癌细胞的迁移[12],还可以通过下调p16和p27的表达促进胆管癌细胞的周期进展,并抑制凋亡的发生[13]。然而,目前为止有关EZH2在SACC中的相关机制研究尚未见相关报道。本研究成功构建了EZH2野生型和突变型真核表达载体,并将其与pre-miR-26a和空载体共转染ACC-M细胞后发现共转染premiR-26a和EZH2-WT的ACC-M细胞其荧光活性检测显著下降。在此基础上采用qRT-PCR和Western blot方法进一步验证了miR-26a能够在mRNA和蛋白水平下调EZH2的表达,从而提示miR-26a的过表达在ACC-M细胞中可以通过靶向降解EZH2的mRNA水平引起蛋白表达的下降,从而抑制ACC-M细胞的增殖活性。
综上所述,本研究已成功构建了miR-26a和EZH2相应真核表达载体,并采用qRT-PCR验证了pre-miR-26a在ACC-M细胞中具有较高的转染效率,MTT分析提示miR-26a过表达能够显著抑制ACC-M细胞的增殖活性,同时双荧光素酶报告基因检测、qRT-PCR和Western blot进一步证实了miR-26a可以降解EZH2的mRNA水平从而下调EZH2的蛋白表达,提示二者之间存在良好的靶向关系。
[1]Tincani AJ,Del Negro A,Araújo PP,et al.Management of salivary gland adenoid cystic carcinoma:Institutional experience of a case series[J].Sao Paulo Med J,2006,124(1):26-30.
[2]He Q,Zhou X,Li S,et al.Microrna-181a suppresses salivary adenoid cystic carcinoma metastasis by targeting mapk-snai2 pathway[J].Biochim Biophys Acta,2013,1830(11):5258-5266.
[3]Chen D,Zhang B,Kang J,et al.Expression and clinical significance of fak,ilk,and pten in salivary adenoid cystic carcinoma[J].Acta Otolaryngol,2013,133(2):203-208.
[4]Calin GA,Sevignani C,Dumitru CD,et al.Human microrna genes are frequently located at fragile sites and genomic regions involved in cancers[J].Proc Natl Acad Sci U S A,2004,101(9):2999-3004.
[5]Deng M,Tang HL,Lu XH,et al.miR-26a suppresses tumor growth and metastasis by targeting fgf9 in gastric cancer[J].PloS One,2013,8(8):e72662.
[6]Lin Y,Chen H,Hu Z,et al.miR-26a inhibits proliferation and motility in bladder cancer by targeting hmga1[J].FEBS Lett,2013,587(15):2467-2473.
[7]Brazёo-Silva MT,Cardoso SV,de Faria PR,et al.Adenoid cystic carcinoma of the salivary gland:A clinicopathological study of 49 cases and of metallothionein expression with regard to tumour behaviour[J].Histopathology,2013,6(6):802-809.
[8]Dai W,Zhou Q,Xu Z,et al.Expression of tmprss4 in patients with salivary adenoid cystic carcinoma:Correlation with clinicopathological features and prognosis[J].Med Oncol,2013,30(4):1-7.
[9]Fu X,Meng Z,Liang W,et al.miR-26a enhances mirna biogenesis by targeting lin28b and zcchc11 to suppress tumor growth and metastasis[J].Oncogene,2013:Epub ahead of print.
[10]Varambally S,Dhanasekaran SM,Zhou M,et al.The polycomb group protein ezh2 is involved in progression of prostate cancer[J].Nature,2002,419(6907):624-629.
[11]Richter GH,Plehm S,Fasan A,et al.Ezh2 is a mediator of ews/fli1 driven tumor growth and metastasis blocking endothelial and neuro-ectodermal differentiation[J].Proc Natl Acad Sci U S A,2009,106(13):5324-5329.
[12]Xu C,Hou Z,Zhan P,et al.Ezh2 regulates cancer cell migration through repressing timp-3 in non-small cell lung cancer[J].Med Oncol,2013,30(4):1-8.
[13]Nakagawa S,Okabe H,Sakamoto Y,et al.Enhancer of zeste homolog 2(ezh2)promotes progression of cholangiocarcinoma cells by regulating cell cycle and apoptosis[J].Ann Surg Oncol,2013:20:S667-S675.
