白癜风皮肤组织角质形成细胞释放警报素分子的研究*
2014-12-16西安交通大学医学院第一附属医院西安710061牟宽厚
西安交通大学医学院第一附属医院(西安710061) 牟宽厚 李 盼
白癜风是一种常见的原发性、获得性皮肤色素脱失性皮肤、粘膜疾病,以大小不等、数目不定的色素完全脱失斑为典型皮损[1]。目前认为其发病是多基因遗传、在多种内外因子的激发下表现为免疫功能紊乱,导致表皮黑素细胞破坏,终至色素脱失[2-4]。目前关于白癜风的研究多集中在黑素细胞上。作为构成皮肤重要组成细胞,角质形成细胞能够分泌多种细胞因子(IL-1、TNF-α、IL-6、bFGF、ET-1等)从而影响黑素细胞增殖分化。因此角质形成细胞在白癜风的研究上也越来越受关注。高迁移率蛋白B1(HMGB1)是一种核内蛋白,其组成性表达于各种组织细胞的胞核内,具有多种重要的核内功能[5-7]。外源性的HMGB1还能促进人永生化有质形成细胞(HaCaT)增殖。但是HaCaT如何释放HMGB1尚不清楚。本研究重点讨论角质形成细胞如何释放内源性的HMGB1并阐明HMGB1在白癜风发病中的可能作用及机制。
材料与方法
1 材 料 ①病例资料:10例患者均来自于我科门诊近半年来诊治的非节段型白癜风患者,均为男性,年龄35~40岁。且近两周未用过免疫调节剂等药物。活检皮肤组织取自病人的腰腹部,直径为5mm。7例对照组皮肤组织取自包皮环切术的正常健康人。②主要试剂:HaCaT细胞系本室常规保存。兔抗人HMGB1抗体购自Abcam公司,Alexa-488标记的羊抗兔荧光二抗购自Invitrogen公司,兔抗人cleaved caspase3抗体购自 Cell signal公司。Amicon-Ultra-4 10K离心管购自Millipore公司。重组人TNF-α、IFN-γ购自Peprotech公司。
2 方 法 ①细胞培养:HaCaT使用含10%胎牛血清的RPMI1640培养液,37℃,5%CO2孵育培养,隔天传代。②Western-blot检测 HMGB1释放:HaCaT细胞(3×106)提前接种于6cm细胞培养皿中,分别使用以下处理方法:TNF-α(20ng/ml)和IFN-γ(40ng/ml)刺激24h;UV照射1min;4μmol/L的喜树碱处理24h;反复冻融细胞3次诱导坏死。将上清收集后,使用 Amicon-Ultra-4 10K 离心管浓缩上清培养液,使用等体积的上清浓缩液进行聚丙烯酰胺凝胶电泳。经过转膜、5%脱脂牛奶封闭2h后,兔抗人HMGB1(1∶1000)抗体孵育过夜,辣根过氧化物酶标记的山羊抗兔IgG(1∶5000)室温孵育1h。使用化学发光法,经化学发光仪检测结果。③免疫荧光染色法检测白癜风皮肤组织的HMGB1和半胱氨酸蛋白酶3(cleaved caspase-3)表达:将白癜风病人的活检皮肤组织和对照组包皮环切术的包皮组织4%多聚甲醛固定24h后、20%和30%的蔗糖脱水后,4%多聚甲醛后固定24h。OTC包埋组织,制作10μm的冰冻切片,-80℃低温冰箱保存备用。免疫染色时,使用0.2%的TritonX-100处理10min;漂洗后,10%的山羊血清室温封闭1h;加入兔抗人的HMGB1抗体(1∶100)或者兔抗人的cleaved caspase-3抗体(1∶400)置于湿盒中4℃过夜;Alexa488标记的山羊抗兔IgG(1∶200)避光置于室温孵育1h;4',6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染色液处理15min;50%甘油封片;共聚焦显微镜观察荧光染色结果。
结 果
1 损伤的HaCaT细胞可以释放HMGB1 HaCaT细胞经过不同处理后,上清中蛋白经过浓缩后经检测均表达HMGB1,在25kD处有明显条带。如图1,凋亡诱导剂喜树碱诱导细胞凋亡能检测到HMGB1(泳道3);紫外线照射(泳道4)、TNF-α和IFN-γ细胞因子刺激(泳道5)、细胞反复冻融(泳道6)皆能诱导凋亡。未处理的培养上清(泳道1)和HaCaT全细胞裂解液(泳道2)作为阴性对照和阳性对照。

图1 Western-blot检测HaCaT经处理后HMGB1的表达
2 HMGB1在白癜风组织中由细胞核内转移至细胞浆释放 白癜风皮肤组织及对照皮肤组织经过荧光染色,置于激光共聚焦扫描显微镜下观察HMGB1的表达。如图2所示:绿色为HMGB1,蓝色为细胞核。在正常包皮皮肤中,HMGB1表达在表皮层的角质形成细胞核内,与蓝色的细胞核共定位。在白癜风皮损区的皮肤中,HMGB1由细胞核转移至细胞浆中,部分HMGB1有可能释放至细胞外。
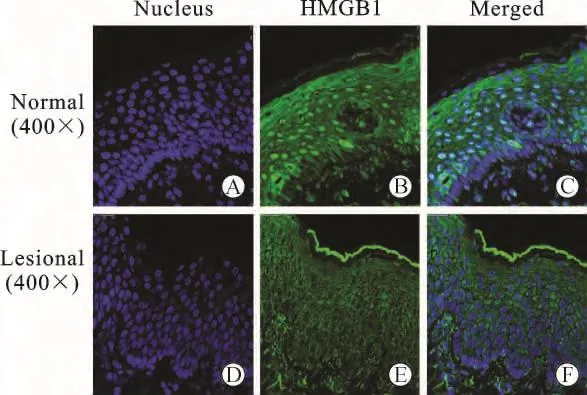
图2 免疫荧光检测HMGB1在正常皮肤和白癜风皮肤中的表达(×400)
3 白癜风皮肤组织中角质形成细胞趋向于凋亡为了证明在白癜风组织中HMGB1由趋向于凋亡的角质形成细胞释放,我们对于正常皮肤组织和白癜风皮肤组织进行免疫荧光染色,如图3所示:绿色为cleaved caspase-3,蓝色为细胞核。在正常的皮肤中,cleaved caspase-3几乎没有表达;而在白癜风皮损区皮肤角质层,有明显的cleaved caspase-3表达。

图3 免疫荧光检测cleaved caspase-3在正常皮肤和白癜风皮肤中的表达(×400)
讨 论
尽管白癜风的发病机制尚未完全阐明,但现在越来越多的研究表明白癜风是一种自身免疫病,与免疫相关分子有着重要的联系[3]。HMGB1作为一种核蛋白,它在受到炎症刺激时能够释放至胞外,它的胞外功能越来越受到重视。角质形成细胞也不单单被认为是一种组成角质层的细胞,多种Toll样受体,例如TLR2,TLR4等在角质形成细胞表面均有表达[8],甚至有些文献认为角质形成细胞是一种特殊的抗原提呈细胞(APC)[9]。本文着重研究角质形成细胞如何释放HMGB1。HMGB1一般由凋亡的细胞或者坏死的细胞被动释放或者在受到炎症刺激时主动分泌。在本研究中,我们使用药物凋亡诱导剂、紫外线照射、细胞因子刺激、反复冻融等诱导凋亡和坏死,我们发现HaCaT可以释放HMGB1。已经有文献报道HaCaT内源性表达HMGB1,外源性的HMGB1能够影响HaCaT的增殖等生物学作用[10],但是这篇文献忽视了HMGB1的释放。恰恰是胞外的HMGB1起着重要的作用。作为警报素分子(alarmin),HMGB1在机体受到损伤时能够释放,很有可能结合角质形成细胞表面的Toll样受体,释放IL-1和IL-6等细胞因子,介导白癜风的发生和发展。
为了证明HMGB1在白癜风中的作用,我们检测了白癜风组织中HMGB1的表达。实验结果表明在白癜风的组织中,HMGB1可以由细胞核转移至细胞浆,可以推断的是,部分HMGB1已经释放到了胞外发挥作用。在白癜风的组织中,我们检测到了代表凋亡的cleaved caspase-3,也证明了在白癜风中,HMGB1是由凋亡的角质形成细胞释放的。
综上所述,我们在体外证明了角质形成细胞能够在凋亡或者坏死的情况下释放HMGB1;在白癜风组织中,角质形成细胞是趋于凋亡的,能够释放HMGB1。接下来的研究将着重阐明在白癜风中HMGB1如 何 通 过 HMGB1-TLR 或 者 HMGB1-RAGE通路发挥作用。
[1] Abu Tahir M,Pramod K,Ansari SH,et al.Current remedies for vitiligo[J].Autoimmu Rev,2010,9(7):516.
[2] Spritz RA.Recent progress in the genetics of generalized vitiligo[J].J Genet Genomics,2011,38(7):271.
[3] Sandoval-CruzM,Garcia-Carrasco M,Sanchez-Porras R,et al.Immunopathogenesis of vitiligo[J].Autoimmu Rev,2011,10(12):762.
[4] Birlea SA,Gowan K,Fain PR,et al.Genome-wide association study of generalized vitiligo in an isolated European founder population identifies SMOC2,in close proximity to IDDM8[J].J Invest Dermatol,2010,130(3):798.
[5] Andersson U,Tracey KJ.HMGB1is a therapeutic target for sterile inflammation and infection[J].Annu Rev Immunol,2011,29:139.
[6] Sadava D,Ahn J,Zhan M,et al.Effects of four Chinese herbal extracts on drug-sensitive and multidrug-resistant small-cell lung carcinoma cells[J].Cancer Chemoth Pharm,2002,49(4):261.
[7] Sims GP,Rowe DC,Rietdijk ST,et al.HMGB1and RAGE in inflammation and cancer[J].Annu Rev Immunol,2010,28:367.
[8] Orentas RJ,Kohler ME,Johnson BD.Suppression of anti-cancer immunity by regulatory T cells:back to the future[J].Semin Cancer Biol,2006,16(2):137.
[9] Lee AY.Role of keratinocytes in the development of vitiligo[J].Ann Dermatol,2012,24(2):115.
[10] Ranzato E,Patrone M,Pedrazzi M,et al.HMGb1promotes scratch wound closure of HaCaT keratinocytes via ERK1/2activation[J].Mol Cel Biochem,2009,332(1-2):199.
