人参脂溶性成分提取工艺优化及其GCMS分析
2014-12-16刘婷婷刘鸿铖樊红秀王大为
刘婷婷,刘鸿铖,樊红秀,王大为
(吉林农业大学食品科学与工程学院,吉林长春130118)
人参(Panax ginseng C.A.Mey)是五加科多年生草本植物,具有大补元气、补脾益肺、复脉固脱、生津安神等功效[1-3]。人参脂溶性成分包括脂肪酸及酯类、甾醇类、聚乙炔醇化合物及挥发油等,据有关文献报道[4],人参脂溶性成分具有消炎、镇咳、降压、抗疲劳、抗肿瘤、降低胆固醇含量以及兴奋中枢神经的作用。人参脂溶性成分的传统提取方法主要有水蒸气蒸馏法和有机溶剂浸取法[5],但水蒸气蒸馏法加热温度高,提取时间长,所得产品的成分往往会发生变化,也可能变味[6];而有机溶剂浸取法往往会带来严重的溶剂残留问题[7]。超临界流体萃取技术(Supercritical Fluid Extraction,SFE)是近年来迅速发展的一种新型绿色分离技术,在功能性油脂的开发利用上已成为热点领域之一[8]。目前利用超临界CO2萃取人参脂溶性成分的相关报道较少,因此,本研究以5年人工种植人参为原料,应用超临界CO2萃取技术提取人参中的脂溶性组分,采用单因素实验考察超临界萃取压力、萃取温度、萃取时间以及夹带剂用量对脂溶性成分萃取率的影响,并通过正交实验对萃取工艺条件进行优化。将萃取物甲酯化后,采用GC-MS对其化学成分进行分析与鉴定,为人参脂溶性成分的开发利用提供了科学依据。
1 材料与方法
1.1 材料与仪器
人参 吉林省白山市抚松县露水河镇5年人工种植参,粉碎后过0.84mm(20目)孔径筛备用;二氧化碳(CO2含量为99.9%,食品级) 长春氧气厂;正己烷(色谱纯) 天津市福晨化学试剂厂;无水乙醇、氢氧化钾、甲醇、无水硫酸钠均为分析纯 北京化工厂。
HA121-50-02超临界萃取装置 江苏南通华安超临界萃取有限公司;GCMS-QP2010气相色谱质谱仪(配有GC-MS Real Time Analysis工作站,NIST107美国标准数据库) 日本岛津公司;FZ102型微型植物粉碎机 天津市泰斯特仪器有限公司;GB1302电子精密天平 梅特勒-托利多仪器(上海)有限公司;101A-2E电热鼓风干燥箱 上海实验仪器厂有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 超临界CO2萃取人参脂溶性成分单因素实验考察 称取100g过0.84mm(20目)孔径筛的干燥人参粉投入萃取罐中,设定分离釜I和分离釜II的压力为6MPa,温度为35℃,控制CO2流量为12L/h,无水乙醇从夹带剂罐中加入,进行动态萃取。萃取到设定时间后,从分离釜I和分离釜II收集萃取物。萃取物经真空旋转蒸发除去乙醇后,得到棕红色具有特殊香味的油状物,将油状物转移到平皿中,置于干燥器内,用无水硫酸钠脱水,备用。根据式(1)计算人参脂溶性成分萃取率。
萃取率(%)=(原料的脂肪含量-萃余物的脂肪含量)/原料的脂肪含量×100 式(1)
设定萃取压力25MPa、萃取温度40℃、萃取时间3h、原料/夹带剂(g/mL)为1∶0.6,单因素实验为固定其他因素,研究某因素对人参脂溶性成分萃取率的影响,各因素水平为:萃取压力分别为15、20、25、30MPa;萃取温度分别为35、40、45、50℃;萃取时间分别为 2.0、2.5、3.0、3.5、4.0h;原料/夹带剂(g/mL)分别选择 1∶0.2、1∶0.4、1∶0.6、1∶0.8、1∶1。
1.2.2 超临界CO2萃取条件的正交优化 根据单因素实验的结果进行正交优化实验,每次装料100g,选择萃取压力(MPa)、萃取温度(℃)、萃取时间(h)和原料/夹带剂(g/mL)为考察因素,以人参脂溶性成分萃取率为考察指标,进行四因素三水平正交实验,确定超临界CO2萃取的最佳工艺条件,实验的各因素水平见表1。

表1 正交实验因素与水平表Table 1 Factors and levels of orthogonal design test
每组实验在相同的条件下平行3次,以降低实验操作过程所产生的误差,数据均以“平均值±标准差”表示,利用SPSS 16.0方差分析对组间和组内差异进行比较,p<0.05时为差异显著,p<0.01时为差异极显著。
1.2.3 萃取物中人参脂溶性成分的GC-MS分析
1.2.3.1 样品甲酯化 称取人参脂溶性成分50mg,置于试管中,加入5mL正己烷,混合使之溶解,再加入0.8mol/L氢氧化钾-甲醇溶液2mL,混匀,于30℃恒温水浴15min,取出静置后分层,加入无水硫酸钠脱水后,取上层正己烷相进行GC-MS分析。
1.2.3.2 GC-MS分析条件 色谱条件:色谱柱:HP-5ms石英毛细管柱(30m ×0.25mm ×0.25μm);进样口温度:250℃;升温程序:从80℃开始,先以10℃/min升至200℃,然后以1℃/min升至220℃,再以8℃/min升至280℃,维持3min;载气为高纯度氦气,流速为1mL/min;进样方式为分流进样,分流比50∶1,进样量1μL。
质谱条件:电子轰击(EI)离子源;电子能量70eV;接口温度250℃;离子源温度230℃;四级杆温度150℃;溶剂延时4min;倍增器电压1300V;质量扫描范围 m/z 40~600。
2 结果与分析
2.1 超临界CO2萃取人参脂溶性成分单因素实验
2.1.1 萃取压力的影响 通过单因素方差分析,可知萃取压力对人参脂溶性成分萃取率的影响达到极显著水平(p<0.01),说明萃取压力是影响萃取的一个重要因素。由图1可以看出,在萃取压力为15~25MPa范围内,随着萃取压力的升高,萃取率显著提高(p<0.01)。这是由于萃取压力增大不但会增加超临界CO2的密度,还会减少分子间的传质距离,增加溶质和溶剂的传质效率[9];但当萃取压力由25MPa升到30MPa时,萃取率提高不显著(p>0.05),这是因为高压下CO2密度增大,粘度也较大,传质性能变差[10],而且过高的萃取压力对设备的使用寿命不利[11]。综合考虑,最佳萃取压力选用25MPa。
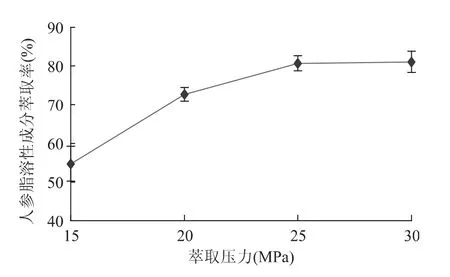
图1 萃取压力对人参脂溶性成分萃取率的影响Fig.1 Effect of extraction pressure on the yield of lipid-soluble components in Panax ginseng
2.1.2 萃取温度的影响 通过单因素方差分析可知,萃取温度对萃取率的影响达到极显著水平(p<0.01),说明萃取温度也是影响萃取的一个重要因素。由图2可以看出,萃取率先随温度升高而增加,40℃时达到最大,随后下降。温度对超临界CO2流体溶解能力影响比较复杂,一方面,温度的升高能提供克服萃取组分解离时动能势垒必需的热能,导致溶质的挥发度增大,扩散系数增大,对萃取有利;另一方面,温度的升高导致超临界CO2的密度降低,从而直接影响超临界CO2的溶解能力[12]。因此,最佳萃取温度选用40℃。

图2 萃取温度对人参脂溶性成分萃取率的影响Fig.2 Effect of extraction temperature on the yield of lipid-soluble components in Panax ginseng
2.1.3 萃取时间的影响 由图3可以看出,在最初阶段,萃取率随萃取时间的延长而显著增加;而当萃取时间超过3h时,萃取曲线上升幅度变小,几乎成为一条水平直线,此时继续延长萃取时间,也几乎无萃取物流出。这是由于萃取初始阶段,超临界CO2仅对物料颗粒表面的有效成分进行萃取,内扩散阻力较小,因此开始阶段萃取效率比较高;随着萃取时间的延长,超临界CO2扩散入固态物料内部进行萃取,内扩散阻力逐渐增大,降低了传质速率,故萃取效率逐渐降低[13],而且时间增加也会增加能耗,因此最佳萃取时间选择3h。
2.1.4 夹带剂用量的影响 通过预实验发现,不加夹带剂时,人参脂溶性成分的提取效果很差,加入乙醇可得到满意的效果。这是由于物料中脂溶性成分含量很低,极少的溶质被包埋在固体介质内部,增大了超临界流体的传质阻力,并且提取出的少量的脂溶性成分极易粘附在管道中和分离釜罐中,难以接出。加入夹带剂一方面可以提高超临界流体的溶解性能[14],另一方面可以将粘附在管道中的溶质携带入分离釜中,提高萃取率。
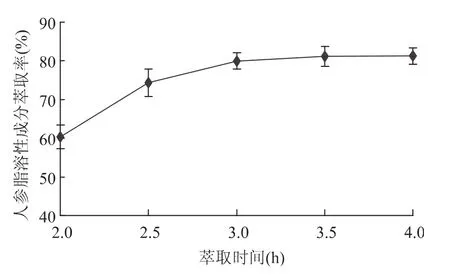
图3 萃取时间对人参脂溶性成分萃取率的影响Fig.3 Effect of extraction time on the yield of lipid-soluble components in Panax ginseng
由图4可以看出,当原料/夹带剂(g/mL)大于1∶0.6时,萃取率随夹带剂用量的增加而显著增加(p <0.01);而当原料/夹带剂(g/mL)小于1∶0.6时,萃取率随夹带剂用量的增加而变化不显著(p>0.05),因此,最佳的原料/夹带剂(g/mL)选用1∶0.6。
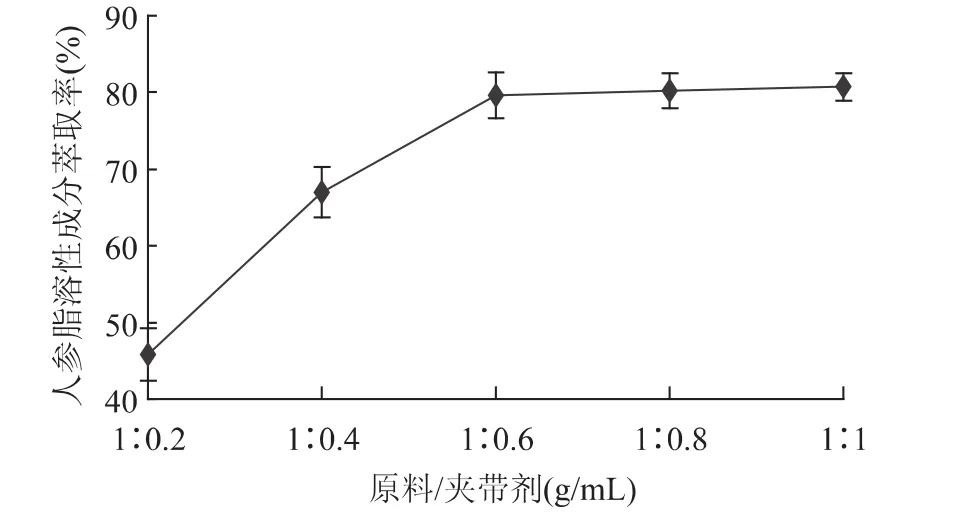
图4 料液比对人参脂溶性成分萃取率的影响Fig.4 Effect of the ratio of material to entrainer on the yield of lipid-soluble components in Panax ginseng
2.2 正交实验结果
正交实验结果如表2所示。根据表2中的R值可以看出,各因素对超临界CO2萃取人参脂溶性成分萃取率的影响程度依次为A>C>B>D,即萃取压力的影响最大,萃取时间次之,再次为萃取温度和原料/夹带剂(g/mL)。由表3的方差分析结果可知,萃取压力和萃取时间对萃取率的影响达到极显著水平(p<0.01),而萃取温度和原料/夹带剂(g/mL)对萃取率影响不显著(p>0.05),这一结果与极差分析结果一致。最优方案为A2B2C3D2,即萃取压力25MPa、萃取温度40℃、萃取时间3.5h、原料/夹带剂(g/mL)1∶0.6。在此优化工艺条件下进行3次验证实验,得到人参脂溶性成分的萃取率为85.38% ±3.16%,超过曹立军等[15]报道的超临界萃取法提取人参油的萃取率。
2.3 超临界CO2萃取人参脂溶性成分的GC-MS分析
采用GC-MS法对超临界萃取物进行分析,得其总离子流图见图5。经质谱数据库(NIST107)检索和人工谱图解析,鉴定出的超临界萃取物的化学成分见表4。

表2 L9(34)正交实验结果与极差分析Table 2 Result of L9(34)orthogonal experiment and range analysis
由表4可以看出,从萃取物中共鉴定出28种化合物。脂肪酸类鉴定出13种(82.39%),其中不饱和脂肪酸8种(68.64%);甾醇类成分鉴定出2种(2.89%);酯类成分2种(2.23%);倍半萜类化合物5种(1.39%);烯烃类成分2种(1.23%)。另外,还有二十八烷等烷烃类成分(0.37%),桉油烯醇等高级烯醇类成分(0.28%),己醛二乙缩醛等缩醛类化合物(0.17%)以及生育酚(0.43%)。萃取物中含量较高的成分为亚油酸(43.12%)、顺-6-十八碳烯酸(21.65%)、棕榈酸(11.86%)、5-烯-3-醇-豆甾醇油酸酯(2.02%)、豆甾醇(1.75%)和菜油甾醇(1.14%)。在所鉴定的成分中,己醛二乙缩醛、桉油烯醇、17-三十五碳烯、5-烯-3-醇-豆甾醇油酸酯和壬酸等5种化合物在前人相关研究文献中未见报道。
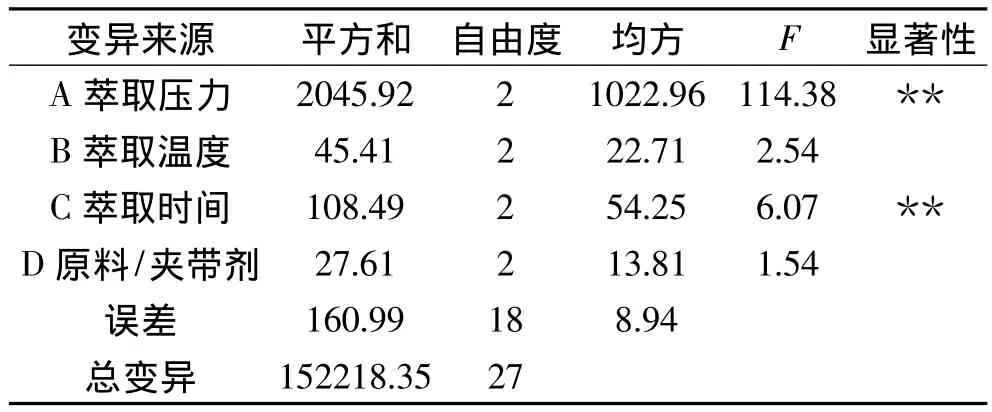
表3 正交实验方差分析结果Table 3 Result of analysis of variance for orthogonal design test

表4 SFE法萃取人参脂溶性成分的GC-MS分析Table 4 GC-MS analysis of the lipid-soluble components from Panax ginseng by SFE

图5 SFE法提取人参根脂溶性成分的总离子流图Fig.5 Total ion current chromatogram of the lipid-soluble components from Panax ginseng by SFE
魏建华等[16]采用超临界CO2萃取法萃取人参脂溶性成分,从中鉴定出44种化学成分,但不含有本研究鉴定出的β-丁香烯、白菖烯、α-古芸烯、γ-榄香烯、桉油烯醇、豆甾醇、菜油甾醇、角鲨烯、生育酚等生物活性成分。分析造成鉴定结果出现差异的原因,一方面可能与样品甲酯化前处理方式和计算机质谱图库的限制有关,另一方面可能与人参产地不同有关。
张秀丽[17]等采用乙醚回流法提取人参脂溶性成分,并鉴定出较高含量的醇类、脂肪酸及酯类成分,以及少量的醛类、烃类、萜类成分。Richter[18]、杨艳辉[19]等采用水蒸汽蒸馏法提取的人参脂溶性成分以萜烯及其含氧衍生物、烷烃、烯、醛、酮类为主[20]。本研究采用的超临界CO2萃取法由于具有强溶解能力和高选择性,能将一些高沸点、脂溶性成分一并提取出来,得到的人参脂溶性成分中富含不饱和脂肪酸、甾醇类化合物、酯类和倍半萜类,但未含有倍半萜烯类的含氧衍生物,这是由于超临界萃取过程完全密闭而且萃取温度较低,排除了一些化学成分遇氧氧化及见光反应的可能性。超临界CO2萃取法提取时间短、无溶剂污染,并且萃余物仍可作为提取皂苷、多糖以及膳食纤维的良好原料,因而超临界CO2萃取法是一种优异的提取方法,在人参脂溶性成分的工业化提取方面具有巨大的前景。
3 结论
通过单因素和正交实验对超临界CO2萃取人参中脂溶性成分工艺进行了优化,得到的最佳工艺参数为:萃取压力25MPa、萃取温度40℃、萃取时间3.5h、原料/夹带剂(g/mL)1∶06,此时人参脂溶性成分的萃取率为85.38% ±3.16%,与前人相关研究文献相比,本研究的提取率较高。
采用GC-MS对超临界CO2萃取法萃取的人参的脂溶性成分进行了分析鉴定,共鉴定了28种化合物,以脂肪酸、甾醇类、酯类、倍半萜类以及烯烃类物质为主。萃取的人参脂溶性成分中含有丰富的不饱和脂肪酸,具有较高的营养价值;其含有的植物甾醇、倍半萜类等化合物也是重要的生物活性物质,这些都表明超临界CO2萃取物具有一定的生物活性。
超临界CO2萃取法是一种公认的油脂类物质提取较为完全的方法,可实现萃取分离一体化,萃取过程短,提取系统密闭、提取温度低。此外超临界CO2萃取法具有收率高、无溶剂污染等优点,人参作为重要的食药用植物资源,此法对于人参脂溶性成分的工业化生产应用有较好的前景。
[1]Wang Y T,You J Y,Yu Y,et al.Analysis of ginsenosides in Panax ginseng in high pressure microwave-assisted extraction[J].Food Chemistry,2008,110:161-167.
[2]张崇喜.人参、西洋参和三七化学成分的研究[D].长春:吉林农业大学,2004.
[3]Wang Y,Jiang R Z,Li G R,et al.Structural and enhanced memory activity studies of extracts from Panax ginseng root[J].Food Chemistry,2010,119:969-973.
[4]孙艳.人参仿生化提取分离及初步药效学研究[D].长春:长春中医药大学,2011.
[5]魏爱书,赵锐.人参挥发油的研究进展[J].人参研究,2010(2):39-41.
[6]秦娇.毛竹叶挥发油的提取及抑菌作用的研究[D].北京:北京林业大学,2010.
[7]王世永.吴茱萸挥发油的提取分离、鉴定及抗氧化和抗菌活性研究[D].武汉:华中农业大学,2008.
[8]Uribe J A R,Perez J I N,Kauil H C,et al.Extraction of oil from chia seeds with supercritical CO2[J].The Journal of Supercritical Fluids,2011,56(2):174-178.
[9]周鸣谦,刘云鹤,林春梅.超临界CO2萃取黑莓籽油及其成分分析[J].食品科学,2012,33(8):39-42.
[10]韩志慧.山茱萸有效成分的提取及相关基础研究[D].郑州:郑州大学,2007.
[11]邓楚津,聂芳红.超临界CO2萃取剑麻中总皂苷的工艺研究[J].科学研究,2008,29(2):41-44.
[12]Sodeifian G,Ansari K.Optimization of Ferulago angulata oil extraction with supercritical carbon dioxide[J].The Journal of Supercritical Fluids,2011,57(1):38-43.
[13]程健,申文忠,刘以红.天然产物超临界CO2萃取[M].北京:中国石化出版社,2009:68-75.
[14]李红茹.超临界流体在中药雷公藤制剂中的应用及其溶解度的理论研究[D].天津:天津大学,2008.
[15]曹立军,徐涛,赵花,等.超临界CO2萃取人参挥发油工艺的研究[J].人参研究,2012(3):8-10.
[16]魏建华,徐涛,曹立军,等.超临界CO2萃取人参脂溶性成分的 GC—MS分析[J].人参研究,2012(4):19-22.
[17]张秀丽,赵岩,沈宏图,等.人参与西洋参脂溶性成分的GC-MS 分析[J].特产研究,2011(4):49-53.
[18]Richter R,Basar S,Koch A,et al.Three sesquiterpene hydrocarbonsfrom the rootsofPanax ginseng C.A.Meyer(Araliaceae)[J].Phytochemistry,2005,66:2708-2713.
[19]杨艳辉,杨兴斌,王燕,等.人参脂肪酸和挥发油成分的GC-MS分析[J].陕西师范大学学报:自然科学版,2007,35(1):77-81.
[20]王恩鹏.人参花挥发油的质谱研究[D].长春:长春中医药大学,2010.
