超滤分级研究乳清蛋白肽美拉德反应产物的抗氧化活性的影响
2014-12-16孙常雁李德海刘骞孔保华
孙常雁,李德海,刘骞,孔保华
(1.东北农业大学 a.食品学院,哈尔滨 150030;b.黑龙江省乳品工业技术开发中心,哈尔滨150028;2.东北林业大学 林学院,哈尔滨 150040)
0 引 言
美拉德反应能提高天然蛋白质、肽及氨基酸的乳化性[1]、溶解性[2]、热稳定性[3]、抗菌性[4]、抗癌性[5]、抗氧化活性[6]和抗过敏性[7]等。但由于MRPs分子组成很复杂,需要分级分离研究,目前多采用膜法进行分离。杨晓泉等[8]利用切向流超滤膜对大豆蛋白肽进行了分级分离并研究其功能性的变化;黄文凯[9]对大豆肽液超滤和纳滤脱盐的分离特性进行了系统的研究;Feng等[10]使用膜将酪蛋白-葡萄糖MRPs分成多个分子量范围并研究其抗氧活性的差异;徐献兵等[11]采用超滤膜分离技术研究不同分子量段MRPs的特性。
本研究利用不同分子截留量的超滤膜对WPPMRPs进行了分级分离,目的是分析其抗氧化活性随分子量分布的变化规律,为WPP-MRPs在功能食品和药品中的应用提供可行的依据。
1 实 验
1.1 试验原料、试剂与仪器
乳清蛋白,ABTS(2,2'-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐),抗坏血酸(Vc)、丁基羟基茴香醚(BHA)、邻苯二酚紫、硫酸亚铁、磷酸盐缓冲液(PBS)、无水乙醇。
紫外可见分光光度计TU-1800,高速万能粉碎机,R-205B旋转蒸发仪,超滤膜分离设备,电子天平,恒温水浴锅。
1.2 WPP-MRPs的制备
参照本实验室前期的实验结果[12],准确称取乳清蛋白配成质量分数为5%的乳清蛋白溶液、经95℃预热5 min,用1 mol/L的NaOH调节溶液pH值到8.5,加入碱性蛋白酶,酶与底物比为2∶100(即每100 g的乳清蛋白底物所需要的碱性蛋白酶的体积为2 mL),水浴55℃下振荡水解,反应过程中不断加入浓度为1 mol/L的NaOH,使pH值保持8.5,水解5 h,之后煮沸5 min灭酶活。
将水解后的乳清蛋白抗氧化肽,加入质量分数为8%的葡萄糖,在一定温度和磁力搅拌(40 r/min)下加热,反应一定时间后立即用冰水混合物迅速降温,终止反应,样品经1 000 g离心10 min,除去沉淀,上清液冻低温旋转蒸发浓缩、冷冻干燥为粉末备用。
1.3 不同分子量分布范围的WPP-MRPs的分级
利用中空纤维超滤膜将1.2中制备的WPP-MRPs混合物上清液进行超滤分级,使其先后通过截留分子量为5 ku及0.8 ku的的超滤膜进行截流分段,温度为20℃,压力为0.1 MPa, 得到I(分子量<0.8 ku)、II(0.8 ku<分子量<5 ku)、III (分子量>5 ku)3个不同分子量等级WPP-MRPs,然后低温旋转蒸发浓缩、冷冻干燥为粉末备用。
1.4 WPP-MRPs抗氧化活性测定
抗氧化能力包括总铁还原能力、ABTS自由基清除能力、羟基自由基清除、硫代巴比妥酸反应物质(Thiobarbituric acid-reactive substances,TBARS)、 对金属离子螯合能力。分别测定I、II、III部分WPPMRPs和不分段的WPP-MRPs混合物的抗氧化活性各项指标。
1.4.1 总还原能力测定
参照Kanokwan[13]的方法。分别取样品溶液0.5 mL(质量浓度为10,20,30,40,50,60,70 g/L),加入2.5 mL磷酸盐缓冲液(浓度为0.2 mol/L,pH值为6.6)和2.5 mL的质量分数为1%铁氰化钾溶液,混合均匀。再将混合物在50℃下水浴保持20 min后急速冷却,加入2.5 mL的10%的三氯乙酸溶液,然后将混合物在3 360 g下离心10 min。取2.5 mL上层清液,加入2.5 mL蒸馏水和0.5 mL质量分数0.1%的氯化铁溶液,混合均匀,放置10 min后,在700 nm处测定其吸光值。以Vc为对照,研究WPP-MRPs的还原能力。
1.4.2 ABTS自由基清除的测定
参照Ozgen[14]的方法并略有改动,分别将WPPMRPs配制成质量浓度为10,20,30,40,50,60,70 g/L的样品溶液。浓度为7.0 mmol/L的ABTS溶液与终浓度为2.45 mmol/L的过硫酸钾混合,室温避光放置12~16 h。用pH值为4.5的乙酸钠溶液(浓度为20 mmol/L)稀释至波长734 nm处的吸光度为0.7±0.02。取3 mL该溶液与20 μL样品液混合,放置6 min,于波长734 nm处测定吸光度,以Vc为对照,研究WPP-MRPs的清除ABTS自由基能力。按照下式计算ABTS自由基清除率为
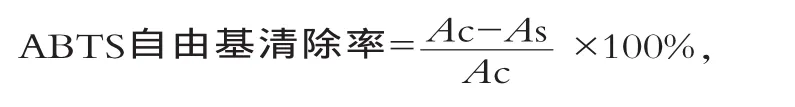
式中:Ac为对照的吸光度;As为样品的吸光度。
1.4.3 ·OH自由基清除能力的测定
参照Wang[15]的方法稍作改进,分别将WPP-MRPs配制成质量浓度为10,20,30,40,50,60,70 g/L的样品溶液。在试管中依次加入浓度为6 mmol/L的FeSO4溶液1 mL,浓度为6 mmol/L的H2O2溶液1mL和样品溶液1 mL,摇匀,静置10 min,再加入浓度为6 mmol/L的水杨酸溶液1 mL,摇匀,静置30 min后于510 nm波长处测其吸光度。以乙醇溶液代替待测液作空白对照,测定吸光度。以Vc为对照,研究WPP-MRPs的清除羟自由基能力。清除率为
·OH清除率=[1-(A1-A0)/A]×100%,
式中:A为空白对照的吸光度;A0为无水杨酸时加入样品液的吸光度;A1为加入样品液的吸光度。
1.4.4 对金属离子的螯合能力
参照Guo[16]的方法稍作修改进行研究。Cu2+的螯合:用邻苯二酚紫作为金属螯合指示剂。向1 mL浓度为2 mmol/L的CuSO4溶液、1mL质量分数为10%的吡啶与20 μL质量分数0.1%的邻苯二酚紫混合物中添加1 mL的乳清蛋白水解物,邻苯二酚紫与CuSO4结合形成蓝色物质,在有螯合剂存在时邻苯二酚紫与Cu2+离子分离,溶液蓝色消失。邻苯二酚紫溶液颜色的变化可以在632 nm处测得。
对于Fe2+的螯合:1 mL浓度为20 μmol/L的FeCl2与1 mL浓度为0.5 mmol/L的ferrozine混合后会产生一种物质,在562 nm处有强吸收。向其中添加0.5m L的乳清蛋白水解物,由于Fe2+被螯合,溶液颜色发生变化,在562 nm下读取吸光值。
螯合作用=[1-(样品溶液的吸光值/空白溶液的吸光值)]×100。
1.4.5 硫代巴比妥酸反应物质的测定
第一步:脂肪氧化体系(Liposome)的制备
卵磷脂脂质体氧化体系 (soybean phosphatidylcholine liposome),采用Decker和 Hultin[17]的方法并进行一些改进。将大豆卵磷脂(质量浓度0.2 g/L)溶解在浓度为0.12 mol/L的KCl溶液,浓度为5 mmol/L组氨酸缓冲溶液 (pH值为 6.8)均质后,在4°C进行超声波降解45 min。为测定样品的抗氧化活力,准备一系列5 mL脂质体和1 mL各种待测样品进行试验。阴性对照用1 mL水代替1 mL样品溶液与5 mL脂质混合,同时以质量分数为0.02%的BHA作为阳性对照。脂质氧化由铁的氧化还原反应引发,将0.1 mL浓度为50 mmol/L的FeCl3和0.1 mL浓度为10 mmol/L抗坏血酸盐加入脂质/蛋白溶液(6 mL)中。样品在37°C 水浴中保温1 h,并迅速通过测定硫代巴比妥酸反应物质 (TBARS)研究脂肪氧化情况。
第二步:硫代巴比妥酸反应物质的测定
TBARS的测定,参照Sinnhuber和Yu[18]的方法,并作适当的修改。取1 mL样品加入3 mL硫代巴比妥酸溶液、17 mL三氯乙酸-盐酸溶液,混匀后,沸水浴中反应30min,冷却,取5 mL样品加入等体积的氯仿,3000 r/min下离心10 min,532 nm下读取吸光值。TBARS值以每升脂质氧化样品溶液中丙二醛的毫克数表示。计算为
TBARS(mg/kg)=(A532/Vs)× 9.48,
式中A532为溶液的吸光值;Vs为样品的体积;9.48为常数。
1.5 统计分析
实验中测定结果重复测定3次,结果表示为平均数±SD。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序,采用sigmaplot9.0软件作图。
2 结果与讨论
2.1 WPP-MRPs总还原能力分析
测定总还原能力实质是基于氧化还原反应的比色法,非酶抗氧化剂可以看作还原剂,把氧化物质还原,从而起到抗氧化剂的作用。本试验以不同浓度的天然抗氧化剂Vc作为对照,评价WPP-MRPs混合物及不同分子量分布范围Ⅰ、Ⅱ、Ⅲ的总还原能力。
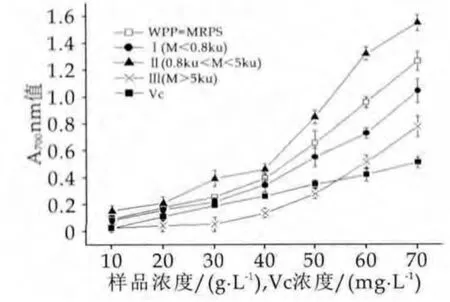
图1 WPP-MRPs的还原能力
由图1可以看出,WPP-MRPs、Ⅰ、Ⅱ、Ⅲ和Vc均随着质量浓度的增加,A700值增大,表明还原能力随之增大,而且还原能力与其浓度成量效关系。其中质量浓度在10~70 g/L之间,Ⅱ的还原能力显著高于相同质量浓度WPP-MRPs、Ⅰ、Ⅲ及Vc的还原能力(P<0.05),但是WPP-MRPs混合物的还原能力高于相同浓度Ⅰ、Ⅲ的还原能力,说明具有较好还原力的WPP-MRPs分子量分布在0.8~5 ku之间。当质量浓度为70 g/L时,Ⅱ的A700值为1.551±0.06,WPP-MRPs的A700值为1.26±0.07,分别相当于质量浓度为212.9 mg/L和173.2 mg/L Vc的还原力。结果表明,Ⅱ分子量分布在0.8~5 ku之间的WPP-MRPs具有较强的还原能力。
Ames 等[19]将MRPs分为两大类:一种是由2~4个含有多个共轭双键的环状物组成的中低分子量化合物,另一种是量具有发色基团的较高分子的褐色聚合物-类黑精。美拉德反应产物具有一定的还原能力,原因可能为反应过程产生了大量褐色素以及还原酮、吡咯酮、脱氧果糖嗪类等能够提供氢电子的物质[20],而氢电子具有还原性,可将Fe3+还原为Fe2+,Fe2+进一步发生Perl’s Prussian反应从而表现出还原能力[21]。Eichner等[22]发现MRPs中等分子量的还原酮类化合物可通过羟基提供电子破坏自由基链,表现出较好的还原性。
2.2 WPP-MRPs的ABTS自由基清除能力分析
以不同质量浓度的天然抗氧化剂Vc作为对照,不同分子量的WPP-MRPs的ABTS自由基清除能力。
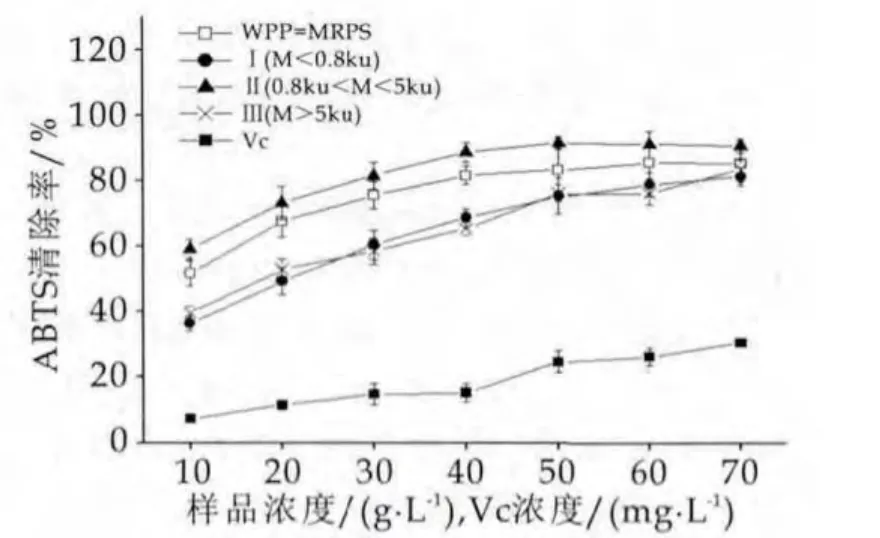
图2 WPP-MRPs的ABTS自由基清除能力
由图2可以看出,对比5种溶液,可以发现乳清蛋白肽美拉德反应物具有较好的清除ABTS自由基能力,可很清楚的看到分段之后,Ⅱ段分子量的美拉德产物清除ABTS自由基的能力略高于Ⅰ段、Ⅲ段和WPP-MRPs的混合物,尤其当Ⅱ段质量浓度为50 g/L时,清除率可达91.49%±3.04%,说明在0.8 ku<分子量<5ku的WPP-MRPs具有较强的自由基清除能力。
很多文献证明了美拉德反应产物具有清除ABTS自由基的能力。Hayase等人[23]研究表明木糖与蛋白的MRPs对ABTS自由基有很好的清除能力;Wagner等人[24]研究了以葡萄糖为模型MRPs也具有较强的ABTS自由基清除能力;另外Nienaber[25]发现抗氧化活性物质主要存在于无色的中低分子量MRPs中,此结论恰好与本试验结果一致。
2.3 羟基自由基清除能力分析
本研究以不同质量浓度的天然抗氧化剂Vc作为对照,评价不同分子量分布范围乳清蛋白肽美拉德反应产物羟基自由基清除能力。
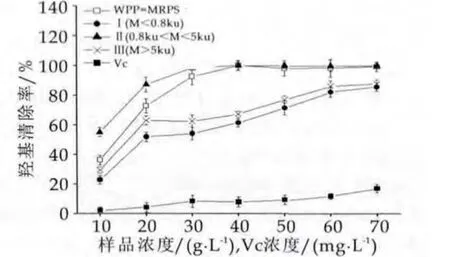
图3 WPP-MRPs的羟基自由基清除能力
由图3可以看出,当质量浓度在10~40 g/L之间时,WPP-MRPs对羟基自由基清除能力随着质量浓度的增加而快速增大(P<0.05),但是质量浓度在50~70 g/L范围内,WPP-MRPs对羟基自由基清除能力随着浓度的增幅减小,即增加不显著(P>0.05)。而质量浓度在10~70 mg/L范围内,Vc对羟基自由基清除能力随着浓度的增加而增大,具有量效关系。当质量浓度为40 g/L时Ⅱ段WPP-MRPs对羟基自由基清除能力99.36%±3.25%,相当于质量浓度为330.2 mg/L的Vc对羟基自由基清除能力。结果表明,WPP-MRPs具有较好的清除羟基自由基能力。
Lusani等[26]研究表明赖氨酸与果糖反应产物具有较强的羟自由基清除能力,羟自由基是活性极强的自由基,几乎可以与细胞内一切有机物反应,表现在使核酸断裂、多糖解聚和不饱和脂肪酸过氧化作用,导致遗传突变、膜损伤、酶失活、线粒体氧化磷酸化作用等一系列变化,进而损伤细胞的机构和功能。
2.4 金属离子螯合能力分析
许多过渡金属离子都能促进体内氧化的进行,它们可以催化超氧阴离子产生羟自由基,造成肌体的氧化衰老,而抗氧化剂可以通过螯合金属离子,间接阻止体内自由基的形成,从而达到抗氧化的目的。本试验选择了铜离子和亚铁离子两种金属离子来测定美拉德产物不同组分的抗氧化活性。
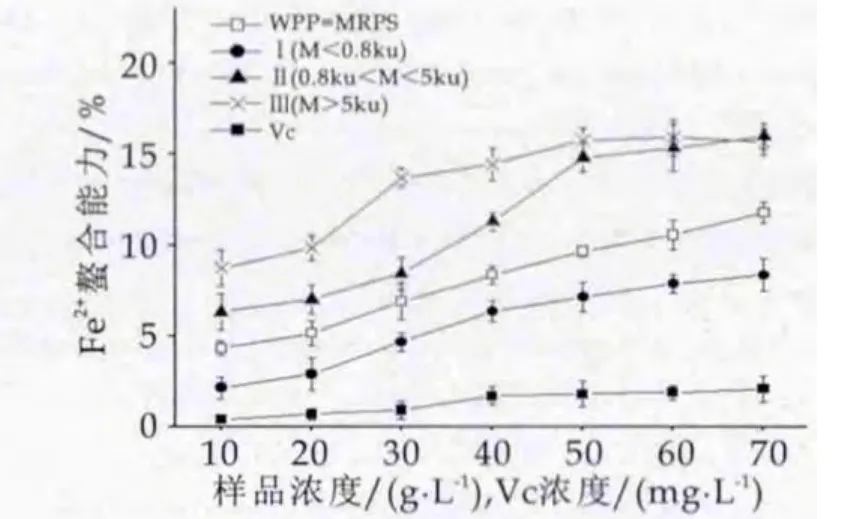
图4 WPP-MRPs亚铁离子螯合率
各组分亚铁离子螯合率如图4。由图4可以看出,随着WPP-MRPs质量浓度的增高,螯合亚铁的能力均略有升高;当质量浓度在10~60 g/L之间时,Ⅲ段的亚铁离子螯合率明显高于其他组分;在最大质量浓度70 g/L下,Ⅱ和Ⅲ段的亚铁离子螯合率达到最高15.65%±1.3%和15.97%±0.7%,二者差异不显著(P>0.05),可见大分子的WPP-MRPs对亚铁离子的螯合能力较强。
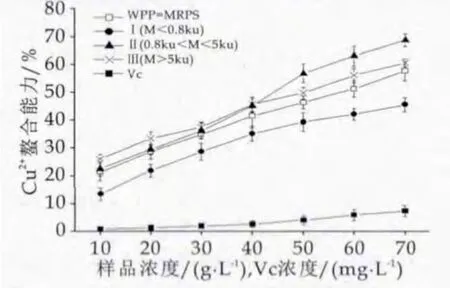
图5 WPP-MRPs铜离子(Cu2+)螯合率
对比图4和图5,可以看出WPP-MRPs对铜离子的螯合率明显高于亚铁离子,且两个图中的WPP-MRPs对金属螯合能力均明显高于Vc溶液,该项指标也反映了抗氧化活性的大小,如Jing等[27]提出糖-赖氨酸的MRPs表现抗氧化活性可能通过螯合金属离子。
螯合金属能力的差异可能是由于MRPs组分复杂多样,国内外也有相应的研究,Tan等[28]发现MRPs中具有较强的螯合能力的化合物为还原酮类,Hofmann[29]报道了金属离子螯合能力主要与MRPs中的大分子物质相关,Eiserich[30]认为杂环化合物也具有很强的螯合铁离子能力。本研究表明WPP-MRPs中抗氧化性较强的物质是Ⅱ、Ⅲ段即分子量M>0.8 ku段,原因可能为该分子量中含有较多还原酮结构和杂环化合物;并且分子量M<0.8 ku的肽段主要成分是小分子量的WPPMRPs及肽、氨基酸和葡萄糖,其螯合金属能力较差。
2.5 TBARS的分析
食品中的脂类非常容易氧化,发生此变化的原因也很复杂,原因可能是金属离子产生的促氧化作用,也有可能是某些自由基本身的促氧化作用,因此,WPP-MRPs的抑制脂质氧化可能二者兼而有之。以不同浓度的抗氧化剂BHA作为对照,WPP-MRPs对卵磷脂脂质氧化的抑制作用。
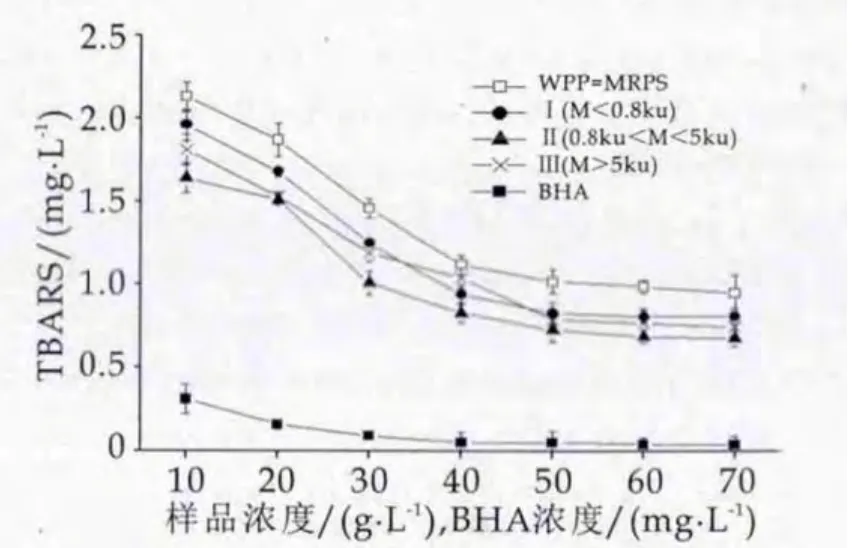
图6 WPP-MRPs的TBARS的抑制作用
由图6可以看出,各组分WPP-MRPs均有一定的对脂质抗氧化能力,随着质量浓度的增大,脂质抗氧化能力不断增加,但质量浓度超过50 g/L时,抗氧化能力趋于平缓。分子量为0.8 ku<分子量<5 ku反应物的抗氧化能略高与其他组分,在质量浓度为50 g/L时,WPP-MRPs、Ⅰ、Ⅱ和Ⅲ的TBARS值分别为1.02±0.09,0.83±0.07,0.73 ±0.07和(0.79±0.03)mg/L,差异不显著(P>0.05)。 Rao等[31]研究证实了壳聚糖、葡萄糖的美拉德产物具有一定的抑制脂肪氧化作用;目前肽类MRPs对脂质氧化的抑制研究较少,Miranda[32]研究了不同氨基酸美拉德反应产物的脂质抗氧化效果,结果为精氨酸-MRPs>缬氨酸-MRPs>组氨酸-MRPs。
本研究可以清晰的看出BHA具有较强的脂质抗氧化能力,其效果明显高于MRPs,但WPP-MRPs作为普通食品原料,具有一定的脂质抗氧化能力,还将有广阔的应用空间。
3 结 论
本研究表明经过中空纤维超滤膜分级的WPPMRPs均具有一定抗氧化活性,且随着质量浓度的增加其抗氧化能力也增强,其中Ⅱ的总还原力、ABTS自由基清除能力和羟基自由基清除能力在同等浓度条件下较Ⅰ和Ⅲ高,而金属螯合能力主要是分子量较大的Ⅲ表现出较好的螯合率,TBARS值为Ⅱ级具有一定的抑制脂肪氧化能力。本试验同时与Vc或BHA进行比较,通过增加WPP-MRPs浓度可以达到Vc或BHA的抗氧化效果,说明WPP-MRPs作为食品原料在抗氧化剂领域中应用具有广阔的开发前景。
[1]BEATRIZ M,ALEJANDRO S.The Occurrence of a Maillard-type Protein-polysaccharide Reaction between β-lactoglobulin and Chitosan[J].Food Chemistry,2007,100:1071-1075.
[2]LI C P,ENOMOTO H,OHKI S,et al.Improvement of Functional Properties of Whey Protein Isolate Through Glycation and Phosphory-lation by Dry Heating[J].Journal of Dairy Sci,2005,88:4137-4145.
[3]KITABATAKE N,CUQ J L,CHEFTEL J C.Covalent Binding of Glycosyl Residues to β-Lactoglobulin Effect on Solubility and Heat Stability[J].Agric Food Chem,1985,33:125-130.
[4]MIRALLES B,MARTINEZ-RODRIGUEZ A,SANTIAGO A,et al.The Occurrence of a Maillard-type Protein-Polysacchande Reaction between β-lactoglobulin and Chitosan[J].Food Chemistry,2007,100(3):1071-1075.
[5]HWANG I G,KIM H Y,LEE S H,et al.Isolation and Identification of an Antiproliferative Substance from Fructose-tyrosine Maillard Reaction Products[J].Food Chemistry,2012,130:547-551.
[6]KIM J S,LEE Y S.Antioxidant Activity of Maillard Reaction Products derived from aqueous Glucose/Glycine,Diglycine,and Triglycine model systems as a Function of Heating Time[J].Food Chemistry,2009,116(1):227-232.
[7]ENOMOTO H,HAYASHI Y,LIC P,et al.Glycation and Phosphorylation of α-lactalbumin by dry Heating:Effect on Protein Structure and Physiological Functions[J].Journal of Dairy Science,2009,92(7):3057-3068.
[8]杨晓泉,张新会,陈山,陈中,赵谋明.大豆肽的分级膜分离研究.华南理工大学学报(自然科学版),2003,31(5):16-20.
[9]黄文凯.膜分离方法制备免疫活性大豆肽的研究[D].无锡:江南大学粮食、油脂及植物蛋白工程系,2007.
[10]FENG L G,JIN M K,SHABBAR A,et al.Structure and Antioxidant Activity of high Molecular Weight Maillard Reaction Products from Casein-Glucose[J].Food Chemistry,2010,120:505-511.
[11]徐献兵,于淑娟.超滤分离美拉德反应产物的特性研究.现代食品科技,2010,26(12):1338-1340.
[12]PENG X Y,XIONG Y L,KONG B H.Antioxidant Activity of Peptide Fractions from Whey Protein Hydrolysates as measured by Electron Spin Resonance[J].Food Chemistry,2009,113:196-201.
[13]KANOKWAN M A,SOOTTAWAT B A,MUNEHIKO T.Effect of Reactant Concentrations on the Maillard Reaction in a Fructoseglycine model system and the Inhibi-tion of black Tiger Shrimp PolypHenoloxidase[J].Food Chemistry,2006,98:1-8.
[14]OZGEN M,REESE R N,TULIO A Z,et al.Modified 2,2-Azinobis-3-ethylbenzothiazoline-6-sulfonic Acid (ABTS)method to Measure Antioxidant Capacity of selected small Fruits and Comparison to Ferric Reducing Antioxidant Power(FRAP)and 2,2’-diphenyl-1-picrylhydrazyl(DPPH)Methods[J].Journal of Agriculture and Food Chemistry,2006,54(4):1151-1157.
[15]WANG H,GAO X D,ZHOU G C,et al.In Vitro and in Vivo Antioxidant Activity of Aqueous Extract from Choerospondias Axillaris Fruit[J].Food Chemistry,2008,106:888-895.
[16]GUO J T,LEE H L,CHIANG S H,et al.Antioxidant Properties of the Extracts from different parts of Broccoli in Taiwan.Journal of Food and Drug Analysis.2001,9(2):96-101.
[17]DECKER E A,HULITINH O.Factors influencing Catalysis of Lipid Oxidation by the Soluble Fraction of Mackerel Muscle[J].Journal of Food Science,1990,55:947-950,953.
[18]SINNHUBER R O,YU T C.2-Thiobarbituric Acid method for the Measurement of Rancidity in Fishery Prducts II.The quantitative determination of Malonaldehyde[J].Food Technology.1958.12:9-12
[19]AMES J M,NURSEN H E.Recent advances in the Chemistry of Coloured Compounds formed during the Maillard Reaction.Trends in Food Science.Singapore:Institute of Food Science and Technology,1989,8-14.
[20]DELGADO A C,RUFIAN H J,MORALES F J.Assessing the Antioxidant Activity of Melanoidins from Coffee Brews by Different Antioxidant Methods[J].Journal of Agricultural and Food Chemistry.2005,53(20):7832-7836.
[21]BENJAKIL S.Antioxidative Activity of Caramelisation Products and their Preventive Effect on Lipid Oxidation in Fish Mince[J].Food Chemistry.2005,90(1-2):231-239.
[22]EICHNER K.Antioxidant effect of Maillard Reaction Intermediates[J].Progress in Food&Nutrition Science,1980,5:441-451.
[23]HAYASE F,USUI T,WATANABE H.Chemistry and some Biological Effects of Model Melanoidins and Pigments as Maillard Intermediates[J].Molecular Nutrition and Food Research,2006,50(12):1171-1179.
[24]WAGNER K,DERKITS S,HERR M,et al.Antioxidative Potential of Melanoidins Isolated from a Roasted Glucose-Glycine model[J].Food Chemistry,2002,78:375-382.
[25]NIENABER U,EICHNER K.The Antioxidative Effect of Maillard Reaction Products in model Systems and Roasted Hazelnuts[J].Health&Environmental Research Online (HERO),1995,97(12):435-444.
[26]LUSANI N V,JESSY V W.Antioxidant Activity of Maillard Reaction Products(MRPs)derived from Fructose-Lysine and Ribose-Lysine Model Systems[J].Food Chemistry,2013,137:92-98.
[27]JING H,YAP M,WONG P Y,et al.Comparison of Physicochemical and Antioxidant Properties of Egg-white Proteins and Fructose and Inulin Maillard Reaction Products[J].Food and Bioprocess Technology,2009,1-8.
[28]TAN B K,HARRIS N D.Maillard Products inhibit Apple Polyphenoxidase[J].Food Chemistry.1995,53(3):267-273.
[29]HOFMANN T.Studies on Melanoidin-Type Colorants Generated from the Maillard Reaction of Protein-bound Lysine and Furan-2-carboxaldehyde-Chemical Characterisation of a red Coloured Domaine[J].Zeitschrift für Lebensmitteluntersuchung und-Forschung A.1998,206(4):251-258.
[30]EISERICH J P,SHIBAMOTO T.Antioxidative Activity of Volatile Heterocyclic Compounds[J].Journal of Agricultural and Food Chemistry.1994,42(5):1060-1063.
[31]RAO M S,CHAWLA S P,CHANDER R,et al.Antioxidant Potential of Maillard Reaction Products formed by Irradiation of Chitosan-Glucose solution.[J].Carbohydrate Polymers,2011,83:714-719.
[32]MIRANDA L T,RAKOVSKI C,Were L M.Effect of Maillard Reaction Products on Oxidation Products in Dround Chicken Breast[J].Meat Science,2012,90(2):352-360.
