乳酸菌发酵剂制备发酵乳的特性研究
2014-12-16侯保朝葛红娟赵建云徐显睿单胜艳李宝磊马广辉马一航李理李言郡
侯保朝,葛红娟,赵建云,徐显睿,单胜艳,李宝磊,马广辉,马一航,李理,李言郡
(1.杭州娃哈哈集团有限公司研究院生物工程研究所,杭州310018;2.东北农业大学食品学院乳品科学教育部重点实验室,哈尔滨150030)
0 引言
发酵乳的感官品质以及形成良好凝固组织状态的时间是筛选发酵剂的重要指标。优良的发酵剂菌株应具有适宜的产酸速率,以保证较短的发酵时间,同时不应有大量乳清的析出。此外,乳酸菌菌株能够产生一定量的黏性物质也是其作为发酵剂的重要因素。研究表明,一些乳酸菌菌株具有产胞外多糖的性质,该物质因其化学结构中含有大量亲水基团而具有良好的持水能力,能够增加发酵乳的黏性、爽滑度,对发酵乳形成稳定的乳化状态有积极作用[3]。除发酵剂菌株本身的发酵特性外,菌株间的复配比例也会显著影响发酵乳的品质,其中嗜热链球菌和保加利亚乳杆菌间的复配比例是研究的重点之一[4-6]。
目前,国内发酵乳制品所使用的发酵剂以购买国际通用型直投式发酵剂为主,这一点大大限制了产品的升级换代,因此研发具有自主知识产权的新型发酵剂对乳制品生产企业的长久发展具有重要意义。本研究在大量前期实验的基础上,对两种自主研发的发酵剂的复配比例进行探究,同时,从产酸性能、产香性能、流变性能和持水性能4个方面比较了采用自主研发发酵剂与国际标准发酵制备的发酵乳的优势和不足。本研究不仅为自主研发发酵剂的产业化提供了理论基础,同时也为其他乳酸菌发酵剂的开发研究提供了良好的借鉴和指导。
1 实验
1.1 菌株与培养基
实验菌株分别为两种自主筛选及保藏的乳酸菌ST-1、LB-1和一种购自A公司的国际标准直投式发酵剂D-1(对照菌株),以上菌粉均4℃保存。培养基(乳基)采用国际通用酸奶配料,其中非脂类固形物质量分数为8.2%~8.6%,乳脂肪质量分数为1.5%,蛋白质质量分数为2.9%~3%。
1.2 仪器与试剂
iCinac乳品发酵酸化监控仪(AMS SYSTEA),Anton Paar MCR302流变仪,Silverson L5T高速分散机,Eppendorf 5810R离心机,梅特勒MS603电子天平,Agilent气相色谱6890-质谱5975C联用仪,市售脱脂乳,分析纯氯化钠。
1.3 不同菌株复配比例发酵乳的制备
取适量乳基,巴氏杀菌(90~95℃,5~10 min),冷却至43℃。在前期实验基础上,ST-1与LB-1分别按1∶1和1∶3的比例进行复配后接种于灭菌乳基中,接种量为5×106mL-1,D-1对照菌株采用相同接种量,混匀后静置于43℃发酵。发酵过程中监测乳体系pH值变化情况。当发酵液表面有少量水痕,倾斜杯体时发酵液变黏稠,且pH值接近4.5时即可停止发酵。取出,冷却,放于4℃条件下后酸化12~24 h后,进行相关指标的测定。
1.4 指标测定
1.4.1 发酵过程乳体系pH值测定
自发酵起始开始,每隔20 min记录发酵乳体系的pH值,同一时间点pH值至少重复测定3次,测定结果取平均值,绘制变化曲线。
1.4.2 发酵乳风味物质测定[7]
1.4.2.1 发酵乳样品前处理(顶空-固相微萃取法)
取发酵乳样品10 g至顶空样品瓶中,加入3 g NaCl,磁力搅拌,样品瓶用聚乙烯/硅胶膜盖密封后45℃水浴30 min。待样品平衡一段时间后,用针头刺穿膜盖,使固相微萃取膜(50/30 μm DVB/CAR/PDMS纤维)暴露于顶空处30 min。萃取得到的样品解析3 min后,进行气相色谱-质谱(GC-MS)定性及定量分析。
1.4.2.2 GC-MS检测
样品和标准品均使用毛细管柱(30 m×250 μm×1.0 μm)分析,进样口温度为300℃,初始柱温为20℃,保持5 min后,以4℃/min的速度升温至200℃,维持10 min,流动相为氮气,流速为0.65 mL/min。定量方法采用标准曲线法,以峰面积定量。
1.4.3 发酵乳流变学特性测定
为科学评价自主研发发酵剂制备的发酵乳在黏度、质构、口感等方面的性状,对3种发酵乳进行流变学测试,其中包括振幅扫描测试和旋转测试扫描测试。取适量发酵乳置于烧杯中,玻璃棒瞬时方向搅动10圈,再逆时针方向搅动10圈,静置30~60 min后进行测试。检测环境温度为发酵乳入口温度10℃。振幅扫描条件为固定频率为1 Hz,应变扫描范围0.01%~500%。旋转扫描剪切速率范围为0.001~500 s-1,每次测定的时间间隔为10 s。
1.4.4 发酵乳持水力测定
准确称取4℃发酵乳样品10 g置于离心管中,4 000 rpm/min离心10 min,称重发酵乳上清(乳清),质量记为n。持水力=(m-n)/m×100%,其中m为发酵乳样品质量[8]。实验结果取3次重复测定的平均值。
2 结果与分析
2.1 不同菌株复配比例发酵乳在发酵过程中pH值的变化
采用3种不同发酵剂制备的发酵乳在发酵过程中pH值的变化情况如图1所示。由图1可以看出,3种发酵乳的pH值呈现出平台-迅速下降-缓慢下降的变化趋势,但采用D-1(国际标准发酵剂)制备的发酵乳和采用自主研发发酵剂制备的发酵乳的pH值变化在平台时期和迅速下降时期出现较明显的区别。D-1发酵乳,在发酵初期(0~80 min)产酸缓慢;进入100 min后,pH值迅速下降,且下降速率持续增加,说明该阶段菌体处于对数生长期,产酸量激增;当发酵接近240 min时,pH值下降变缓,产酸速率降低,说明此时发酵已进入平稳阶段。与之相比,自主研发的发酵剂(ST∶LB=1∶1为发酵剂Z-1,ST∶LB=1∶3为发酵剂Z-2)的产酸平台期较长,接近D-1发酵乳的2倍(0~160 min),而当发酵180 min后,两种发酵乳的pH值均开始迅速下降,最大下降速率可达到0.0175△pH/min,发酵300 min后,pH值下降明显变缓,此时pH值为4.94。发酵结束时,Z-1和Z-2发酵乳的终点pH值为4.5左右,D-1发酵乳的终点pH值为4.7左右,由此可知,虽然自主研发发酵剂在乳基中产酸延迟期较长,但达到发酵终点pH值至所用时间与国际标准发酵剂基本一致。
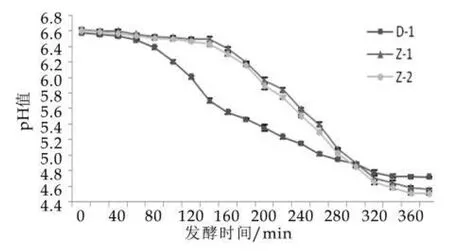
图1 不同菌株复配比例发酵乳在发酵过程中pH值的变化
发酵剂及发酵过程中球菌与杆菌的比例直接影响发酵乳产酸的速度,并对发酵乳的性状和感官品质有着重要的影响[9]。嗜热链球菌是发酵剂中主要的产酸菌株,一般情况下,接种时球菌占优势的发酵乳发酵速度整体快于杆菌占优势的发酵乳,但有研究指出,当球菌和杆菌的复配比例接近1∶1时,发酵乳产酸的速度是最快的[5]。另外,球杆菌的比例不仅会影响发酵过程中产酸的速度和产酸量,也会影响发酵乳在后酸化期pH值的变化。秦南冰等人[5]和赵鑫等人[10]的研究表明,发酵剂中球菌占优势的发酵乳后酸化程度较低,而后酸化产酸最多的仍然是球杆菌比例为1∶1的情况。值得注意的是,由于不同菌株自身特性差异较大,最佳产酸时的球杆菌比例是不定的。通过实验结果及上述分析可知,自主研发发酵剂应适当增加ST-1的量,从而提高复配菌株产酸的速度,以期缩短其在发酵前期的延迟时长和达到发酵终点pH值的时间。
2.2 不同菌株复配比例发酵乳的风味物质
采用顶空固相微萃取结合GC-MS的方法对3种发酵乳中挥发性的风味物质进行检测,气谱-质谱峰如图2所示,主要挥发性物质质量浓度如表1所示。由图2可以看出,3种发酵乳中分离到的挥发性物质种类较多,但大部分质量浓度较低。其中质量浓度较高的为三种酮类化合物,分别为2,3-丁二酮,2,3-戊二酮和3-羟基丁酮,一种酸性化合物乙酸和一种酯类化合物丁二酸二乙酯。在这五种物质中,前四种为发酵乳主要的风味物质。采用自主研发发酵剂制备的两种发酵乳,乳酸质量浓度较高且质量浓度接近,分别是采用通用型发酵制备发酵乳的2.18和1.99倍,这可能是由于Z-1和Z-2发酵剂在发酵后期和后酸化期仍缓慢产酸导致的。与其他研究结果相比[11-12],这两种发酵乳中的酸性物质质量浓度在可接受的范围内,说明自主研发发酵剂制备的发酵乳能够形成更为酸爽的口感。2,3-丁二酮,又称双乙酰,是一种重要的风味物质,赋予发酵乳特殊的香气。Z-1和Z-2发酵乳中均检测到了2,3-丁二酮,而对照发酵乳中没有检测到该种化合物,说明了自主研发发酵剂制备的发酵乳在产香方面明显优于对照发酵乳。
2.3 不同菌株复配比例发酵乳的流变学特性
流变学测试是指从应力、应变、温度和时间等方面来研究物质变形和(或)流动的一种手段。发酵乳是一种复杂的流体,其流变性是指发酵乳的流动和变形随时间、压力的变化所表现出的性质,发酵乳的流变性通常用来描述和衡量产品的质地,包括凝胶的黏弹性、硬度等[13]。为评价自主研发发酵剂所制备发酵乳口感、质构等方面的性状,本实验分别采用振幅扫描和旋转扫描对发酵乳的流变特性进行测定。振幅扫描主要检测由乳酸菌产生的胞外多糖与乳中酪蛋白形成网状结构的交联程度以及此结构对水分的保持力[14]。旋转扫描主要为测定发酵乳的动态黏度曲线以及发酵乳在入口、留口及吞咽过程中其黏性的变化趋势。
2.3.1 振幅扫描
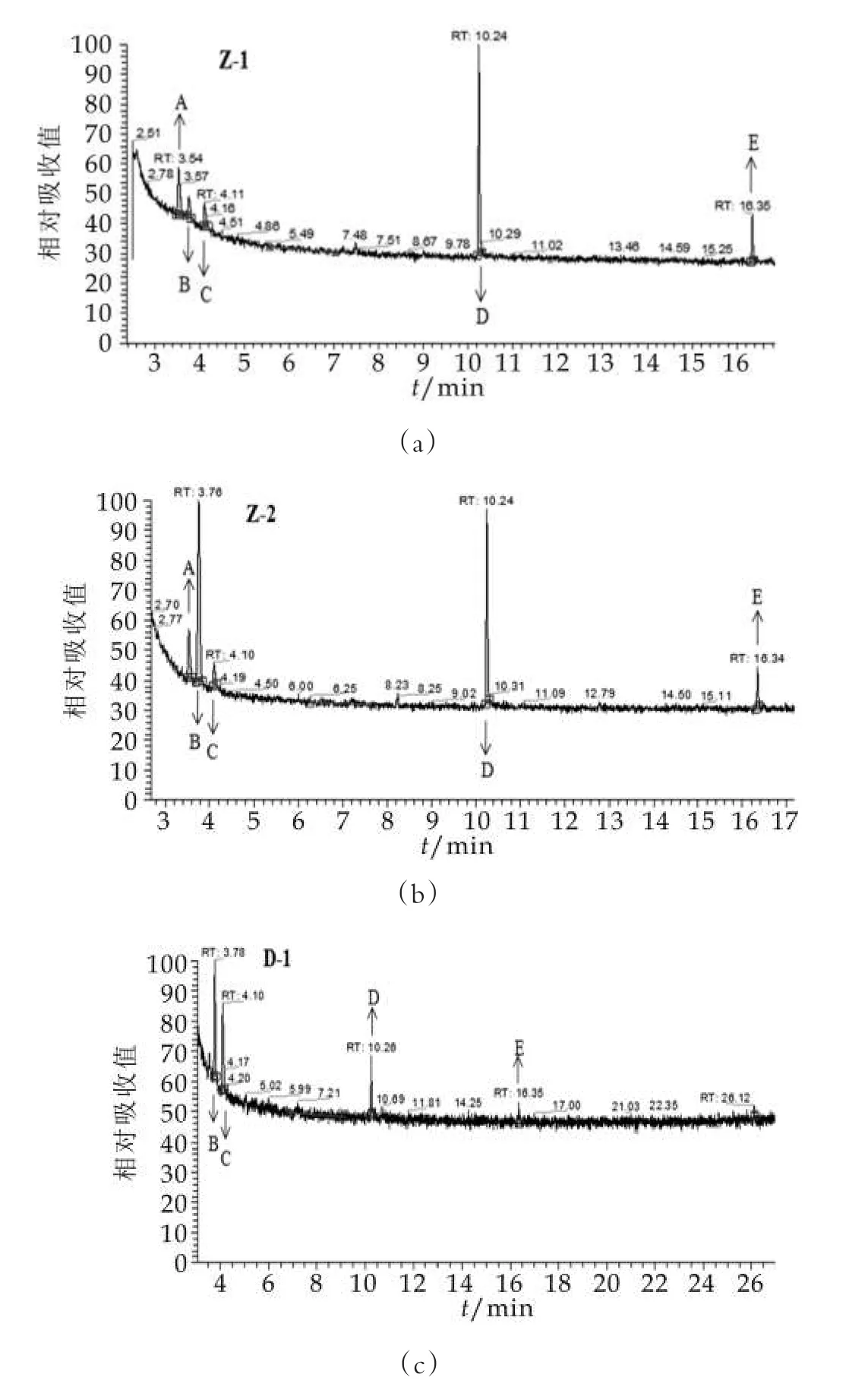
图2 不同菌株复配比例发酵乳气相色谱-质谱图
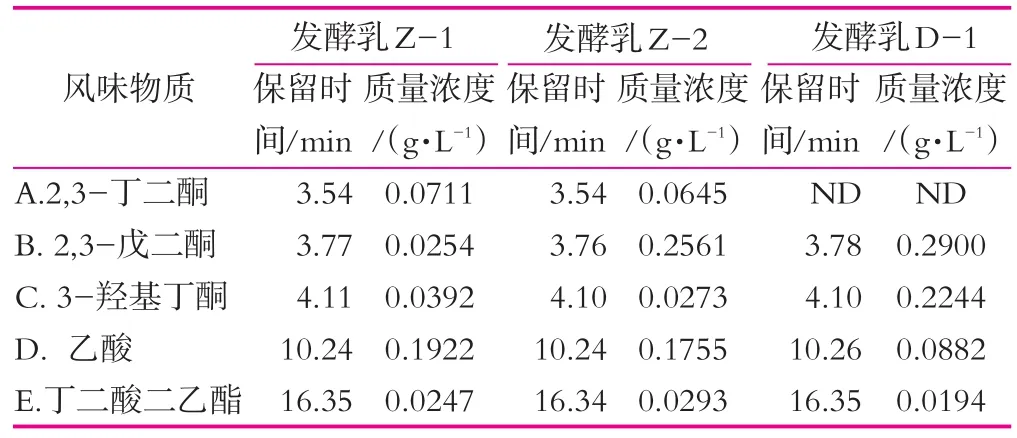
表1 发酵乳中主要挥发性物质质量浓度
通过振幅扫描,分别对三种发酵乳的黏弹性、储能模量(Storage Modulus,G′)和损耗模量(Loss Modulus,G″)进行测定,结果如图3所示。从图中可以发现,国际通用D-1和自主研发Z-1和Z-2发酵剂制备的发酵乳,在1 Hz的应变扫描中,线性黏弹区均在0.01~1.2%,在此区间剪切应变率(γ)和剪切应力(τ)成线性关系,说明了采用自主研发发酵剂制备的发酵乳在黏弹性方面能够达到标准。另外,在大部分扫描过程中,发酵乳样品表现为G′>G″,该结果与Purohit等人[14]的研究一致。储能模量与损耗模量与乳体系凝胶网络结构中链接键的个数是呈一定比例[15],其中损耗模量与键能较大的链接键相关,而储能模量的大小主要取决于键能较小的链接键[16]。因此,当发酵乳呈现G′>G″时,说明乳体系中形成了较为坚固的网状胶体结构。但随着剪切应变率的增加,G′>G″均明显下降,说明此时发酵乳体系中的网状胶体结构很大程度被破坏。同时我们还发现,在线性黏弹区间内,Z-1发酵乳的储能模量始终大于D-1发酵乳,由此可以判断,采用自主研发发酵剂Z-1制备的发酵乳所形成的网状结构较为牢固,表现为入口较高的稠厚感。

图3 不同菌株复配比例发酵乳的振幅扫描
2.3.2 旋转扫描
通过旋转扫描,对3种发酵乳的动态黏度进行测定,结果如图4所示。由图4可以看出,当剪切应变速率在0.001~0.01 s-1区间时,发酵乳样品的状态可以理解为处于货架期或入口的状态,此时发酵乳Z-1的黏度为650~802 Pa·s,而对照发酵剂D-1制备的发酵乳为533~625 Pa·s,由此可以判断自主研发发酵乳对比国际标准发酵乳在货架期及入口时可能呈现出较高的黏稠度,以及可能具有较强的持水能力。当应变剪切速率升高到10~70 s-1时,对照发酵乳D-1的黏度较高,而自主研发的发酵乳Z-1和Z-2较低,由此我们可以推测,前者在吞咽过程中呈现的稠度较厚,而后者在咀嚼和吞咽过程中比较顺滑,易于吞咽。发酵乳的黏度主要与乳体系中蛋白胶束的强弱有关,胶束强弱的变化是一种维持在乳蛋白酸化变性、蛋白酶活性变化、肽分子由于静电力和疏水作用力的重排以及氢键和二硫键等多重因素间的动态平衡[17-18]。另外,乳酸菌发酵过程中产生的胞外多糖也是影响发酵乳黏度的一个重要因素,有研究证明,采用能够产生胞外多糖的乳酸菌菌株作为发酵剂制备的酸乳具有较好的稠度和稳定性[2,19]。
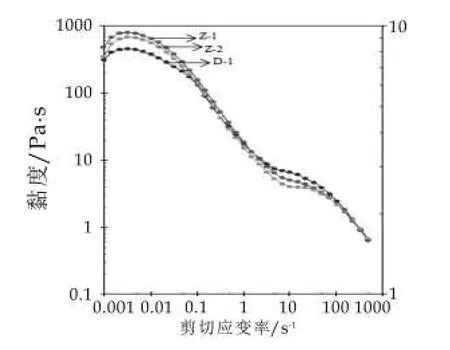
图4 不同菌株复配比例发酵乳的旋转扫描
2.4 不同菌株复配比例发酵乳持水力的比较
利用重力和离心力是测定发酵乳持水性能的经典手段[20-21]。本研究采用离心测定析水力的方法分析了3种发酵乳的持水能力,结果如图5所示。由图5可以看出,国际标准发酵剂D-1制备的发酵乳经适度离心后,乳清析出量较少,与之相比,Z-1和Z-2发酵乳上清析出量较低,其中Z-1上清析出量比D-1少10%(质量分数)左右。乳清的析出主要受到发酵乳中酪蛋白分子重排和胶质钙离子溶解速率的影响[15],然而,有研究表明,发酵乳中的一些大分子物质,例如胞外多糖,由于其具有较强结合水分的能力,并能和乳蛋白相互结合形成较稳定的网状结构[22],从能够而有效地降低乳清的析出,提高发酵制品的感官品质。另外,发酵剂菌株产酸的速率也会显著影响乳清的析出,因此在筛选发酵剂菌株时,应同时考虑菌株产生胞外多糖的量以及产酸的速度。
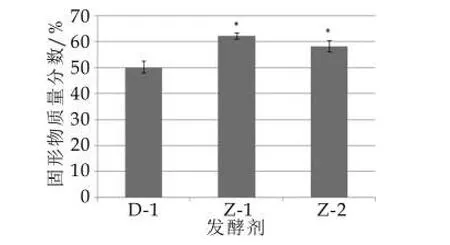
图5 不同菌株复配比例发酵乳的持水力
3 结论
(1)采用自主研发发酵剂制备的发酵乳在产香、黏弹性(爽滑度)、持水力等方面优于采用国际标准通用型发酵剂制备的发酵乳。
(2)采用振幅扫描和旋转扫描技术能够对发酵乳制品的组织状态、黏弹性、持水力等方面进行科学、客观的评价。
(3)自主研发发酵剂菌株产酸主要发生在发酵的中后期,应适当调整发酵剂菌株的复配比例,以期缩短发酵延迟期,使其适用于大规模的发酵乳生产。
[1]MOZZI F,DE GIORI GS,DE VALDEZ GF.UDP-galactose 4-epimerase:a key enzyme in exopolysaccharide formation by Lactobacillus casei CRL 87 in controlled pH batch cultures[J].Journal of Applied Microbiology,2003,94(2):175-183.
[2]KAILASAPATHY K.Survival of free and encapsulated probiotic bacteria and their effect on the sensory properties of yoghurt[J].LWT-Food Science and Technology,2006,39(10):1221-1227.
[3]FOLKENBERG D M,DEJMEK P,SKRIVER A,et al.Sensory and rheological screening of exopolysaccharide producing strains of bacterial yoghurt cultures[J].International Dairy Journal,2006,16(2):111-118.
[4]华鹤良,房东升,杨仁琴,等.嗜热链球菌与保加利亚乳杆菌的不同比例对酸乳发酵性能和产香特性的影响[J].中国乳品工业,2014,42(3):26-29.
[5]秦南冰,李妍,袁珠妮,等.保加利亚乳杆菌与嗜热链球菌的比例变化对酸奶品质的影响[J].中国乳品工业,2011,39(2):37-39.
[6]田芬,粘靖祺,霍贵成.嗜酸乳杆菌和双歧杆菌发酵乳的流变特性研究[J].食品科学,2012,33(5):155-159.
[7]DA SILVA GC,DA SILVA AAS,DA SILVA LSN,et al.Method development by GC-ECD and HS-SPME-GC-MS for beer volatile analysis[J].Food chemistry 2015,167:71-77.
[8]赵谋明,卢延辉,林伟锋,等.乳清蛋白对脱脂发酵乳的流变特性及贮存稳定性的影响[J].中国乳品工业,2006,34(2):4-6.
[9]LA TORRE L,TAMIME AY,MUIR D.Rheology and sensory profiling of set-type fermented milks made with different commercial probiotic and yoghurt starter cultures[J].International Journal of Dairy Technology,2003,56(3):163-170.
[10]赵鑫,赵洪双,姜国龙.不同比例的嗜热链球菌与保加利亚乳杆菌对酸奶品质的影响[J].农产品加工(学刊),2009,3:177-180.
[11]FERNANDEZGARCIA E,MCGREGOR JU.Determination of Organic-Acids During the Fermentation and Cold-Storage of Yogurt[J].Journal of Dairy Science,1994,77(10):2934-2939.
[12]李理,丁木,满朝新,等.两种酸奶后酸化期风味物质的比较研究[J].中国食物与营养,2014,20(5):26-30.
[13]赵红玲,李全阳,赵正涛,等.搅拌型酸奶流变学特性的研究[J].乳业科学与技术,2009,32(4):159-163.
[14]PUROHIT DH,HASSAN AN,BHATIA E,et al.Rheological,sensorial,and chemopreventive properties of milk fermented with exopolysaccharide-producing lactic cultures[J].Journal of Dairy Science,2009,92(3):847-856.
[15]LEE WJ,LUCEY JA.Structure and physical properties of yogurt gels:Effect of inoculation rate and incubation temperature[J].Journal of Dairy Science,2004,87(10):3153-3164.
[16]LUCEY J A,JOHNSON M E,HORNE D S.Invited review:Perspectives on the basis of the rheology and texture properties of cheese[J].Journal of Dairy Science,2003,86(9):2725-2743.
[17]RINGGENBERG E,ALEXANDER M,CORREDIG M.Effect of concentration and incubation temperature on the acid induced aggregation of soymilk[J].Food Hydrocolloids,2013;30(1):463-469.
[18]ROESCH R,JUNEJA M,MONAGLE C,et al.Aggregation of soy/milk mixes during acidification[J].Food Research International,2004,37(3):209-215.
[19]SUTHERLAND I W.Structure-Function-Relationships in Microbial Exopolysaccharides[J].Biotechnology Advances 1994,12(2):393-448.
[20]AMATAYAKUL T,SHERKAT F,SHAH NP.Syneresis in set yogurt as affected by EPS starter cultures and levels of solids[J].International Journal of Dairy Technology,2006,59(3):216-221.
[21]HASSAN AN,FRANK JF,SCHMIDT KA,et al.Textural properties of yogurt made with encapsulated nonropy lactic cultures.Journal of Dairy Science,1996,79(12):2098-2103.
[22]DE VUYST L,DEGEEST B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiology Reviews,1999,23(2):153-177.
