大越豆芋蛋白ACE抑制肽的分离纯化研究
2014-12-16许光治高前欣倪勤学杨冬冬张有做
陈 龙,庄 溪,许光治,高前欣,倪勤学,杨冬冬,张有做
(浙江农林大学农业与食品科学学院浙江省农产品品质改良技术研究重点实验室,浙江临安311300)
大越豆芋(Apios americana Medikus)属是一种原产于美洲的豆科植物[1],后传入日本,现已在日本广泛种植[2]。2010年本课题组从日本引进了该作物,并在浙江试种成功。大越豆芋具有较高的营养价值,其可食用部分-块茎中蛋白质含量相对高于其他块茎类植物,其中谷氨酸和天冬氨酸的含量最高,同时大越豆芋块茎中还含有其它豆科植物中含量较少的蛋氨酸和半胱氨酸,大越豆芋中的亚油酸含量也相对较高,且大越豆芋的块茎中还具有马铃薯、芋头和红薯中所没有的异黄酮类物质[3-7]。同时,大越豆芋具有抗肿瘤[8],抗高血压等多种功能。Kunihisa lwai通过用大越豆芋的粉末和水提物喂食患有高血压的小鼠后发现小鼠的血压,血脂和血浆中的胆固醇含量都有所下降,并证明了大越豆芋在一定程度上对高血压和高血脂有抑制作用,是一种健康的降压食品[9],然而,大越豆芋抑制高血压和高血脂的有效成分及机理还不清楚。
蛋白质是人体必需的重要营养物质。但现代营养学研究显示,蛋白质不仅可以为人体提供营养,其分解产物多肽还具有抗氧化、免疫调节、血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制等多种活性功能[10]。其中ACE抑制肽对于高血压具有良好的预防和治疗作用。
为了研究大越豆芋蛋白水解产物中ACE抑制肽的活性,本实验用酶水解制备了大越豆芋蛋白多肽,研究了其ACE抑制活性。在此基础上,对ACE抑制肽进行了初步纯化。以期为今后大越豆芋抗高血压机理研究及资源的高效利用提供更多参考。
1 材料与方法
1.1 材料与仪器
大越豆芋 浙江农林大学食品分子机能实验室;马尿酰组氨酰亮氨酸(Hip-His-Leu,HHL)sigma公司;血管紧张素转换酶(ACE)sigma公司;Alcalase碱性蛋白酶 北京索宝来科技有限公司;NaOH,茚三酮,磷酸二氢钠,磷酸氢二钠等试剂 均为分析纯。
DA201-C型大孔吸附树脂 郑州勤时科技有限公司;超滤仪 美国Millipore公司;DEAE-sepharose fast flow,solarbio SepHadex G-15葡聚糖凝胶,AKTA
purifier蛋白质纯化仪 美国Amersham公司;冷冻干燥机 德国eppendorf公司。
1.2 实验方法
1.2.1 实验流程 大越豆芋蛋白制备→豆芋蛋白酶解液制备→超滤分离豆芋ACE抑制肽→豆芋ACE抑制肽脱盐处理→离子交换层析分离豆芋ACE抑制肽→SepHadex G-15法分离豆芋ACE抑制肽
1.2.2 大越豆芋蛋白的制备 豆芋块茎经去皮、切片后进行冷冻干燥,用高速粉碎机将冻干后的豆芋块茎磨成粉状。以1mol/L的NaOH溶液调整蒸馏水的pH至8.0,使用该液作为提取液,将豆芋块茎粉放进40℃的提取液搅拌提取蛋白质,豆芋块茎粉与提取液比例为1∶20,提取时间为2h,将提取液4000r/min离心、沉淀,重复提取一次,将上清液加1mol/L HCl溶液至沉淀不再增加,4000r/min离心弃去上清液,合并沉淀,冷冻干燥,获得大越豆芋蛋白粉末,4℃下保存备用[11]。
1.2.3 大越豆芋酶解液制备 酶解工艺以水解度和ACE抑制率为指标进行了优化,称取一定量的豆芋蛋白粉,以1.2%的底物浓度溶于pH9.5的0.2mol/L的磷酸盐缓冲液中。按照3000U/g的加酶量加入Alcalase碱性蛋白酶,充分混合均匀,放置于温度为62℃的水浴锅中开始反应。酶解过程中采用茚三酮法测定水解度[12-13]。酶解3h后,将酶解液加热到90℃保持10min,以终止酶解反应,冷却,8000r/min离心20min,收集上清液冷冻干燥后备用,并测定ACE抑制率。
1.2.4 ACE抑制活性测定方法 ACE抑制率测定采用 Cushman[14]和 Chenung[15]的方法,并根据实际情况做相应改进。取0.1U ACE溶于含有0.3mol/L NaCl的硼酸盐缓冲液(pH8.3)中配制成ACE粗酶液,取50μL待测样液(溶于上述缓冲液,2mg/mL),50μL上述缓冲溶液和100μL的反应底液HHL(溶于相同缓冲液5mmol/L),37℃下保温10min。然后向其中加入20μL ACE溶液(100mU/mL),混合均匀后在37℃下反应 1h。向反应好的溶液中加入 100μL 1mol/L的HCl溶液以终止反应。然后向试管中加入1mL乙酸乙酯溶液用以抽提反应过程中释放出的马尿酸。剧烈震荡后,洗出乙酸乙酯层,旋转蒸发直至蒸干,加入3mL蒸馏水重新溶解溶质,在228nm下测定吸光度。用50μL的缓冲液代替样品作为空白对照。按照式(1)计算ACE抑制活性:

式中:A为空白对照的样品吸光度值;B为加入样品和ACE的溶液的样品吸光度;C为未加入ACE溶液的样品吸光度。
1.2.5 超滤分离大越豆芋ACE抑制肽 将超滤膜装入Mini-pellicon超滤系统中,调节超滤系统管路至清洗的状态,用蒸馏水对超滤膜进行清洗,清洗时间约为1h,然后用0.1mol/L pH为8.0的磷酸盐缓冲液循环清洗超滤膜以达到活化的目的,将大越豆芋酶解产物用pH为8.0的0.1mol/L的磷酸盐缓冲液配制成一定浓度的溶液,用0.45μm的膜对溶液进行一次抽滤防止沉淀物堵塞超滤膜,将处理好的溶液倒入超滤装置的贮液罐中,设定好超滤系统的进口压力后开启超滤仪,进行超滤[16]。
分别采用10、5、3ku三种不同规格的聚醚砜超滤膜进行超滤,获得组分I(M>10ku)、组分II(10ku>M>5ku)、组分 III(5ku>M >3ku)、及组分 IV(M<3ku)超滤物,收集各个组分冷冻干燥,分别测定各组分的ACE抑制率,选择合适的超滤膜。
1.2.6 豆芋ACE抑制肽DA201-C大孔吸附树脂脱盐处理 将预处理后的DA201-C大孔吸附树脂装入2.6cm×30cm的层析柱内,加至离柱口3cm。将经过超滤后冻干的豆芋多肽粉末配制成质量浓度为10mg/mL的溶液,以1mL/min的流速上样,上样量为30mL,然后用去离子水以同样的流速进行洗脱,每3mL收集一管洗脱液,测定其电导率。当电导率稳定时用不同浓度梯度的乙醇溶液以1mL/min的流速对豆芋多肽进行梯度洗脱,以分别收集合并每一个浓度梯度下的洗脱液,冷冻干燥后备用[17-20]。测定各个乙醇浓度梯度多肽的回收率及脱盐率及ACE抑制率。灰分含量的测定采用马弗炉灰化法(GB 5009.4-2010)。

式中:ρ为脱盐率(%);A为原液中灰分的含量(%);B为洗脱液中灰分含量(%)。
1.2.7 离子交换层析分离豆芋ACE抑制肽 实验选用DEAE-SepHarose Fast Flow阴离子交换树脂对经过超滤和脱盐的大越豆芋ACE抑制肽进行分离纯化。将脱盐后的豆芋ACE抑制肽冻干粉末溶解于pH为7.8的0.05mol/L的Tris-HCl缓冲液当中,配制成20mg/mL的溶液。将填充好的层析柱用0.05mol/L的Tris-HCl(pH7.8)溶液以0.5mL/min的流速平衡1h,然后用配制好的样品溶液上样,上样量为1mL,用0.5mol/L的NaCl溶液进行洗脱,用自动部分收集器收集洗脱液,每管3mL,合并洗脱峰,将各个洗脱峰冻干后,测定各个洗脱峰的ACE抑制活性。

表1 不同分子量范围样品的ACE抑制活性Table 1 The ACE inhibition activities of different molecular weight sample
离子交换色谱洗脱条件:柱尺寸:1.6cm×60cm;洗脱液:NaCl量为0.5mol/L的Tris-HCl缓冲液;流速:0.75mL/min;检测波长:220nm;上样量:1mL(样品浓度20mg/mL)。
1.2.8 SepHadex G-15法分离豆芋ACE抑制肽 将预处理好的SepHadexG-15凝胶填充入1.6cm×100cm的层析柱中。将填充好的层析柱装入AKTA purifier蛋白质纯化仪中,用超纯水以1mL/min的流速使层析柱平衡1h,然后上样开始凝胶色谱分离,分管收集洗脱组分,每管5mL,样品重复分离若干次,合并各个分离峰,将每个峰进行冻干,测定ACE抑制的活性。凝胶分离条件:凝胶类型:SepHadex G-15;柱尺寸:1.6×100 cm;洗脱液:去离子水;流速:0.5mL/min;检测波长:220nm;上样量:1mL(样品浓度100mg/mL)。
1.2.9 数据处理方法 实验数据均是经过三次平行实验得到的平均值,并采用SPSS19.0分析计算其标准偏差,Microsoft Excel(office 2003)软件作图。
2 结果与讨论
2.1 不同规格超滤膜进行超滤对产物ACE抑制活性的影响
实验选用了三种不同规格的超滤膜进行超滤实验,将收集到的滤液冻干后测定当溶液浓度为2mg/mL时各个样品低聚肽的ACE抑制活性,重复三次实验。结果如表1。通过比较不同组分的ACE抑制率可知,组分 IV(M<3ku)的 ACE抑制率为62.32%,比原液的抑制率高出9.86%。ACE抑制率随着豆芋多肽的分子量降低而升高。根据实验结果,本研究选用3ku的超滤膜对豆芋ACE抑制肽进行超滤。
2.2 豆芋ACE抑制肽脱盐处理
蛋白质水解过程中常常要使用酸或碱来调节反应液的pH,从而来保持蛋白酶的活性,但也因此会引入大量的盐离子。采用DA201-C大孔吸附树脂可以对多肽进行脱盐处理。使用不同浓度的乙醇梯度洗脱还能对多肽进行分级,获得亲水性不同的多肽。实验分别用30%,50%,70%,90%的乙醇溶液对已经上样的大孔吸附树脂进行梯度洗脱,收集合并不同浓度梯度下的洗脱液,冷冻干燥,并测定多肽回收率,脱盐率和ACE抑制率,结果如表2所示。豆芋ACE抑制肽得率随乙醇浓度的增加逐渐降低,乙醇梯度洗脱后肽的总回收率为80.49%;脱盐率随乙醇浓度的升高而增大,当乙醇浓度为30%时脱盐率为90.13%,当乙醇浓度增至90%时脱盐率增大至94.78%,由此利用大孔树脂对豆芋蛋白酶解产物进行脱盐的整体效果较好。从表中还可以看出相对于超滤组分IV,各组分的ACE抑制率都有较大提高,不同浓度乙醇洗脱的组分ACE抑制率不同,随着乙醇浓度的增加,洗脱下来的具有ACE抑制活性的豆芋多肽越多,当乙醇浓度为70%时,洗脱液的ACE抑制活性最高,为66.65%,但当乙醇浓度在90%时,ACE活性抑制率有所下降,这说明ACE抑制率与豆芋多肽疏水性没有太大的相关性。
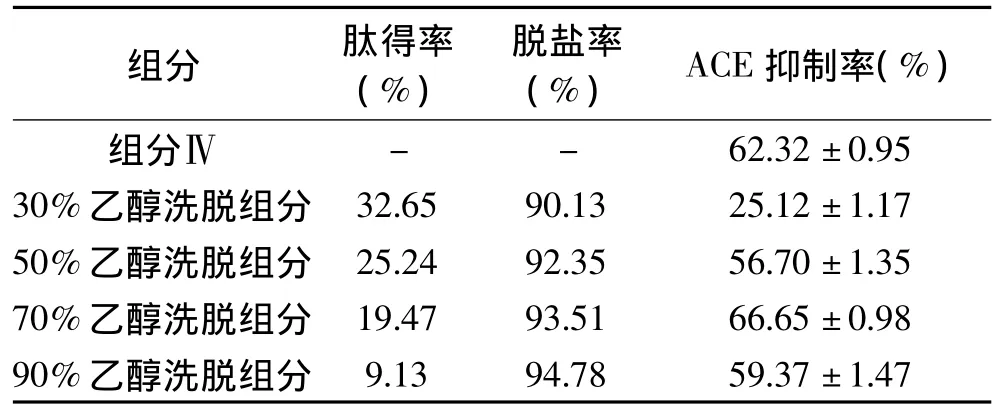
表2 不同浓度乙醇洗脱组分的肽得率,脱盐率及ACE抑制率Table 2 The peptide recovery ration,desalinization ration and ACE inhibition activity in different elution fractions
2.3 离子交换色谱DEAE-SepHarose Fast Flow的分离纯化结果
如图1所示,大越豆芋ACE抑制肽经DEAESepHarose Fast Flow阴离子交换树脂分离后大致将产物分为3个峰,分别依次命名为G1、G2、G3。本实验采用同步洗脱的方式对肽类物质进行分离,由于被吸附的肽分子的种类不同,它们所带的电荷量也不相同,因此与介质的结合牢固程度不同,这样在洗脱的过程中,较容易被替换的肽分子先从介质上脱离流出层析柱,较难被替换的肽分子后流出,这样就达到了分离纯化的目的[21]。
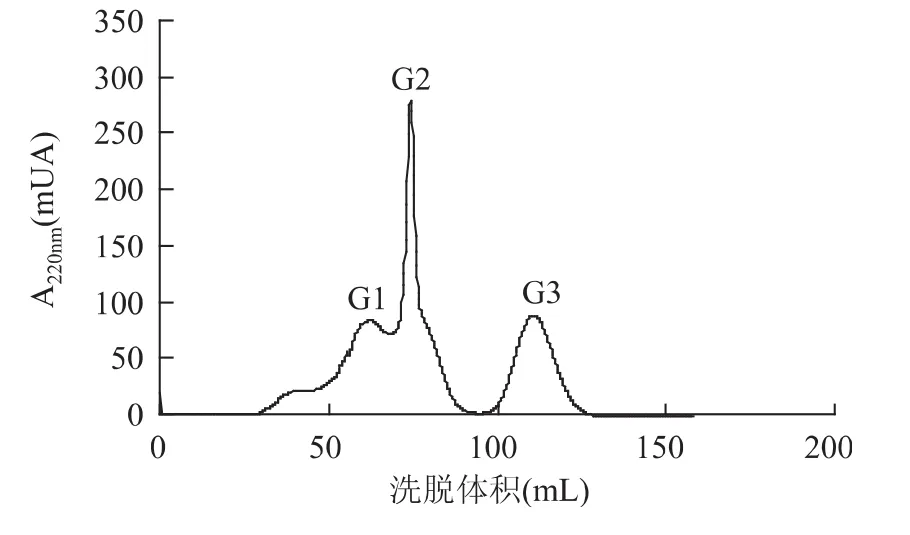
图1 DEAE-SepHarose Fast Flow洗脱曲线Fig.1 The eluting curve of DEAE-SepHarose Fast Flow
将三个峰合并收集以后浓缩冻干,分别在不同浓度下测定ACE抑制活性。各个峰的抑制活性见图2,其中G3曲线拟合斜率最大,表示G3的抑制率在一定多肽浓度范围内上升最快。根据三个峰各自不同的ACE抑制率随浓度变化曲线计算出三个峰的IC50,结果见表3。根据结果可知,G3的IC50最小,为66.00μg/mL,说明其ACE抑制活性最高,其次G1,它的IC50是178.1μg/mL,G2的 ACE抑制活性最低;三个洗脱峰的活性相差较大,说明了DEAE-SepHarose Fast Flow对ACE抑制活性肽纯化效果较好。
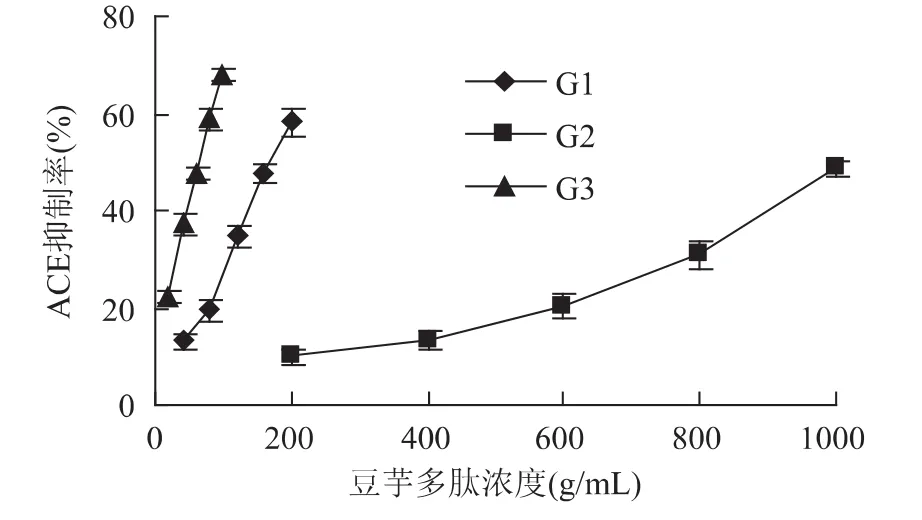
图2 G1、G2、G3 ACE抑制率随浓度的变化Fig.2 The change of ACE inhibition activity with solution concentration of G1,G2,G3

表3 DEAE-SepHarose Fast Flow三个峰ACE抑制率的IC50Table 3 The IC50of three elution peaks of DEAE-SepHarose Fast Flow
2.4 SepHadex G-15分离脱盐豆芋ACE抑制肽
采用SepHadex G-15凝胶色谱对ACE抑制肽进行分离纯化,得到的洗脱曲线见图3。从图中可知,ACE抑制肽经过凝胶色谱SepHadex G-15的分离纯化,出现两个峰,分别命名为F1和F2,分别将F1和F2两个峰各自合并后冷冻干燥,测定它们不同浓度的ACE抑制活性,结果见图4,图4中F2的斜率较大,表明F2在豆芋多肽一定浓度范围内比F1抑制效果要好。根据结果计算两个洗脱峰ACE抑制活性的IC50见表4。由表4可以看出,峰2的抑制活性较好,其 IC50可以达到 37.47μg/mL。经过 SepHadex G-15凝胶色谱纯化后的ACE抑制肽的抑制活性有所提高,说明SepHadex G-15对ACE抑制肽进行了进一步纯化。
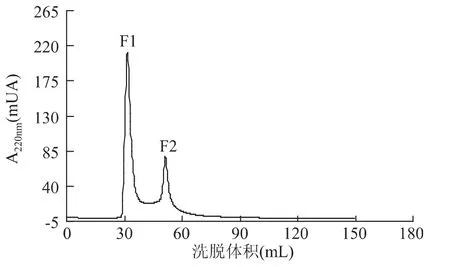
图3 SepHadex G-15的洗脱曲线Fig.3 The eluting curve of SepHadex G-15
3 结论

图4 F1、F2 ACE抑制活性随浓度的变化Fig.4 The change of ACE inhibition activity with solution concentration of F1,F2
大越豆芋蛋白经Alcalase蛋白酶酶解后,采用超滤分离、DA201-C大孔吸附树脂脱盐处理、DEAESepHarose Fast Flow离子交换色谱法、SepHadex G-15凝胶色谱法分离等手段,其分离获得的组分ACE抑制率都具有不同程度的升高。超滤分离得到3ku的豆芋多肽抑制率为62.32%,比原液高出了9.86%;大孔吸附树脂脱盐采用70%乙醇洗脱出来的组分具有最高的ACE抑制率,抑制率为66.65%。DEAE-SepHarose Fast Flow离子交换层析法分离获得的 G3组分 IC50达到 66.0μg/mL。最后采用SepHadex G-15凝胶色谱法分离获得两个组分,通过测定不同浓度样品的ACE抑制率得到抑制效果最为显著的组分 F2,其IC50可达37.47μg/mL。从实验结果上来看,本实验初步制备了具有ACE降血压活性的大越豆芋多肽。为了更清楚的了解其作用机理,有必要进行进一步的分离纯化,从而制备出ACE抑制肽单体,研究其构效关系及作用机理。大越豆芋降血压活性的研究为推动这种新食品资源的开发利用提供了有力的依据。

表4 SepHadex G-15两个洗脱峰ACE抑制率的IC50Table 4 The IC50of the tow elution peak of SepHadex G-15
[1]Seabrook JAE.Studies on the genus apiosⅠChromoseme number and distribution of Apios americana and A.priceana[J].Canadian Journal of Botany,1976,54:2567-2572.
[2]Hoshikawa K,Juliarni.The growth of Apios(Apios americana Medikus),a New Crop,under Field Conditions[J].Crop Science,1995,64(2):323-327.
[3]William M W,Edward M,Croom Jr,et al.Compositional study of Apios priceana tubers[J].Journal of Agricultural and Food Chemistry,1986,34:39-41.
[4]Kazuhiro Nara,Ken-ichi Nihei,Yasuo Ogasawara,et al.Novel isoflavone diglycoside in groundnut(Apios americana Medik)[J].Food Chemistry,2011,124:703-710.
[5]Youzuo Zhang,Cunshan Zhou,Shunming Tang,et al.Effect of AATI,a Bowman.Birk type inhibitor from Apios americana,on proliferation of cancer cell lines[J].Food Chemistry,2011,128:909-915.
[6]Wilson PW,Gorny JR,Blackmon WJ.Fatty acids in the American groundnut(Apios americana)[J].Food Science,1986,51:1387-1388.
[7]Carlisi J,Wollard D.History,Culture,and Nutrition of Apios americana[J].Journal of Nutraceuticals,Functional and Medical foods,2004(4):3-4.
[8]Barnes S,C-C Wang,Kirk M.HPLC mass spectrometry of isoflavonoids in soy and the American groundnut,Apios americana[J].Advances in Experimental Medicine and Biology,2002,21:77-88.
[9]Iwai K,Matsue H.Ingestion of Apios americana Medikus tuber suppressesblood pressure and improves plasma lipids in spontaneously hypertensive rats[J].Nutrition Research,2007(4):218-224.
[10]Giovanna B,Graziana M S,Donatella Resta,et al.ACE-inhibitory activity of enzymatic protein hydrolysates from lupin and other legumes[J].Food Chemistry,2014,145:34-40.
[11]Kakoli Mukhopadhyay,James L Maller.Purification and characterization of a protein kinase from winged bean[J].Phytochemistry,1997,46(7):461-467.
[12]张效荣,吕顺,陆剑锋,等.酶解鮰鱼皮明胶制备ACE抑制肽的工艺条件优化[J].食品工业科技,2012,33(18):302-305.
[13]郭兴凤 .蛋白质水解度的测定[J].中国油脂,2000,25(26):176-177.
[14]Cushman D W,Cheung H S.Spectrophotometric assay and properties of angiotensin-converting enzyme of rabbit[J].Biochem Pharmacol,1971,20:1637-1648.
[15]Ching W D,Tsou M J,Tsaiet Z Y,et al.AngiotensinⅠ-converting enzyme inhibitor derived from soy protein hydrolysate and produced by using membrane reactor[J].Food Chemistry,2006,98:725-732.
[16]冯彪,倪晋仁.超滤技术处理酪蛋白酶解液的研究[J].中国乳品工业,2005,33(3):32-34.
[17]李勇,黄先智,阚建全,等.大孔树脂吸附分离蚕蛹ACE抑制肽的研究[J].食品工业科技,2012,33(16):281-288.
[18]刁静静,曹龙奎.大孔吸附树脂吸附分离高活性玉米抗氧化肽[J].食品科学,2011,32(16):187-191.
[19]范文,阮长青,王鹤霖.DA201-C大孔吸附树脂对腐乳多肽脱盐作用的研究[J].中国粮油学报,2011,26(8):105-108.
[20]袁怀波,赵国华,李洪军,等.利用大孔吸附树脂纯化葛根异黄酮的研究[J].食品与发酵工业,2003,29(2):62-65.
[21]Chetan S R.Purification of large proteins using ion.exchange membranes[J].Process Biochemistry,2001,37:247-256.
