响应面法优化新疆昆仑雪菊多糖提取工艺研究
2014-12-16田洪磊
邵 理,詹 萍,田洪磊
(石河子大学食品学院,新疆石河子832000)
昆仑雪菊(Coreopsis tinctoria Nuff.)是菊科金鸡菊属一年生草本植物,其学名为蛇目菊、双色金鸡菊[1]。原产地为美国中西部地区,目前在新疆和田地区广泛种植,在当地又称之为雪菊、昆仑血菊、高寒雪菊等,维语名称为古里恰依[2]。也是目前在新疆唯一可以与雪莲媲美,具有特殊功效和药用价值的高寒野生植物[3]。昆仑雪菊味甘,性平,具有活血化瘀、和胃健脾、降血压和降血脂的作用。长期以来都被当地居民当花茶来饮用,并有减肥养颜、抗菌消炎的功效,具有极高的药用价值,历代药典中关于昆仑雪菊的药用价值记载也很多,因此昆仑雪菊是具有广阔前景和研究价值的新品种[4-7]。
近几年来,随着人们对天然产物保健品越来越重视,加之植物多糖类化合物有着广泛的生物活性(如免疫调节、降血糖、抗氧化等)作用,引起了许多学者对多糖的关注和研究。现代药理研究已表明菊花多糖是一种良好的氧自由基清除剂,具有良好的预防保健作用[8]。昆仑雪菊的药理作用[9-10],及其氨基酸[11]、总黄酮[3]、挥发油[12]等化学成分的研究已有报道,但对其多糖的研究报道尚待深入。本论文以多糖得率为指标,结合超声波辅助提取及响应面实验Box-Behnken设计的方法,探讨了液料比、超声时间、提取温度等参数对昆仑雪菊多糖得率的影响。预期研究成果为新疆昆仑雪菊生物活性物质制备提供借鉴。
1 材料与方法
1.1 材料与仪器
昆仑雪菊 西域金锄生物工程有限责任公司提供;苯酚、硫酸、乙醇、葡萄糖等标品及其他试剂 均为分析纯,蒸馏水为实验室自制。
双频数控超声波清洗器KQ-200VDE 昆山市超声仪器有限公司;紫外可见分光光度计UVmini-1240 岛津国际贸易公司;离心机 力康发展有限公司;粉碎机 上海百丰食品机械有限公司;HHS-216型恒温水浴槽 常州国华电器有限公司。
1.2 实验方法
1.2.1 昆仑雪菊多糖的提取方法 参考文献[13],将昆仑雪菊放入40℃的烘箱中干燥24h,粉碎,过60目筛,密封后避光保存。采用索氏提取法在有机溶剂丙酮-石油醚(1∶1,V/V)65℃的回流下对昆仑雪菊粉末进行脱脂处理,并烘干脱脂后的粉末。再进行超声萃取处理,经提取,离心合并上清液并浓缩后,用Sevag法除蛋白、醇沉、抽滤,滤饼依次用无水乙醇、丙酮、乙醚洗涤后,真空干燥,得昆仑雪菊粗多糖。其工艺流程:昆仑雪菊→干燥→粉碎→脱脂→超声波萃取→离心→浓缩→去蛋白→醇沉→洗涤→冷冻干燥→粗多糖。
1.2.2 标准曲线的建立 参考文献[14-15],分别吸取(1.0mg/mL)葡萄糖标准溶液 2.0、4.0、6.0、8.0、10.0mL,分别置100mL容量瓶中,用蒸馏水稀释至刻度,摇匀。精密移取上述系列标准溶液各0.5mL,置于具塞玻璃试管(10mL)中,空白对照用蒸馏水0.5mL。每管加入1.0mL苯酚溶液(5%),混匀后,加3.5mL浓硫酸,迅速混匀,室温放置10min,置40℃水浴中加热反应30min,冰水浴冷却至室温,于487nm处测吸光度。以标准葡萄糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。回归方程为:A=0.0072C-0.002,R2=0.9981(n=5),线性关系良好。式中:A表示波长487nm处的吸光度;C表示葡萄糖的浓度。
1.2.3 苯酚-硫酸法测定昆仑雪菊多糖的得率 昆仑雪菊多糖的得率(%)=C×V×D/W×100,式中:C为根据标准曲线计算出的浓度,μg/mL;V为提取液的体积,mL;D为样品溶液的稀释倍数;W为样品的质量,μg。
1.2.4 单因素实验
1.2.4.1 液料比对昆仑雪菊多糖得率的影响 准确称取昆仑雪菊粉末2.00g,设置超声时间为60min、提取次数为一次、提取温度为70℃,分别在液料比(mL/g)梯度为 20∶1、30∶1、40∶1、50∶1、60∶1、70∶1 条件下制备粗多糖样品,并结合离心、醇沉及洗涤等环节对制备粗液进行纯化。通过样品复溶稀释测定吸光值,计算昆仑雪菊多糖的得率。
1.2.4.2 超声时间对昆仑雪菊多糖得率的影响 准确称取昆仑雪菊粉末2.00g,设置液料比(mL/g)40∶1、提取次数为一次、提取温度为70℃,分别在超声时间为 15、30、45、60、75、90min 条件下制备粗多糖样品,并结合离心、醇沉及洗涤等环节对制备粗液进行纯化。通过样品复溶稀释测定吸光值,计算昆仑雪菊多糖的得率。
1.2.4.3 提取次数对昆仑雪菊多糖得率的影响 准确称取昆仑雪菊粉末2.00g,设置液料比(mL/g)40∶1、超声时间为60min、提取温度为 70℃,分别在提取次数为一次、两次、三次、四次、五次条件下制备粗多糖样品,并结合离心、醇沉及洗涤等环节对制备粗液进行纯化。通过样品复溶稀释测定吸光值,计算昆仑雪菊多糖的得率。
1.2.4.4 提取温度对昆仑雪菊多糖得率的影响 准确称取昆仑雪菊粉末2.00g,设置液料比(mL/g)40∶1、超声时间为60min、提取次数为一次,分别在提取温度为30、40、50、60、70、80℃ 条件下制备粗多糖样品,并结合离心、醇沉及洗涤等环节对制备粗液进行纯化。通过样品复溶稀释测定吸光值,计算昆仑雪菊多糖的得率。
1.2.5 响应面分析法优化实验验 根据Box-Benhnken的中心组合实验设计原理[16],结合前期单因素实验,选取液料比、超声时间、提取温度、提取次数各因素的最优实验范围,以多糖得率(%)为响应值,运用响应面法进行四因素三水平的昆仑雪菊多糖提取工艺优化实验设计,以确定昆仑雪菊多糖最佳提取工艺。因素水平及编码如表1所示。
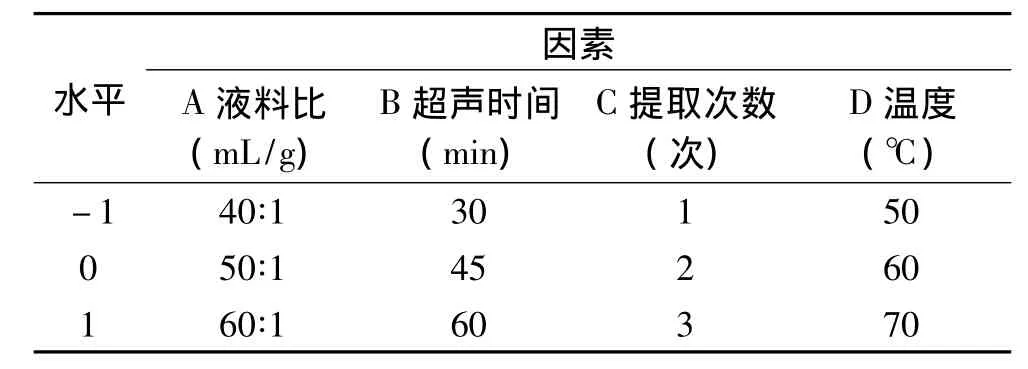
表1 响应面因素水平及编码Table 1 The factors and levels of response surface
1.2.6 数据统计与分析 数据采用origin8.0及Design-Expert 8.06软件处理分析,所有数据均进行三次平行实验。
2 结果与分析
2.1 单因素实验
2.1.1 液料比对昆仑雪菊多糖得率的影响 从图1可以看出,液料比在(mL/g)20∶1~50∶1 之间,多糖的得率随溶剂量的增加而增大,在50∶1时多糖得率达到最大,当进一步增大液料比时,多糖的得率反而下降。在一定范围内,由于萃取体系溶剂量的增加会导致溶质细胞内外渗透压产生明显差异,从而在加速多糖扩散程度的同时,辅助于多糖浸出效率的提升;随着细胞内外多糖浓度趋向平衡的动态变化,多糖溶出量达到最大[17];继而增大液料比,可能会加速胞内其它物质浸出及多糖螯合的机率,致使多糖得率降低。故选取液料比(mL/g)50∶1左右为宜。
2.1.2 超声时间对昆仑雪菊多糖得率的影响 从图2可以看出,超声时间在15~45min之间,多糖得率随超声时间延长而逐渐增加,45min时多糖得率达到最大,而后随时间的延长得率呈下降趋势。由于超声波剪切力强和对细胞的空化作用,使得细胞内部的多糖逐渐向外扩散,得率呈上升趋势;当处理数分钟后,细胞破碎程度增大,有利于多糖浸出,多糖的含量升高到最大值;随超声波处理时间的延长,多糖结构遭到破坏,这可能是造成得率下降的原因[18]。故选取超声时间45min左右为宜。

图1 液料比对多糖得率的影响Fig.1 The influence of liquid-solid ratio on polysaccharide yield
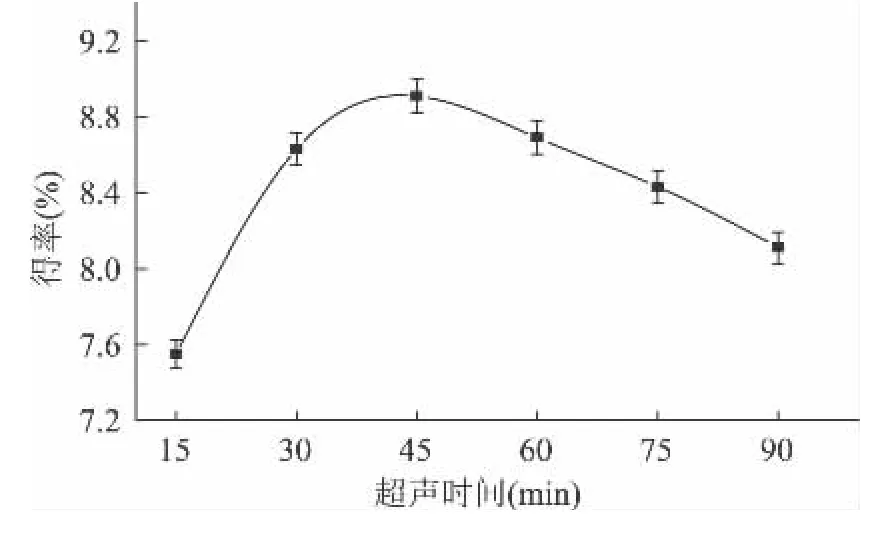
图2 超声时间对多糖得率的影响Fig.2 The influence of ultrasound time on polysaccharide yield
2.1.3 提取次数对昆仑雪菊多糖得率的影响 从图3可以看出,随着提取次数的增加,得率增加基本平缓。一次提取,整个体系较稠,溶液颜色较深,多糖不能完全浸出。提取次数增加,得率变化不大,所得溶液的体积增加,为后期溶液的处理带来试剂上的浪费。故选取提取次数为两次左右为宜。

图3 提取次数对多糖得率的影响Fig.3 The influence of extraction times on polysaccharide yield
2.1.4 温度对昆仑雪菊多糖得率的影响 从图4可以看出,在30~60℃范围内,多糖得率呈上升趋势,在60℃时,得率达到最大,而后随着温度升高多糖得率呈降低趋势。温度升高,使得多糖分子扩散运动加强,促使多糖浸出,多糖得率增加;然而在温度过高的情况下,可能由于多糖糖苷键的破坏与降解,导致多糖得率下降。故选取提取温度60℃左右为宜。

图4 温度对多糖得率的影响Fig.4 The influence of extraction temperature on polysaccharide yield
2.2 响应面分析法优化实验
2.2.1 回归模型的建立及方差分析 采用Design Expert8.0.6软件中的Box-Behnken模型设计分析方案,实验设计及结果如表2所示。

表2 响应面实验设计及结果Table 2 The experimental scheme and results of central composite design

表3 回归模型及方差分析结果Table 3 The regression models and results of variance analysis
根据表2中Box-Behnken实验设计结果,采用Design-Expert 8.06统计软件,通过回归分析对表2实验数据进行回归拟合,得到A(液料比)、B(超声时间)、C(提取次数)、D(温度)四个因素对昆仑雪菊多糖得率(Y)的二次回归方程为:
Y=+11.82+0.65A+0.35B+0.16C-0.63D-0.43AB-1.07AC+0.48AD-0.62BC-0.16BD+1.00CD-1.35A2-1.94B2-0.79C2-0.74D2。对该回归模型及其系数进行显著性检验,结果见表3。
由表3可知:模型极显著(p<0.0001),一次项(A、B、D)、交互项(AC、BC、CD)、各平方项均对响应值有极显著性影响;失拟项p=0.9893>0.05,失拟项差异不显著,该回归方程对实验拟合程度较好;模型相关系数为0.9705,说明该模型能解释97.05%的响应值变化,仅有2.95%的变异不能由此模型解释,预测值与实验值具有高度的相关性,该模型成立。对回归系数显著性检验,在α=0.05显著水平剔除不显著项,得到优化后的方程为:

通过对回归系数的检验可知,各因素对昆仑雪菊多糖得率影响的大小顺序为A(液料比)>D(温度)>B(超声时间)>C(提取次数),其中液料比、温度、超声时间对得率具有极显著的影响,提取次数对得率没有显著影响。
2.2.2 响应面分析 该数学回归模型中响应面图形是响应值(得率)对各因素所构成的三维空间的曲面图。为考察交互项对多糖得率的影响,在其他两因素条件取最优工艺参数值时,考察另外两因素交互项对多糖得率的影响[19-20]。由方差分析表3可知,在本实验所建立的数学回归模型中,AC、BC和CD三项之间存在极显著的交互作用。利用Design-Expert8.0.6软件对回归模型进行响应面分析,得到AC、BC和CD的响应面三维立体图(图5~图7)。
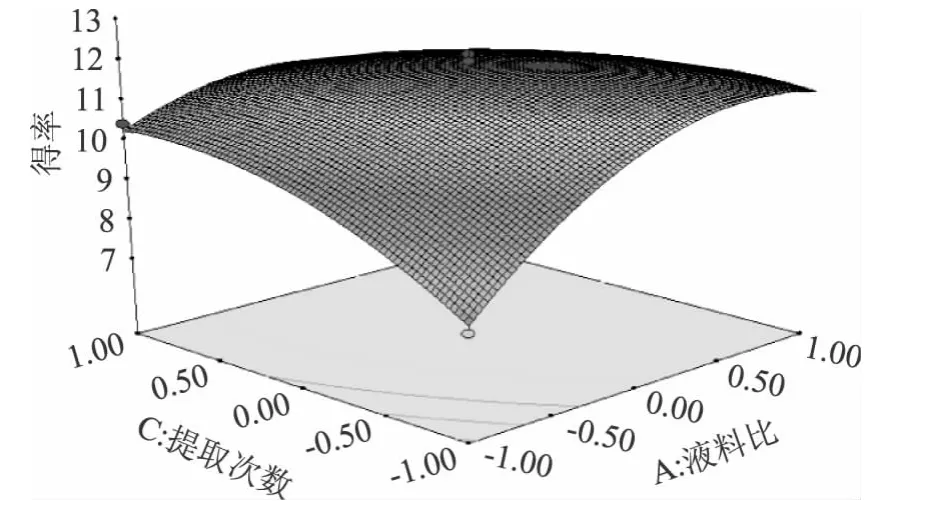
图5 液料比与提取次数交互作用的响应面Fig.5 The response surface and contour of interacting between liquid-solid ratio and extraction times
从图5可以看出:响应曲面走势剧烈,说明提取次数和液料比之间交互作用强;同时液料比的曲面较提取次数的曲面陡,亦说明当其它因素为固定时,料液比对多糖得率的影响显著,等高线图的圆心接近椭圆,交互作用强;沿液料比轴向的等高线密集,说明液料比对多糖得率的影响显著性比提取次数对多糖得率的影响更加显著。从图7可以看出:提取次数曲面比温度曲面平缓,当其它因素固定时,与提取次数相比提取温度呈显著性变化趋势,且其等高线成椭圆,此两因素交互作用较强,沿温度轴的等高线较为密集,说明超声温度对多糖得率影响较显著。从图6可以看出:超声时间曲面比提取次数曲面陡,说明超声时间对多糖得率的影响显著,等高线接近圆,说明这两因素交互作用不明显。结合表3可以得出各因素的交互作用对得率的影响由强到弱依次为 AC、CD、BC。

图6 超声时间与提取次数交互作用的响应面Fig.6 The response surface and contour of interacting between extraction time and extraction times

图7 温度与提取次数交互作用的响应面Fig.7 The response surface and contour of interacting between extraction temperature and extraction times
2.3 昆仑雪菊多糖最优提取条件的确定和验证实验
通过所得回归模型对提取工艺进行优化,得到昆仑雪菊多糖得率的最佳工艺条件为:液料比(mL/g)为 59.6∶1,超声时间 52.54min,提取次数为1.76次,温度为67.90℃,在此条件下多糖得率的理论值为10.07%。为检验Box-Behnken(BBD)实验设计方法的可靠性,采用上述最佳工艺条件进行验证实验,同时考虑到操作的方便性,将提取工艺参数修正为液料比(mL/g)60∶1,超声时间53min,提取次数两次,温度68℃,设三次重复实验。测得多糖平均得率为9.85%,相对误差约为2.18%,实际值与理论值相差较小,说明由Box-Behnken(BBD)实验设计方法进行该实验条件的优化,具有可行性。
3 结论
本论文以新疆昆仑雪菊为材料,运用了Box-Behnken(BBD)实验设计方案,采用超声波辅助法对昆仑雪菊多糖的提取工艺进行了研究。在单因素实验的基础上,利用 Design Expert软件Box-Behnken设计法设计响应面实验,建立了数学模型,预测了昆仑雪菊多糖最优的提取工艺条件,并进行实验验证,经修正后确定昆仑雪菊多糖最佳提取工艺条件:液料比(mL/g)60∶1,超声时间53min,提取次数两次,温度68℃,此条件下昆仑雪菊多糖得率可达9.85%。超声波辅助法对提取昆仑雪菊多糖工艺具有操作简单、效率高等优点,为进一步的工艺开发提供较好的参考依据。
[1]兰卫,赵保胜,李玉清,等.昆仑雪菊中多种成分的含量测定[J].中国实验方剂学杂志,2012,18(10):101-103.
[2]曹燕,庞市宾,徐磊,等.金鸡菊提取物体外抗氧化活性[J].中国实验方剂学杂志,2011,17(12):144-147.
[3]张彦丽,茹鲜古丽·哈斯木,丁海燕,等.超声-微波协同萃取法提取昆仑雪菊中的总黄酮的研究[J].广州化工,2011,39(21):57-59.
[4]买买提·艾买提,木合布力·阿布力孜,孟磊.新疆昆仑雪菊水溶性总黄酮的含量测定[J].海峡药学,2010,22(10):56-57.
[5]张彦丽,阿布都热合曼·合力力,阿依吐伦·斯马义.苯酚-硫酸法测定维吾尔药昆仑雪菊多糖含量的研究[J].药物分析杂志,2010,30(11):2205-2207.
[6]新疆植物志编辑委员会.新疆植物志第5卷[M].乌鲁木齐:新疆科技卫生出版社,1999.93.
[7]刘伟新,邓继华,徐鸿.一种金鸡菊花的生药学研究[J].中国民族医药杂志,2009,l:24-25.
[8]李贵荣.野菊花多糖的提取及其对活性氧自由基的清除作用[J].中国公共卫生,2002,18(3):269-270.
[9]梁淑红,庞市宾,刘小燕,等.金鸡菊提取物降血脂作用的研究[J].中国实验方剂学杂志,2010,16(8):234-235.
[10]梁淑红,哈木拉提,庞市宾,等.金鸡菊提取物降血压化学成分实验研究[J].时珍国医国药,2010,21(7):1619-1621.
[11]木合布力·阿布力孜,张兰,张敏.昆仑雪菊中氨基酸的含量分析[J].医药导报,2011,30(4):431-432.
[12]张彦丽,韩艳春,阿依吐伦·斯马义.GC-MS对昆仑雪菊挥发油成分的研究[J].新疆医科大学学报,2010,33(11):1299-1300.
[13]敬思群,张晓明.超高压处理金鸡菊多糖的提取工艺条件优化[J].食品科技,2013,38(2):168-170.
[14]M Dubots,KA Gilles,JK Hamilton.Colorimetric method for determination of sugars and related Substances[J].Anal Chem,1956,28:350-356.
[15]姜爽.黄连多糖的提取、分离及抗大鼠2型糖尿病作用的实验研究[D]:长春:吉林大学,2013:16-17.
[16]费荣昌.实验设计与数据处理[M].第4版.无锡:江南大学教材,2001.59-63.
[17]王超,蒋璇,彭杰,等.香菇粗多糖提取工艺的研究[N].江苏科技大学学报:自然科学版,2013,27(1):85-88.
[18]蒲彪,岳金玫,陈安均,等.响应面法优化块菌多糖的超声波辅助提取工艺[N].核农学报,2013,27(7):0996-1002.
[19]王淑霞,李爱梅,张俊杰,等.响应面分析法优化龙眼核中多酚物质提取工艺[J].食品科学,2011,32(10):35-39.
[20]袁建,李大川,石嘉怿,等.响应面法优化麦麸蛋白质和膳食纤维的提取工艺[J].食品科学,2011,32(10):25-30.
