SPIO标记浓度对BMSCs生物学特性的影响及体外MRI表现
2014-12-13赵江民刘佳林雁冰宗根林吴利忠钱海珊游建雄
赵江民,刘佳,林雁冰,宗根林,吴利忠,钱海珊,游建雄*
1.上海交通大学医学院附属第三人民医院医学影像科,上海 201999
2.上海市东方医院医学影像科,上海200120
骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)是一类具有高度的自我复制能力和多项分化潜能的细胞[1-3]。近年来,随着分子影像学技术的发展,采用适当的分子标记BMSCs,利用MRI成像技术对其示踪,已成为研究的热点[4-6]。笔者通过对大鼠BMSCs进行不同浓度超顺磁性氧化铁(SPIO)的体外标记,研究其对干细胞的生物学特性的影响,以及不同标记浓度SPIO的MR成像效果,为进一步研究奠定基础。
1 材料与方法
1.1 实验动物、主要仪器和试剂
清洁级SD大鼠(上海斯莱克实验动物有限责任公司购入),4~6周龄5只。
DMEM/F12培养基(美国Gibco公司),倒置相差显微镜(日本Olympus公司),MR成像仪(3.0 T,Achieva型)(Phillips公司),FBS(胎牛血清) (美国Gibco公司),L-谷氨酰胺、青霉素-链霉素溶液、胰蛋白酶(1:250) (美国Hyclone公司),超顺磁性氧化铁(商品名Resovist;德国Schering公司),普鲁士蓝染色试剂盒(上海虹桥乐翔医用试剂公司)。
1.2 大鼠BMSCs的体外分离、培养与传代
SD大鼠行颈椎脱臼法处死,完整取出股骨、胫骨及肱骨,在超净台无菌条件下,用注射器吸取5 ml含15%胎牛血清的完全培养基(DMEM/F12,青霉素100 U/ml,链霉素100 μg/ml)反复冲洗骨髓腔,并用吸管将细胞悬液吹打混匀。将冲出液直接接种于T25的细胞培养瓶内,置于37 ℃、5%CO2、饱和湿度细胞培养箱中培养。
待细胞融合达80%~90% 即可传代。用0.25%的胰蛋白酶1 ml消化后按1:2或1:3的比例传代。以后每隔3~4 d换液,倒置相差显微镜逐日观察,待细胞融合铺满瓶底约80%~90%,重复上述操作。
1.3 流式细胞仪检测表面抗原CD34、CD44及CD90
取培养至第4代的细胞,用PE-CD34、PECD44及FITC-CD90抗体标记,并通过流式细胞仪检测细胞表型。
1.4 BMSCs的SPIO标记及鉴定
SPIO加入到新鲜DMEM/F12(含15%FBS)细胞培养液中,将SPIO浓度分别调整为25 μg/ml、50 μg/ml、75 μg/ml及100 μg/ml,并在这些液体中分别加入0.75 μg/ml的多聚赖氨酸。实验组:取状态良好的第4代BMSCs分别更换上述4种浓度SPIO的完全培养液,细胞浓度为1×105/ml,置于细胞培养箱(37℃、5%CO2、湿度95%)孵育48 h,作为实验组(B、C、D、E)。对照组(A):用不含SPIOPLL的DMEM/F12培养液换液,其他条件同实验组。并在倒置相差显微镜下观察各组细胞的形态及生长状况。
将经SPIO标记48 h的实验组(B、C、D、E)的BMSCs分别进行普鲁士蓝染色,显微镜下观察结果。计数阳性细胞,计数各孔3个低倍镜视野下的200个细胞中的阳性细胞,计算阳性细胞比率(阳性细胞比率=阳性细胞数÷细胞总数×100%)。
1.5 SPIO标记的BMSCs生物学特性的检测
1.5.1 台盼兰染色观察细胞活性
将实验组及对照组共5组细胞制为细胞悬液,取9滴细胞悬液移入小试管内,加入1滴0.4%的台盼兰染液,混匀,在光镜下进行细胞计数,死细胞染为蓝色,活细胞不着色,计数200个细胞,每组重复3次,并计算活细胞百分率(活细胞率=活细胞数÷细胞总数×100%)。
1.5.2 MTT比色法检测细胞增殖
将实验组及对照组共5组细胞制成细胞悬液(细胞浓度2×104/ml),按每孔200 μl接种于96孔板中,每组设10个平行对照孔。分别在接种后第5天采用MTT法进行细胞增殖检测,酶联免疫检测仪测定各孔的吸光度值(OD值)。
1.6 SPIO标记的BMSCs体外MRI
对照组、各实验组标记48 h后,将细胞浓度调整为2×106/ml的细胞悬液,每组细胞各取250 μl (细胞量为5×105)接种于96孔板中,进行MR扫描。采用Phillips 3.0 T Achieva型MR成像仪,八通道头颅线圈(Sense head 8 coil)。视野(FOV) 100 mm×150 mm,层厚0.6 mm,层间距0 mm,矩阵163×163;采用3D-FFE (TR 100 ms,TE 4.6~40 ms,echo 5,Flip 15°)。测量各孔细胞悬液图像的信号强度,ROI为5 mm×5 mm。相对信号值=标记BMSCs的信号强度÷对照的普通BMSCs的信号强度。
1.7 统计学方法
所有实验数据采用SPSS 17.0统计学软件进行统计学分析处理,以均数±标准差(±s)形式表示,细胞活性、细胞增殖结果及MRI信号强度比较采用方差分析,以P<0.05表示差别有统计学意义。
2 结果
2.1 BMSCs表面抗原的检测
流式细胞仪检测表面抗原,表面抗原CD34表达阴性,CD44 、CD90表达阳性的细胞分别在98%、90%左右,表明分离培养得到的MSCs纯度较高(图1)。
2.2 SPIO标记BMSCs
2.2.1 倒置相差显微镜下,离心后观察
在倒置相差显微镜下观察发现,SPIO浓度为25 μg/ml、50 μg/ml标记的BMSCs保持原有的梭形形态,在胞质内细胞核周围可见到聚积的褐色颗粒物。但在75 μg/ml及100 μg/ml SPIO标记后的BMSCs中,虽然部分仍保持原有的梭形形态,但细胞间出现较多的细胞碎片及散在褐色颗粒聚集物,100μg/ml标记的细胞膜模糊、细胞与细胞之间的边界不清(图2)。四种浓度SPIO标记48 h后的细胞经胰酶消化离心后,可见沉积的细胞团块呈现为棕褐色,且随着SPIO的浓度增加其细胞团块颜色也逐渐加深(图3)。
2.2.2 标记效率检测
SPIO浓度为25、50、75及100 μg/ml标记48h的BMSCs经普鲁士蓝染色后显微镜下观察,细胞的胞质内均出现成簇或散在分布的细小的蓝色铁颗粒,并随着SPIO浓度的增加,蓝色铁颗粒有所增多。这4个组标记的阳性细胞率分别为:99%、100%、100%、100%(图4)。
2.3 SPIO标记BMSCs生物学特性的检测结果
2.3.1 台盼兰染色活细胞计数
25 μg/ml、50 μg/ml、75 μg/ml、100 μg/ml浓度的SPIO标记后,经台盼兰染色活细胞比率分别为95.51±1.20、96.03±1.78、92.73±0.98和90.44±2.24,未标记BMSCs活细胞比率为95.35±1.37。与未标记组相比, SPIO浓度为25 μg/ml、50 μg/ml标记的BMSCs活细胞比率差异无统计学意义(P>0.05),而SPIO浓度为75 μg/ml、100 μg/ml时,活细胞比率差异有统计学意义,P值分别为0.0026、0.0028(P<0.05),说明对细胞活力有明显抑制作用。
2.3.2 细胞增殖活性检测
MTT结果显示,浓度为25 μg/ml、50 μg/ml的实验组SPIO标记对细胞增殖无明显影响;而浓度为75 μg/ml、100 μg/ml的实验组与对照组相比,明显抑制细胞增殖,P值分别为0.01663、0.01659(P<0.05;表1)。
2.4 MRI扫描结果
表1 实验组及对照组的MRI信号强度和吸光度(OD)值(±s)Tab.1 MRI signal intensity and absorbance (OD) value of experimental and control groups(±s)
Note: aP<0.05 compared with control group.
Group Signal intensity Absorbance (OD) value (n=10)Control group 1260.2±145.8 0.4886±0.039125 μg/ml 1005.3±262.5 0.4807±0.035250 μg/ml 711.3±198.3a 0.4701±0.033975 μg/ml 556.5±145.6a 0.4523±0.0423a 100 μg/ml 340.4±102.8a 0.4429±0.0309a
在SPIO标记48h的BMSCs MRI扫描图像上,当SPIO标记浓度为25 μg/ml时,细胞悬液的信号最高,与对照组BMSCs相比较,信号强度的差异无统计学意义;当SPIO浓度≥50 μg/ml,标记细胞的T2信号强度与对照组BMSCs相比较均有明显差异(P<0.05),随着SPIO浓度的增加信号强度也逐渐降低,当浓度为100 μg/ml时,信号强度为最低信号(表1,图5)。
3 讨论
骨髓间充质干细胞的标记方法众多,目前,由于磁对比剂标记细胞进行MRI活体示踪具有非侵袭性、可重复性、动态性等特点,故利用MRI定位及监测移植细胞迁徙情况已成为重要的研究手段[7-8]。其中,超顺磁性氧化铁(SPIO)也已成为应用最为广泛的阴性对比剂[9]。
3.1 BMSCs 的SPIO标记
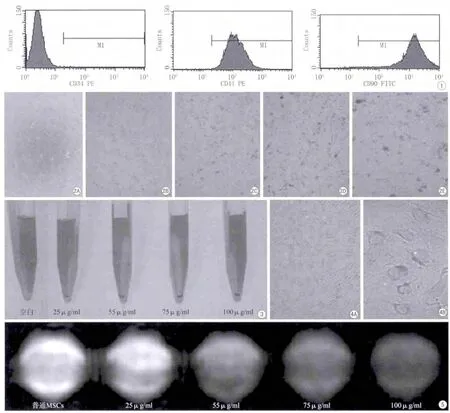
图1 流式细胞仪检测MSCs表面抗原CD34、CD44及CD90的结果 图2 A为未标记的BMSCs;B~E分别为25 μg/ml、50 μg/ml、75 μg/ml及100 μg/ml SPIO标记48 h的BMSCs ( ×100) 图3 SPIO标记:不同浓度SPIO标记BMSCs 48 h,离心后细胞的团块 图450 μg/ml SPIO标记BMSCs48h后普鲁士蓝染色(A: ×100;B: ×200) 图5 不同浓度SPIO (μg/ml)标记BMSCs的MR图像Fig.1 Detection of MSCs surface antigen CD34, CD44 andCD90 by fl ow cytometry. Fig.2 A: unlabeled BMSCs.B—E: BMSCs labeled with different concentration in 25 μg/ml, 50 μg/ml, 75 μg/ml and 100 μg/ml after 48 h ( ×100). Fig.3 BMSCs labeled with different concentration of SPIO for 48 h after centrifugation. Fig.4 BMSCs labeled with 50 μg/ml SPIO for 48h after the Prussian blue staining (A: ×100.B: × 200). Fig.5 MR images of BMSC labeled with different concentrations of SPIO (μg/ml).
SPIO的核心结构为氧化铁颗粒(3~5 nm),其表面带有负电荷,由于细胞膜也带负电荷,因此未经表面修饰的SPIO纳米颗粒很难进入细胞内[10-11]。多聚赖氨酸(PLL)(常用转染剂之一),其表面带有正电荷,通过静电作用与表面带有负电荷的SPIO颗粒结合,可促进细胞胞吞噬或胞饮,从而提高细胞标记率[12]。本研究采用PLL修饰SPIO,即PLL-SPIO,对干细胞标记的成功率非常高,经普鲁士蓝染色后发现SPIO浓度分别为25 μg/ml、50 μg/ml、75 μg/ml及100 μg/ml时体外标记BMSCs的细胞阳性率分别为99%、100%、100%、100%。倒置显微镜下及细胞离心后观察,胞质内细胞核周围可见到聚积的褐色颗粒物及试管内褐色的细胞团块,且随着SPIO的浓度增加其细胞团块颜色也逐渐加深,再次印证了细胞内的铁颗粒浓度与加入培养液内的SPIO浓度呈正相关,这与Daldrup-Link等[13]的结果一致。
3.2 SPIO标记对BMSCs生物学特性的影响
虽然SPIO的标记浓度越高,细胞的标记率越高,MR成像的效果会越好,但标记浓度过高会影响细胞的生物学活性及其增殖能力[14],从而影响到活体成像的追踪观察;而适宜浓度SPIO标记BMSCs并不影响体外干细胞的生物学特性及多向分化能力[15-16]。因而选择适宜的标记浓度至关重要。
本实验结果显示,SPIO浓度为25 μg/ml、50 μg/ml的SPIO标记后的BMSCs生长状态良好,能够保持细胞原有的梭形形态,正常贴壁生长并传代,台盼兰活细胞计数实验及MTT细胞增殖检测证实标记后的细胞仍具有较高的活性及增殖能力。以上实验结果与Arbab等[17]及Ben-Hur等[18]研究结果相似。而当SPIO浓度为75 μg/ml和100 μg/ml时,活细胞率分别为92.70%和90.41%,明显低于对照组,且细胞增殖明显受到抑制,说明当SPIO浓度过高时会对细胞产生一定的毒性作用。这可能与细胞内非结合的铁能使氧化作用加强,形成过多的氧化产物和羟基自由基,造成细胞损伤,甚至导致细胞坏死有关[19]。
3.3 体外MRI成像
经SPIO标记BMSCs的MRI成像观察,证实SPIO主要缩短了T2*及T2弛豫时间,1×103/ml的细胞浓度就能引起明显的信号变化[20],且经表面转染的SPIO标记是观察所标记干细胞的最有效方法[16]。在本研究MRI上,观察到SPIO标记48 h的各组细胞悬液的信号强度,与未标记对照组BMSCs相比较,均表现为不同程度的低信号,但SPIO标记浓度为25 μg/ml时,与普通BMSCs相比较,信号强度的差异无统计学意义;当SPIO浓度≥50 μg/ml时,标记细胞的T2信号强度与普通BMSCs相比较均有明显差异(P<0.05),随着SPIO浓度的增加信号强度也逐渐降低,这也说明随着SPIO标记浓度的增加,进入到细胞内的SPIO也有所增加,产生了更为明显的负性对比效应,这与Lee等[21]报道一致。
本研究标记方法简单易行且安全有效,同时MRI能够探测到干细胞在活体内的分布和迁移[15]。但该方法还存在不足之处:由于MRI只能观察标记细胞的铁含量变化,故只能对标记细胞起示踪依据,不能对标记细胞的定量和定性分析,无法分析细胞的增殖及分化情况,所以影响以后干细胞在体内移植后的观察价值。相信分子影像技术的运用和标记方法的改进是未来研究的方向。另外Rosenberg等[22]发现SPIO标记hMSCs在缺血缺氧环境下其细胞活性大幅降低,所以该标记方法运用于脑缺血动物模型的影响,有待更多的试验证实。同时,王建东等[23]发现铁蛋白与SPIO相互作用,并可以延长MRI活体细胞示踪时间,克服了SPIO无法长期标记示踪的缺陷。
总之,本研究通过全骨髓直接贴壁法能在体外成功培养并扩增出大鼠BMSCs,经形态学、分化潜能及流式细胞仪鉴定证实;采用浓度为25~50 μg/ml的SPIO联合0.75 μg/ml PLL体外标记大鼠BMSCs安全、可靠,不会对细胞的表型、活力和增殖等生物学特性产生明显的影响;MR扫描在T2WI序列上能有效观察到浓度为50 μg/ml标记SPIO标记BMSCs 48 h后的信号变化。
[References]
[1]Pittenger MF, Mackay AM, Beck SC, et al.Multilineage potential of adult human mesenchymal stem cells.Science, 1999, 284(5411):143-147.
[2]Petersen BE, Bowen WC, Patrene KD, et al.Bone marrow as a potential source of hepatic oval cells.Science, 1999, 284(5417):1168-1170.
[3]Sanchez-Ramos J, Song S, Cardozo-Pelaez F, et al.Adult bone marrow stromal cells differentiate intoneural cells in vitro.ExpNeurol, 2000,164(2): 247-56.
[4].Salem HK, Thiemermann C.Mesenchymal stromal cells: current understanding and clinical status.Stem Cells, 2010, 28(3): 585-596.
[5]Chen A, Siow B, Blamire AM, et al.Transplantation of mag- netically labeled mesenchymal stem cells in a model of perinatal brain injury.Stem Cell Res, 2010, 5(3): 255-266.
[6]Hokai M, Kuroda S, Shichinohe H, et al.Bone marrow stromal cells protect and repair damaged neurons through multiple mechanisms.Neurosci Res, 2008, 86(5): 1024-1035.
[7]Bulte JW, Kraitchman DL.Monitoring cell therapy using iron oxide MR contrast agents.Curr Pharm Biotechnol, 2004, 5(6): 567-584
[8]Cao J, Wang YN, Kong LY, et al.Magnetic resonance imaging of injected adipose derived stem cells (ADSCs) in rat myocardial infarction: the feasibility of cell tracking and left ventricular function measurement in vivo.Chin J Magn Reson Imaging, 2011, 2(5):337-342.曹剑, 王怡宁, 孔令燕, 等. 活体MR成像监测移植干细胞治疗SD大鼠心肌梗死并评价左心功能的可行性研究.磁共振成像, 2011,2(5): 337-342.
[9]Frank JA, Miller BR, Arbab AS, et al.Clinically app licablelabeling of mammalian and stem cells by combining superparamagnetic iron oxides and transfection agents .Radiology, 2003, 228(4): 480-487.
[10]Ittrich H, Lange C, Togel F, et al.In vivo magnetic resonance imaging of iron oxide-labeled, arterially-injected mesenchymal stem cells in kidneys of rats with acute ischemic kidney injury: detection and monitoring at 3 T.J Magn Reson Imaging, 2007, 25(6): 1179-1191.
[11]Smirnov P, Lavergne E, Gazeau F, et al.In vivo cellular imaging of lymphocyte trafficking by MRI: a tumor model approach to cell-based anticancer therapy.Magn Reson Med, 2006, 56(3): 498-508.
[12]Neri M, Madema C, Cavazzin C, et al.Eficient in vitro labeling of human neural precursor cells with superparamagnetic iron oxide particles: relevance for in vivo cell tracking.Stem Cells, 2008, 26(2):505-516.
[13]Daldrup-Link HE, Rudelius M, Oostendorp RA, et al .Targeting of hematopoietic progenitor cells with MR contrast agents.Radiology,2003, 228(3): 760-767.
[14]Arbab AS, Bashaw LA, Miller BR et al.Characterization of biophysical and metabolic properties of cells labeled with superparamagnetic iron oxide nanoparticles and transfection agent for cellular MR imaging.Radiology, 2003, 229(3): 838-846.
[15]Guo RM, Cao N, Zhang F,et al.Controllable labelling of stem cells with a novel superparamagnetic iron oxide–loaded cationic nanovesicle for MR imaging.Eur Radiol, 2012, 22(11): 2328-3237.
[16]Schafer R,Kehlbach R,Wiskirchen J, et al.Transferrin receptor upregulation: in vitro labeling of rat mesenchymal stem cells with superparamagnetic iron oxide.Radiology, 2007, 244(2): 514-523.
[17]Arbab AS, Wilson LB, Ashari P, et al.A model of lysosomal metabolism of dextran coated superparamagnetic iron oxide (SPIO)nanoparticles: implications for cellular magnetic resonance imaging.NMR Biomed, 2005, 18(6): 383-389.
[18]Ben-Hur T, van Heeswijk RB, Einstein O, et al.Serial in vivo MR tracking of magnetically labeled neural spheres transplanted in chronic EAE mice.Magn Reson Med, 2007, 57(1): 164-171.
[19]Emerit J, Beaumont C, Trivin F.Iron metabolism, free radicals, and oxidative injury.Biomed Pharmacotherapy, 200l, 55(6): 333-339.
[20]Gao ZH, Hu XS, Cai HS, et al.Study of SPIO labeled rabbit BMSCs biological characteristics and in vitro MRI imaging.Chin J CT MRI,2012, 10(5): 1-4.高振华, 胡晓书, 蔡华松, 等.SPIO标记兔BMSCs的生物学特性及体外MRI显像研究.中国CT和MRI杂志, 2012, 10(5): 1-4.
[21]Lee JH, Jung MJ, Hwang YH, et al.Heparin-coated superparamagnetic iron oxide for in vivo MR imaging of human MSCs.Biomaterials,2012, 3(35): 4861-4871.
[22]Rosenberg JT, Sellgren KL, Sachi-Kocher A, et al.Magnetic resonance contrast and biological effects of intracellular superparamagnetic iron oxides on human mesenchymal stem cells with long-term culture and hypoxic exposure.Cytotherapy, 2013, 15(3): 307-322.
[23]Wang JD, Hu QJ, Zhu FP, et al.Ferritin coordinates with SPIO in tracking C6 rat glioma cells by MRI.Chin J Magn Reson Imaging,2010, 1(4): 299-304.王建东, 胡秋菊, 朱飞鹏, 等.铁蛋白与SPIO在磁共振细胞活体示踪中的增效作用.磁共振成像, 2010, 1(4): 299-304.
