昆虫毒蕈碱型乙酰胆碱受体的分子进化、功能及药理学研究
2014-12-09张雅林吕淑敏
姜 鸣,张雅林,吕淑敏
(西北农林科技大学植保资源与病虫害治理教育部重点实验室,陕西杨凌 712100)
乙酰胆碱受体(acetylcholine receptor,AchR)是昆虫神经系统中一种十分重要的神经递质受体,参与昆虫各种神经生理活动。与脊椎动物类似,在昆虫体内亦存在烟碱型(N 型)受体(nicotine acetylcholine receptor,nAchR)和毒蕈碱型 (M型) 受 体 (muscarinic acetylcholine receptor,mAchR)两种受体。20 世纪90年代初,新烟碱型杀虫剂成功研发,其作用靶标N 型受体成为昆虫分子生物学研究的一个热点领域,学者们从药理学和分子水平对其进行了广泛而深入的研究(Barbara et al.,2008;尚庆利等,2009;赵宇等,2009)。但昆虫M 型受体的研究远远落后于N 型受体。早在1981年Breer 提出昆虫体内存在M 型受体,1989年首次从果蝇Drosophilia melanogaster 体内克隆获得昆虫第一个M 型受体基因序列(Onai et al.,1989),随后通过虫体药理学和免疫组织化学方法研究发现M 型受体参与昆虫神经元轴突的延伸、表皮的形成(Clark et al.,2005),调节昆虫的迁飞 (Oliveira et al.,2010)、鸣声、求偶(Hoffmann et al.,2007;Heck et al.,2009)及学习记忆等行为 (Ismail et al.,2006;Guez et al.,2010),是农药开发的一个潜在靶标,具有很大的开发和应用价值(Honda et al.,2007)。本文就国内外对昆虫M 型受体的研究进展作一简要综述,并对GenBank 中已上传的昆虫M 型受体序列进行分子进化分析。
1 毒蕈碱型乙酰胆碱受体概述
M 型受体是一种单链跨膜糖蛋白,分子量大约在51-66 kDa,由460-590 个氨基酸残基组成(王昊等,2002),通过与异三聚体鸟苷酸结合蛋白(G 蛋白)偶联介导信号转导过程,属于G 蛋白偶联受体(G Protein Coupled Receptor,GPCR)超家族。此类受体的基本结构特征是具有七个跨膜螺旋结构,其中七个跨膜区(TMI-TMVII)由三个胞外环(O1-O3)和三个胞内环(I1-I3)连接而成,其氨基端位于细胞外侧,羧基端位于细胞内侧。随着分子生物学的发展,目前已经从脊椎动物体内克隆获得5种M 型受体亚型(Eglen et al.,1999;Richards,1991),这五个亚型之间氨基酸序列很相似,其中7 个跨膜区的氨基酸序列相似性最高,3 个胞外环和I1、I2 胞内环也比较保守,变异较大的区域主要在N 末端、C 末端及第3 个胞内环,其中以第3 个胞内环的变异最大,该区域是M 型受体与G 蛋白结合并引起生物学效应的主要部位。根据这五个亚型所转导的信号途径不同又可分为两大类即Ⅰ类(M1/M3/M5)和Ⅱ类(M2/M4):Ⅰ类是激活Gq,通过磷脂酸肌醇系统,激活磷脂酶C (PLC),生成肌醇1,3,4,三磷酸(IP3)和甘油二酯(DAG),最终使细胞内Ca2+浓度升高而发挥作用。Ⅱ类是激活Gi,抑制腺苷酸环化酶,从而降低胞内cAMP 水平(Kohn et al.,1996;Eglen et al.,2001;Stefan et al.,2001)。而且这5种M 型受体亚型都可以被毒蕈碱激动剂激活,被阿托品所拮抗(Tobin et al.,2009;Harvey,2012)。有研究认为脊椎动物的第6 个M 型受体已被克隆 (Goodearl et al.,1999),但目前尚无M6 亚型的药理学及生理功能方面的报道。于海龙等2007年通过生物信息学方法,从进化、序列相似性、表达相关性、蛋白互作等多个角度对M 型受体亚型之间的关系进行了研究,结果认为,脊椎动物M 型受体的5种亚型在某些组织中正表达相关,呈现共表达趋势,这提示着不同受体亚型在执行不同的生理功能,并彼此相互调节。最近在脊椎动物的研究中发现胆碱能系统不仅参与神经生理活动,而且还与神经系统的发育及突触结构的维持密切相关(Wright et al.,2009;Abreu-Villaca et al.,2011),并参与细胞的增殖、程序性死亡及神经细胞的分化(Resende and Adhikari,2009)。
昆虫中,在果蝇全基因组序列获得之前,药理学研究认为昆虫体内亦存在多种M 型受体亚型,并提出昆虫M 型受体的分型与脊椎动物M 型受体的分型不一定完全吻合(Hannan and Hall et al.,1993)。从1989年昆虫的第一个M 型受体基因克隆,一直未从分子水平验证昆虫中存在其他M 受体亚型,直到2013年3月才发现昆虫中存在两种M 型受体,根据药理学特征分为A 亚型和B 亚型,其中A 亚型受体与脊椎动物M 型药理学特征类似,可被乙酰胆碱、毒蕈碱激动剂所激活,被经典的拮抗剂阿托品、东莨菪碱 及二苯乙醇酸-3-奎宁环酯(QNB)所拮抗;而B 亚型受体药理学特征与脊椎动物M 型受体差别较大,其可被乙酰胆碱激活,但对毒蕈碱敏感性要比乙酰胆碱低1000 倍,而上述经典的拮抗剂对其不起作用(Collin et al.,2013)。因此,Collin 等将脊椎动物M 型受体的5个亚型归于A 亚型受体。昆虫A 亚型受体主要存在于神经系统,主要功能是参与神经生理活动,是杀虫剂的潜在靶标。由于昆虫B 亚型受体刚发现,对其功能研究甚少。
2 昆虫M 型受体的克隆与表达
2.1 昆虫M 型受体基因的克隆与分子进化
Onai 等1989年首次通过分子克隆方法从果蝇体内获得昆虫的第一个M 型受体基因序列,命名为DM1,定位在果蝇第二条染色体的右臂,该受体与脊椎动物M3 受体序列的相似度最高。随着分子生物学的发展,更多的昆虫基因组序列被测序,通过电子克隆方法获得了多个已知全基因组序列的昆虫物种M 型受体序列A 亚型,随着今年B 亚型受体的发现,Collin 等(2013)对已知基因组的昆虫及其他节肢动物B 亚型受体进行了电子克隆,发现在原口动物中存在多种B 亚型受体现象,但仅有1种A 亚型受体;而后口动物中仅存在A 亚型,未发现B 亚型存在。为了确定已知的昆虫M型受体序列A 亚型及B 亚型与脊椎动物5 个亚型(同属于A 型)之间的关系,我们选取GenBank 中收录的12种昆虫和3种蜱螨类A 亚型受体、5种昆虫及1种蜱螨类B 亚型受体以及大鼠Rattus norvegicus 5 个M 受体亚型的氨基酸序列,利用Mega 5.0 软件基于NJ 法构建了分子进化树如图1所示。分子进化树分析结果,恰与Collin 等对其药理学分析一致。即具有相似药理学特征的无脊椎动物A 亚型与脊椎动物M 型受体5种亚型聚为一支,而具有独特药理学特征的无脊椎动物B 亚型单独聚为一支。在脊椎动物中,M 型受体各亚型分成的两大分支刚好与药理学的Ⅰ类和Ⅱ类相吻合。在无脊椎动物A 亚型中,昆虫纲Insecta 与蛛形纲Arachnida 各聚为一支。昆虫中,同翅目的豌豆蚜Acyrthosiphon pisum A 亚型从双翅目和膜翅目中分离出来作为单独一支,另一分支自上而下分别为膜翅目、鞘翅目和双翅目A 亚型,并以物种间的亲缘关系而聚类。相对于B 亚型来说,无脊椎动物与脊椎动物A 亚型受体在进化上是相对保守的,推测A 亚型可能是M 受体较古老的亚型,B 亚型可能是在A 亚型的基础上突变进化而来,而脊椎动物A 亚型中的5 个亚型可能是A 亚型在进化中通过复制进化而来(Collin et al.,2013)。因此,无脊椎动物与脊椎动物的M 型受体分子可能在很早以前就已经分化出来。但无脊椎动物M型受体除了A 亚型和B 亚型外是否还存在其他亚型?有关其分型问题有待于从分子生物学、药理学及其他角度进一步探讨。
2.2 昆虫M 型受体的组织分布与功能
对昆虫M 型受体的功能研究主要集中于A 亚型,B 亚型2013年才发现,对其研究甚少。昆虫第一个M 型受体基因被克隆后,有关其组织分布及功能研究受到广泛关注。目前已经对双翅目、鳞翅目、膜翅目等多种昆虫的M 型受体A 亚型进行了免疫组织化学定位研究。基于果蝇DM1 多克隆抗体的免疫细胞化学研究发现,果蝇DM1 受体蛋白仅表达于神经系统,肌肉系统内不表达,而神经系统中以触角叶位置表达量最高,说明果蝇DM1 与嗅觉信息的神经传递相关(Blake et al.,1993;Harrison et al.,1995)。Aizono 等 (1997)对家蚕Bombyx mori 脑部A 亚型受体和促前胸腺激素PTTH 共定位研究发现,A 亚型受体在家蚕脑部神经系统广泛表达,而且其与PTTH 在两簇背神经分泌细胞及多处神经纤维中呈现共表达模式,推测家蚕A 亚型可能调节PTTH 神经分泌细胞中PTTH 激素的释放。Clark 等(2005)利用商品化单克隆抗体m35 (Argene,Varilhes,France 10-217)对烟草天蛾Manduca sexta 触角发育过程中M型受体的表达进行了组织学定位研究,结果发现M 型受体蛋白不仅限于神经元表达,而且在神经胶质细胞和表皮细胞均有表达。发育了4-5 d 的成虫该受体主要分布于触角神经的轴突位置,发育4-9 d,上皮细胞基部的感觉神经元胞体具有较强的阳性反应,说明神经元和神经胶质细胞间胆碱的通讯可能调节着轴突的延伸。而即将分化为表皮细胞的上皮细胞上存在胆碱能系统可能与表皮的形成相关。拟黑多刺蚁P.vicina mAchR mRNA 不仅表达于成虫的脑部神经系统,而且在卵期及幼虫整个发育阶段均有表达,说明mAchR可能参与了昆虫发育行为(吕淑敏等,2010)。对脑部的mAchR mRNA 原位杂交定位研究发现,其在各个品级蚂蚁脑部广泛表达。除了蕈形体萼部和领部阳性反应比较弱外,其他部位均有阳性神经元胞体和神经纤维存在,并呈现不同的表达模式,其中以脑部蕈形体、视叶和嗅叶的阳性反应最强,推测M 型受体可能参与视觉和嗅觉信息的获取与整合(Lü et al.,2011)。以上结果说明,M型受体A 亚型广泛存在于昆虫神经系统,不仅于神经元表达,而且在神经胶质细胞和上皮细胞中均有表达,生理功能除了调节神经生理活动,还参与神经元轴突的延伸,表皮的形成及激素的释放,昆虫发育等,但其具体调节机制还需深入研究。RNAi 技术在昆虫基因功能研究中已经很成熟,今后结合RNAi 技术进一步开展昆虫M 型受体功能研究将是一个重要的方向。
3 昆虫M 型受体的药理学分析及信号转导途径
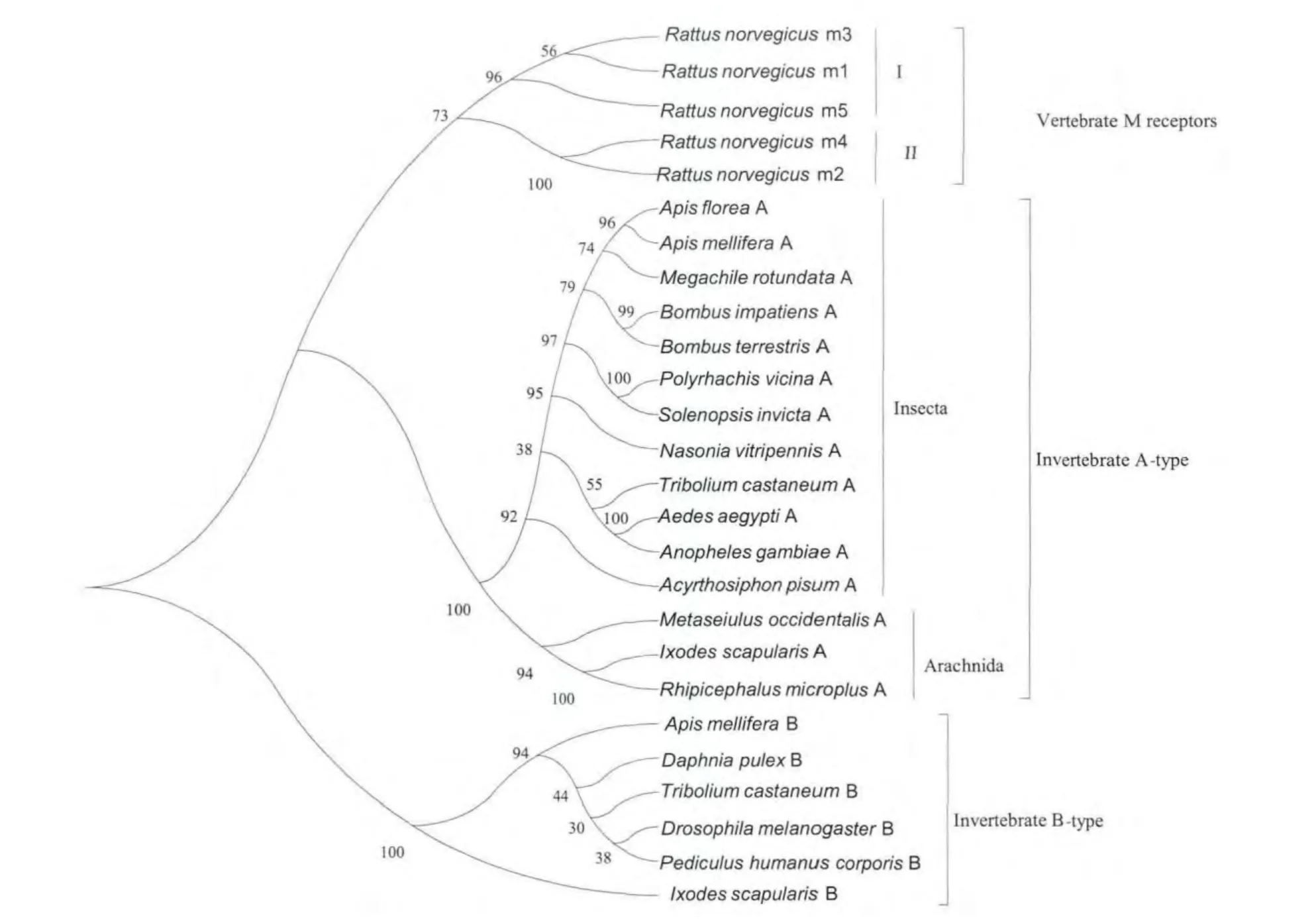
图1 昆虫mAchR 分子进化树(Mega 5.0)Fig.1 Phylogenetic tree of insects mAchR (Mega 5.0)
关于昆虫M 型受体的药理学分析主要从以下两个方面展开,一是虫体药理学方法,即给虫体注射M 型受体通路的激动剂或拮抗剂,观察对虫体的影响,进而分析功能。二是细胞药理学方法,将M 型受体通过表达载体导入细胞,通过M 型受体的激动剂和拮抗剂检测其胞内的信号通路。目前仅有果蝇和T.castaneum A 亚型及B 亚型细胞药理学研究报导。药理学分析认为果蝇DM1 的药理学特征与脊椎动物M1 和M3 相似(Blake et al.,1993;Millar et al.,1995;Aizono et al.,1997;Collin et al.,2013),将DM1 基因异源表达于不同的脊椎动物细胞及果蝇S2 细胞系,被激动剂激活后可以促进胞内Ca2+和IP3 的积累 (Reaper et al.,1998;Cordova et al.,2003;Collin et al.,2013)。氨甲酰胆碱 (Carbamylcholine,CCh)和氧化震颤素oxotremorine 是果蝇DM1 的潜在激动剂,而适用于脊椎动物M1 受体的激动剂McN-A-343 反应很弱。当S2-DM1 受体被CCh 激活后,胞内Ca2+浓度上升(Cordova et al.,2003)。说明果蝇DM1 的信号转导途径与脊椎动物M 型受体Ⅰ类相似,通过磷脂酸肌醇系统,最终使胞内第二信使Ca2+浓度上升。而昆虫B 亚型可被乙酰胆碱激活并使胞内Ca2+浓度上升,但不被M 受体通用拮抗剂所拮抗(Collin et al.,2013)。有关B 亚型的药理学研究还需进一步开展,通过计算机辅助药物设计进行高通量筛选将是一个重要方向。
对蜜蜂虫体药理学研究发现,给蜜蜂食用毛果芸香碱和毒蕈碱将导致脑部神经纤维网体积增大,其效果与已训练一周具有觅食经验的工蜂类似,该效果可被一种毒蕈碱拮抗剂东莨菪硷scopolamine 所抵消。结合行为训练和组织学分析表明,M 型受体的激活与蜜蜂脑部的可塑性相关,可以诱导神经元细胞内基因的表达从而影响经验依赖性的学习记忆行为(Ismail et al.,2006;Guez et al.,2010)。雄性蝗虫脑部中央复合体内小剂量注射毒蕈碱激动剂时,将导致其鸣声更尖锐且持续时间更长,而伴随这发声的间隔缩短,而且毒蕈碱诱导的发声可被腺苷酸环化酶的两种抑制剂2-5-dideoxyadenonsine、SQ22536 和PKA 的两种抑制剂U-73122、neomycin 所抑制。在注射毒蕈碱有效的脑部部位注射3-isobuty-1-methylxanthine、腺苷酸环化酶和PKA 的催化剂forskolin 时,同样也能激起鸣声 (Heinrich et al.,2001;Wenzel et al.,2002;Hoffmann et al.,2007;)。说明昆虫M 型受体可以调节蝗虫的鸣声,而且AC/cAMP/PKA 和PLC/IP3/diacylglycerine 传导通路是M 型受体兴奋传导所必需的,与果蝇DM1 受体信号转导系统研究结果一致。
昆虫胆碱能神经传递是当前杀虫剂的一个主要靶标,其机理是抑制乙酰胆碱酯酶或异常激活/抑制N 型受体起到杀虫效果。学者们对果蝇和家蝇M 型受体的研究中发现存在一些激动剂或抑制剂可以中强度的杀灭昆虫(Miller et al.,1991;Reaper et al.,1998),并提出毒蕈碱型乙酰胆碱受体是杀虫剂的一个潜在靶标。Honda 等 (2007)等利用哺乳动物M 型受体信号通路的8种激动剂和11种拮抗剂对果蝇和家蝇进行药理学筛选研究,发现有部分激动剂和拮抗剂可以明显影响家蝇和果蝇的行为,并提出以M 型受体为靶标的杀虫剂可以避免已有杀虫剂所带来的交叉抗药性。但目前市场上还没有商业化的以M 型受体为靶标的杀虫剂,有关昆虫M 型受体在杀虫剂方面的应用还有待于进一步研究。
4 小结与展望
M 型受体是昆虫胆碱能受体研究中的一个薄弱环节。前人基于已克隆获得的果蝇DM1 序列,主要展开以下两个方面的研究:一是根据果蝇DM1 序列制备多克隆抗体,在多种昆虫中进行组织定位即生理学功能方面的研究;二是根据脊椎动物M 型受体的激动剂和拮抗剂,进行药理学特性方面的研究。这些研究证实昆虫M 型受体与其体内的N 型受体类似,在昆虫体内起着重要作用,调节昆虫的多种行为活动;从药理学角度验证昆虫体内也存在多种亚型的M 受体,目前从分子方面已验证昆虫中存在A 亚型和B 亚型两种受体,但B 亚型2013年刚发现,对其研究甚少。昆虫M 型受体的研究远远落后于N 型受体,主要体现在:(1)GenBank 中实验验证获得M 型受体的基因数据缺乏;(2)M 型受体的分型情况尚未了解清楚;(3)生理功能研究认为M 型受体参与昆虫多种行为活动,但其作用机理及信号转导途径还需进一步研究;(4)M 型受体作为杀虫剂的一个潜在靶标,目前市场上还未有商品化的以此为靶标的农药存在。因此,加强对昆虫M 型受体分子机制、信号转导途径及药理学方面的研究,有助于全面深入地了解昆虫胆碱的神经传递机制,特别是无脊椎动物中独有的B 亚型,对其功能研究将为发现新的杀虫作用靶标,创制新的杀虫剂提供新思路。
References)
Abreu-Villaça Y,Filgueiras CC,Manhães AC.Developmental aspects of the cholinergic system [J].Behav.Brain.Res.,2011,221:367-378.
Aizono Y,Endo Y,Sattelle DB,et al.Prothoracicotropic hormone-producing neurosecretory cells in the silkworm,Bombyx mori,express a muscarinic acetylcholine receptor [J].Brain Res.,1997,763:131-136.
Barbara GS,Grünewald B,Paute S,et al.Study of nicotinic acetylcholine receptors on cultured antennal lobe neurones from adult honeybee brains [J].Invert.Neurosci.,2008,8:19-29.
Blake AD,Anthony NM,Chen HH,et al.Drosophila nervous system muscarinic acetylcholine receptor:transient functional expression and localization by immunocytochemistry [J].Mol.Pharmacol.1993,44:716-724.
Breer H.Properties of putative nicotinic and muscarinic cholinergic receptors in the central nervous system of Locusta Migratoria [J].Neurochem.Int.,1981,3:43-52.
Clark J,Meisner S,Torkkeli PH.Immunocytochemical localization of cholineacety transferase and muscarinic Ach receptors in the antenna during development of the sphinx moth Manduca sexta [J].Cell Tissue Res.,2005,320:163-173.
Collin C,Hauser F,de Valdivia EG,et al.Two types of muscarinic acetylcholine receptors in Drosophila and other arthropods [J].Cell Mol.Life Sci.,2013,DOI 10.1007/s00018-013-1334-0.
Cordova D,Raymond DV,Sattelle DB,et al.Spatiotemporal calcium signal in a Drosophila melanogaster cell line stably expressing a Drosophila muscarinic acetylcholine receptor [J].Invert.Neurosci.,2003,5:19-28.
Eglen RM,Chopin A,Dillon MP,et al.Muscarinic receptor ligands and their therapeutic potential [J].Curr.Opin.Chem.Biol.,1999,4:426-432.
Eglen RM,Choppin A,Watson N,Therapeutic opportunities from muscarinic receptor research [J].Trends Pharmacol.Sci.,2001,22:409-414.
Goodearl,Andrew DJ.Nucleic acids encoding muscarinic receptors and uses therefor [P].United States Patent,5882893.March 16,1999.
Guez D,Zhu H,Zhang SW,et al.Enhanced cholinergic transmission promotes recall in honeybees [J].J.Insect Physiol.,2010,56:1341-1348.
Hannan F,Hall LM.Muscarinic acetylcholine receptors in invertebrates:comparison with homologous receptors from vertebrates [C].In:Comparative Molecular Neurobiology.1993,Basel:Birkh¨auser,pp:98-145.
Harrison JB,Sattelle DB,Schaffer S,et al.Immunocyto-chemical localization of muscarinic acetylcholine receptors in antenal lobe glomeruli of Drosophila and Apis mellifera [J].J.Physiol.,1995,6:485-311.
Harvey RD.Muscarinic receptor agonists and antagonists:effects on cardiovascular function [J].Hanb.Exp.Pharmacol.,2012,208:299-316.
Heck C,Kunst M,Härtel K,et al.In vivo labeling and in vitro characterisation of central complex neurons involved in the control of sound production [J].J.Neurosci.Methods.,2009,183:202-212.
Heinrich R,Wenzel B,Elsner N.A role for muscarinic excitation:control of specific singing behavior by activation of the adenylate cyclase pathway in the brain of grasshoppers [J].Proc.Natl.Acad.Sci.U.S.A.,2001,98:9919-9923
Honda H,Tomizawa M,Casida JE.Insect muscarinic acetylcholine receptor:pharmacological and toxicological profiles of antagonists and agonists [J].J.Agric.Food Chem.,2007,55:2276-2281.
Hoffmann K,Wirmer A,Kunst M,et al.Muscarinic excitation in grasshopper song control circuits is limited by acetylcholinesterase activity [J].Zoolog.Sci.,2007,24:1028-1035.
Ismail N,Robinson GE,Fahrbach SE.Stimulation of muscarinic receptors mimics experience-dependent plasticity in the honey bee brain [J].Proc.Natl.Acad.Sci.U.S.A.,2006,103:207-211.
Kohn EC,Alessandro R,Probst J,et al.Identification and molecular characterization of a M5 muscarinic receptor in A2058 human melanoma cells.coupling to inhibition of adenylyl cyclase and stimulation of phospholiase A2 [J].J.Biol.Chem.,1996,271:17476-17484.
Lü SM,Jiang M,Pu CP,et al.Real-time quantitative RT-PCR detection for developmental expression of a muscarinic cholinergic receptor gene in the ant Polyrhachis vicina [J].Journal of Northwest A & F University (Nat.Sci.Ed.),2010,38:161-166.[吕淑敏,姜鸣,卜翠萍,等.拟黑多刺蚁mAchR 基因发育表达的荧光实时定量RT-PCR 检测[J].西北农林科技大学学报(自然科学版),2010,38:161-166]
Lü SM,Zhao Z,Zhang YL,et al.Cloning and expression analysis of a muscarinic cholinergic receptor from the brain of ant,Polyrhachis vicina [J].Arch.Insect Biochem.Phys.,2011,78:46-60.
Millar NS,Baylis HA,Reaper C,et al.Functional expression of a clonedDrosophila muscarini acetylcholine receptor in a stable Drosophila cell line [J].J.Exp.Biol.,1995,198:1843-1850.
Miller JH,Gibson VA,McKinney M.Binding of[3H]-AF-DX 384 to cloned and native muscarinic receptors [J].J.Pharmacol.Exp.Ther.,1991,259:601-607.
Oliveira EE,Pippow A,Salgado VL,et al.Cholinergic currents in leg motoneurons of Carausius morosus [J].J.Neurophysiol,2010,103:2770-2782.
Onai T,Fitzgerald MG,Arakawas S,et al.Cloning,sequence and chromosomal localization of a Drosophila muscarinic acetylcholine receptor [J].FEBS Lett.,1989,255:219-225.
Reaper CM,Fanelli F,Buckingham SD,et al.Antagonist profile and molecular dynamic simulation of a Drosophila melanogaster muscarinic acetylcholine receptor [J].Receptors Channels.,1998,5:331-345.
Resende RR,Adhikari A,Cholinergic receptor pathways involved in apoptosis,cell proliferation and neuronal differentiation [J].Cell Commun.Signal.,2009,7:20.
Richards MH.Pharmacology and second messenger interactions of cloned muscarinic receptors [J].Biochem.Pharmacol.,1999,42:1645-1653.
Shang QL,Liang P,Gao XW.Molecular cloning and sequence analysis of nicotinic acetylcholine receptor β1 subunit from Spodoptera exigua(Hübner)[J].Journal of Environmental Entomology,2009,31:197-202.[尚庆利,梁沛,高希武.甜菜夜蛾烟碱型乙酰胆碱受体β1 亚基基因的克隆与序列分析[J].环境昆虫学报,2009,31:197-202]
Stefan D,Chris J,Van K.Muscarinicreceptor in mammalian heart [J].Pharmacol.Res.,2001,44:161-182.
Tobin G,Giglio D,Lundgren O.Muscarinic receptor subtypes in the alimentary tract [J].J.Physiol.Pharmacol.,2009,60:3-21.
Yu HL,Xiao Y,Ai J,et al.Relationship between muscarinic acetylcholine receptor subtypes [J].Hereditas,2007,29 (10):1280-1288.[于海龙,肖云,艾静,等.毒蕈乙酰胆碱受体亚型关系的研究[J].遗传,2007,29 (10):1280-1288]
Wang H,Guo ZD,Li Z.Signal transduction between muscarinic acetylcholine receptors and GTP-binding proteins [J].Progress in Physiological Sciences,2002,33:230-234.[王昊,郭政东,李智.毒蕈碱样乙酰胆碱受体及其信号转导[J].生理昆虫进展,2002,33:230-234]
Wenzel B,Elsner N,Heinrich R.mAChRs in the grasshopper brain mediate excitation by activation of the AC/PKA and the PLC second-messenger pathways [J].J.Neurophysiol.,2002,87:876-888.
Wright MC,Potluri S,Wang X,et al.Distinct muscarinic acetylcholine receptor subtypes contribute to stability and growth,but not compensatory plasticity,of neuromuscular synapses [J].J.Neurosci.,2009,29:14942-14955.9
Zhao Y,Yang YH,Wu SW,et al.Cloning sequence analysis and developmental expression of a cDNA encoding nicotinic acetylcholine receptor α subunit from Plutella xylostella (L.)(Lepidoptera:plutellidae)[J].Acta Entomologica Sinica,2009,52:17-26.[赵宇,杨亦桦,武淑文,等.小菜蛾烟碱型乙酰胆碱受体α 亚基cDNA 的克隆、序列分析与不同发育阶段表达分析[J].昆虫学报,2009,52:17-26]
