聚丙烯酰胺凝胶电泳和毛细管电泳用于淋球菌多位点串联重复序列分型的评估
2014-12-09于瑞星尹跃平陈绍椿戴秀芹韩燕张国毅陈祥生
于瑞星 尹跃平 陈绍椿 戴秀芹 韩燕 张国毅 陈祥生
·技术与方法·
聚丙烯酰胺凝胶电泳和毛细管电泳用于淋球菌多位点串联重复序列分型的评估
于瑞星 尹跃平 陈绍椿 戴秀芹 韩燕 张国毅 陈祥生
淋球菌是引起淋病的致病菌,淋球菌感染不仅可引起新生儿失明等严重的并发症,还能够加速其他病原体及HIV感染[1]。近年来淋球菌分型方法报道较多,目前最常用的是淋球菌多抗原序列分型(NG-MAST)和多位点序列分型(MLST)分型,但这两种分型方法费用较高,不适合资源匮乏地区应用。多位点串联重复序列分型(multiple-locus variable number tandem repeat analysis,MLVA)是近年来用于淋球菌分型的一种方法,该分型方法是一种简单、价格便宜、易操作、结果客观的分型方法。本文的目的是比较聚丙烯酰胺凝胶电泳和毛细管电泳两种方法进行淋球菌MLVA分型的异同,以便选择最佳的实验方法。
一、对象
10株淋球菌临床分离菌株来自于中国医学科学院皮肤病研究所2012年性病门诊。标本的采集及保存方法根据2007年中国疾病预防控制中心下发的“全国淋球菌耐药监测实施方案”进行,收集淋球菌临床分离菌株,经初步鉴定后传代1次,洗于脱脂牛奶中,-70℃冰箱保存备用。标准菌株FA1090购于北京中原公司。
主要试剂:Taq DNA 聚合酶、dNTP、MgCl2、缓冲液(不含Mg+离子)、pBR322 DNA/MspⅠ PCR参照物、 丙烯酰胺、N,N′-亚甲基双丙烯酰胺、10%PBS、TEMED购于南京兴生生物技术有限公司。硝酸银、氢氧化钠、甲醛、无水乙醇、冰醋酸购于南京化学试剂厂。Tris-borate-EDTA缓冲液购于美国Sigma公司。
二、方法
1.淋球菌DNA的提取:将保存在-70℃冰箱的淋球菌临床分离株复苏,接种于淋球菌基础培养基,置于36℃5%CO2培养箱中过夜,挑取一满环菌,研磨至装有1 ml的双蒸水中,100℃加热10 min,1 409×g离心2 min,取上清即为DNA。
2.MLVA分型:PCR反应:依据文献[2]报道,选择7个淋球菌串联重复序列(variable number tandem repeat,VNTR)基因位点(表1)。聚丙烯胺凝胶方法所用引物委托英潍捷基贸易有限公司合成,毛细管电泳所用引物委托上海桑尼生物科技有限公司完成,上游引物用FAM标记。采用20 μl反应体系,实验浓度分别为Taq DNA聚合酶1 U,dNTP 200 μmol/L,上游引物 0.3 μmol/L,下游引物 0.3 μmol/L,MgCl22.5 μmol/L,缓冲液体积与MgCl2相同,双蒸水补充至反应体积。VNTR264基因位点PCR反应条件:94℃预变性5 min,94℃ 30 s,68℃ 30 s,70℃ 45 s,35个循环后,72℃延伸10 min。其他VNTR基因位点 PCR反应条件:96℃预变性3 min,96℃6 s,60℃6 s,72℃10 s,40个循环。在用FAM标记的引物PCR时,注意避光。
聚丙烯酰胺凝胶电泳:VNTR264和VNTR2048基因位点PCR产物电泳用6%聚丙烯酰胺凝胶,其余VNTR基因位点PCR产物用8%聚丙烯酰胺凝胶。将上述配置成的液体混匀后快速用移液器加满制胶板,平行放入齿梳,静置30 min后拔掉齿梳,将2 μl样品和1 μl溴酚蓝混匀后加入加样孔,加2 μl pBR322 DNA/MspI PCR参照物及FA1090菌株相应VNTR基因位点的PCR产物。向电泳槽中倒入1×TBE电泳缓冲液,80 V 55 min后,将聚丙烯酰胺凝胶按照文献[3]方法快速银染。
毛细管电泳:将N002-N011淋球菌临床分离菌株及FA1090菌株全部VNTR基因位点PCR产物避光-20℃保存,委托上海桑尼生物技术有限公司进行毛细管电泳。

表1 引物序列、重复片段大小及侧翼大小
FA1090 菌 株测序:FA1090 菌 株 VNTR264、VNR471、VNTR947、VNTR1609、VNTR1638、VNTR2048、VNTR218 基 因 位点PCR产物测序委托上海桑尼生物科技有限公司完成。
3.结果分析:在PubMed利用BLAST比对,分析FA1090菌株 VNTR264、VNTR471、VNTR947、VNTR1609、VNTR1638、VNTR2048、VNTR2148基因位点 PCR产物测序序列与Kushnir等[4]报道是否一致。依据文献[1]报道,参照pBR322 DNA/MspⅠ PCR marker及FA1090菌株相应VNTR基因位点PCR产物的条带位置,确定不同菌株VNTR基因位点PCR产物的大小范围;然后根据表2中不同VNTR基因位点PCR产物大小所对应的重复次数,确定不同菌株VNTR基因位点PCR产物的重复次数。将上海桑尼科技有限公司毛细管电泳结果利用Peak Scanner和Gene Marker软件分析数据,确定不同VNTR基因位点PCR产物重复次数。
三、结果

表2 不同VNTR基因位点PCR产物大小所对应的重复次数(bp)
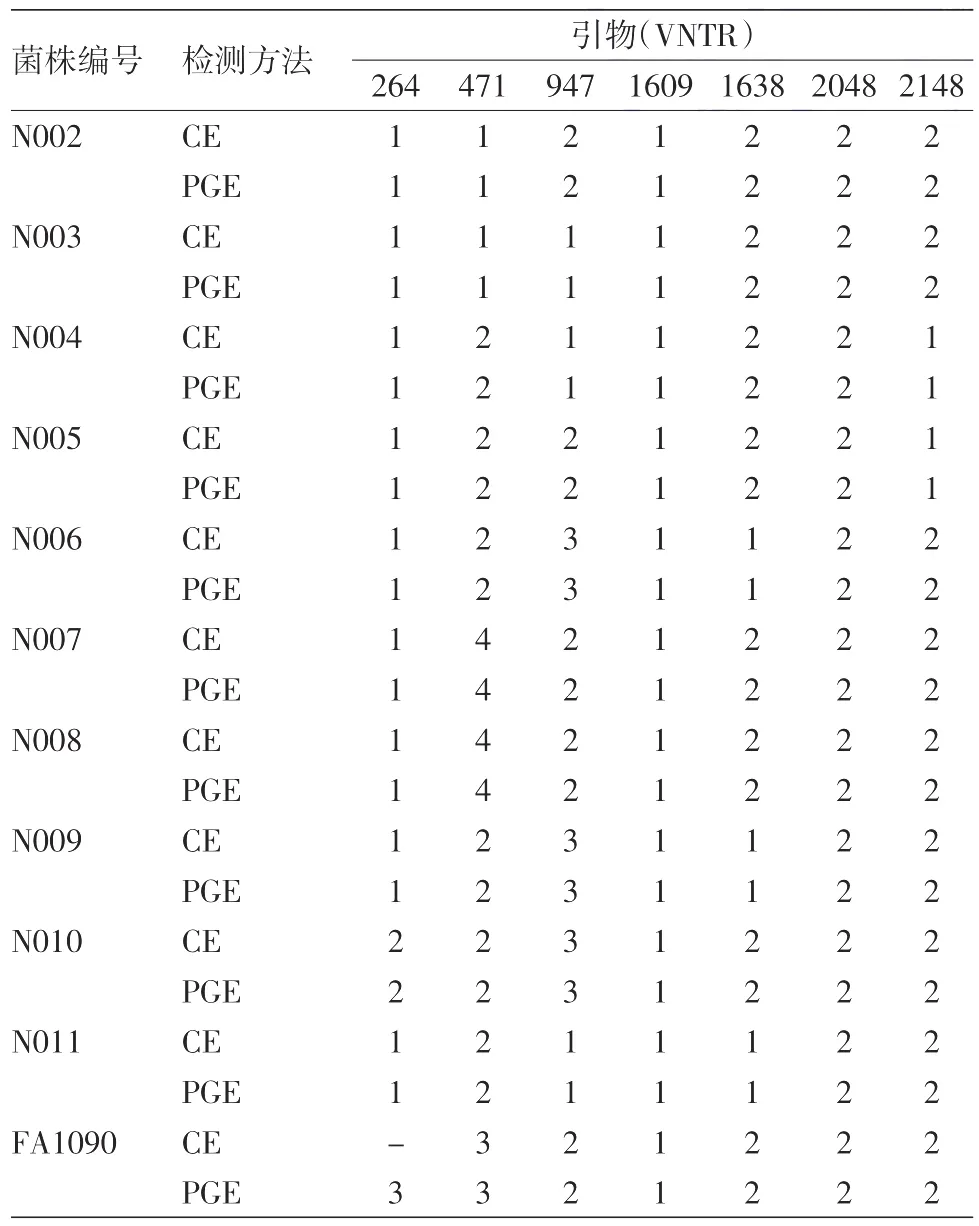
表3 毛细管电泳和聚丙烯酰胺凝胶电泳结果比较
1.FA1090测序结果:VNTR264、VNTR471、VNTR947、VNTR1609、VNTR1638、VNTR2048和 VNTR2148基因位点的PCR产物测序序列与文献[4]报道的序列一致,即这7对引物可用于相应VNTR基因位点PCR扩增、MLVA分型。

图1 VNTR471 PCR产物聚丙烯酰胺凝胶电泳图 1:淋球菌临床分离菌株N008;2:标准菌株FA1090;3:标准菌株FA1090;4:淋球菌临床分离菌株N004;5:淋球菌临床分离菌株N002;M:标准参照物
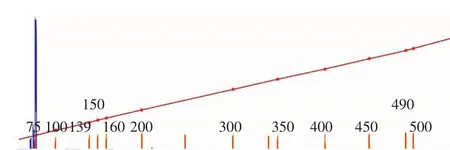
图2 标准菌株FA1090 VNTR471 PCR产物毛细管电泳图 蓝色峰为FA1090菌株VNTR PCR产物,黄色峰为内标LIZ500,从左到右依次增大
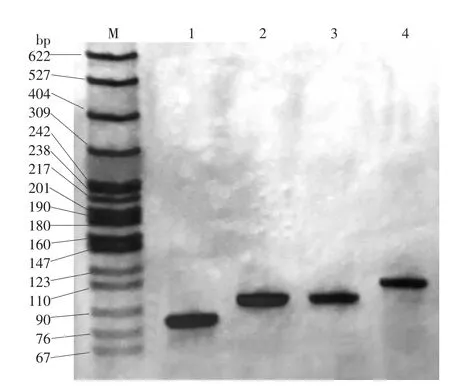
图3 VNTR947 PCR产物聚丙烯胺凝胶电泳图 M:标准参照物;1:淋球菌临床分离菌株N003;2:淋球菌临床分离菌株N005;3:标准菌株FA1090;4:淋球菌临床分离菌株N004
2.毛细管电泳和聚丙烯酰胺凝胶电泳结果比较:见表3。N002-N011淋球菌临床分离菌株利用聚丙烯酰胺凝胶电泳 所 确 定 的 VNTR264、VNTR471、VNTR947、VNTR1609、VNTR1638、VNTR2048、VNTR2148 基因位点 PCR 产物重复次数与毛细管电泳所得结果一致。如图1~4,FA1090菌株VNTR471及VNTR947 PCR产物利用聚丙烯酰胺凝胶电泳与毛细管电泳结果一致。FA1090菌株VNTR264基因位点PCR产物用聚丙烯酰胺凝胶电泳确定其重复次数为3,利用毛细管电泳不能确定其重复次数,而其他6个基因位点PCR产物利用这两种方法所确定的重复次数一致。
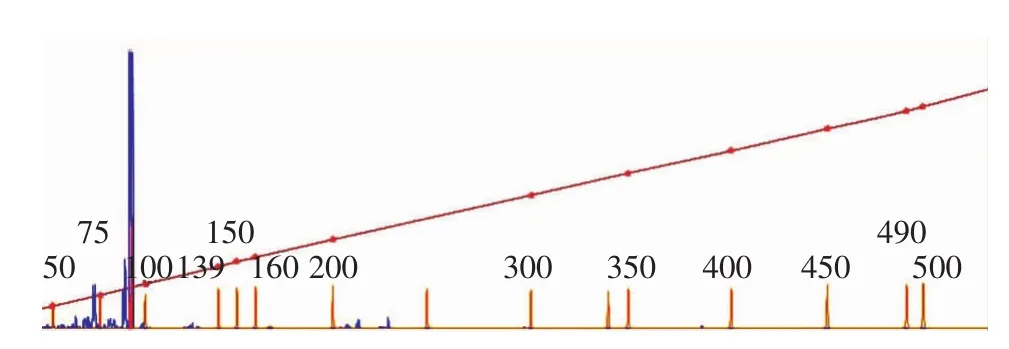
图4 标准菌株FA1090 VNTR 947引物PCR产物毛细管电泳图 蓝色峰为FA1090菌株VNTR PCR产物,黄色峰为内标LIZ500,从左到右依次增大
四、讨论
合理的抗生素治疗和及时了解淋病患者的性传播网络是防治淋球菌感染的重要措施。研究报道,MLVA分型可用于研究菌株在不同地区的分布,以便确定某一地区菌株的型别特点及爆发的流行菌株型别[2];根据型别特点以确定菌株的进化及遗传学特点[4];研究不同型别在人群的分布特征[5];也可根据菌株对药物敏感性与菌株型别的关系,及早确定菌株型别与耐药之间的关系[2]。
MLVA分型在1990年代开始用于炭疽杆菌、土拉热杆菌、包柔螺旋体螺旋体、大肠杆菌、结核杆菌等病原体的分子流行病学研究。淋球菌MLVA分型根据FA1090淋球菌菌株整个基因组序列,采用Tandem Repeat Finder软件筛选出合适的串联重复序列,通过分析菌株串联重复序列的数目来分型。有研究[6-10]已经建立了结核分枝杆菌MLVA分型方法标准化操作。MLVA分型可采用基因测序、聚丙烯酰胺凝胶电泳、毛细管电泳3种实验方法。前两种实验方法在文献中已经有报道用于MLVA分型[2-5]。毛细管电泳结果与聚丙烯酰胺凝胶电泳结果对比,具有一致性,说明毛细管电泳可用于MLVA分型。毛细管电泳是一种省时省力的实验方法,与测序比较,价格便宜,PCR浓度要求低;与聚丙烯酰胺凝胶电泳比较,操作简单,省时省力,有利于大样本分子流行病学的研究。综上所述,毛细管电泳是进行MLVA分型较好的实验方法,但该实验方法也有一定的局限性,例如引物需要避光保存,对500 bp以上VNTR准确性低。
[1]Zuppa AA,D′Andrea V,Catenazzi P,et al.Ophthalmia neonatorum:what kind of prophylaxis?[J].J Matern Fetal Neonatal Med,2011,24(6):769-773.
[2]Kushnir AV,Ilina EN,Malakhova MV,et al.Multiple-locus variable number tandem repeat analysis ofNeisseria gonorrhoeaeisolates in Russia[J].Infect Genet Evol,2013,14:8-14.
[3]梁宏伟,王长忠,李忠,等.聚丙烯酰胺凝胶快速、高效银染方法的建立[J].遗传,2008,30(10):1379-1382.
[4]KushnirAV,MuminovTA,BayevAI,etal.Molecularcharacterization ofNeisseria gonorrhoeaeisolates in Almaty,Kazakhstan,by VNTR analysis,Opa-typing and NG-MAST[J].Infect Genet Evol,2012,12(3):570-576.
[5]Heymans R,Schouls LM,van der Heide HG,et al.Multiplelocusvariable-numbertandem repeatanalysisofNeisseria gonorrhoeae[J].J Clin Microbiol,2011,49(1):354-363.
[6]Farlow J,Postic D,Smith KL,et al.Strain typing ofBorrelia burgdorferi,Borreliaafzelii,andBorreliagariniiby using multiple-locus variable-number tandem repeat analysis[J].J Clin Microbiol,2002,40(12):4612-4618.
[7]Farlow J,Smith KL,Wong J,et al.Francisella tularensis strain typing using multiple-locus,variable-numbertandem repeat analysis[J].J Clin Microbiol,2001,39(9):3186-3192.
[8]Smith KL,De Vos V,Bryden HB,et al.Meso-scale ecology of anthrax in southern Africa:a pilot study of diversity and clustering[J].J Appl Microbiol,1999,87(2):204-207.
[9]Keys C,Kemper S,Keim P.Highly diverse variable number tandem repeat loci in theE.coliO157:H7 and O55:H7 genomes for high-resolution molecular typing[J].J Appl Microbiol,2005,98(4):928-940.
[10]吕冰,Christine Pourcel,刘敬华,等.结核分枝杆菌多位点可变数目串联重复序列分型方法标准化操作程序的建立[J].中华流行病学杂志,2008,29(9):919-924.
2014-02-20)
(本文编辑:吴晓初)
10.3760/cma.j.issn.0412-4030.2014.12.021
国家自然科学基金(81101294);国家十一五科技重大专项(2008ZX10001-005)
210042南京,中国医学科学院北京协和医学院皮肤病研究所
尹跃平,Email:yinyp@ncstdlc.org
