黄芪甲苷对HaCaT细胞的光保护效能及其机制
2014-12-09杨子良骆丹钱齐宏杜纳余秀琴王淼淼闵玮
杨子良 骆丹 钱齐宏 杜纳 余秀琴 王淼淼 闵玮
黄芪甲苷对HaCaT细胞的光保护效能及其机制
杨子良 骆丹 钱齐宏 杜纳 余秀琴 王淼淼 闵玮
目的观察黄芪甲苷对于中波紫外线(UVB)损伤的人表皮细胞的保护作用,探讨其相关机制。方法将培养的永生化人皮肤角质形成细胞(HaCaT细胞)分为对照组、UVB组、黄芪甲苷组和UVB+黄芪甲苷组,其中UVB组和UVB+黄芪甲苷组细胞接受50 mJ/cm2UVB照射,加药组加入不同浓度的黄芪甲苷(10、20、50、100、200 mg/L)进行干预,24 h后CCK8法检测细胞活性。根据CCK8法检测结果选择最佳药物浓度(20 mg/L)进行后继实验。照光后继续培养24 h,流式细胞仪检测细胞内活性氧(ROS)水平,Western印迹法检测HaCaT细胞中p53、p38、基质金属蛋白酶9(MMP-9)和高迁移率族蛋白A1(HMGA-1)的表达。结果与对照组相比,10 mg/L和20 mg/L黄芪甲苷组对HaCaT细胞的增殖活性无明显影响(F=1.32,P>0.05),50、100和200 mg/L黄芪甲苷对细胞增殖活性有一定抑制作用(F=20.20,P<0.05);UVB组与对照组比较,HaCaT细胞增殖活性显著下降(F=99.00,P<0.01)。与UVB组相比,UVB+黄芪甲苷(10~200 mg/L)组HaCaT细胞增殖活性不同程度升高(F=19.08,P<0.01),其中UVB+20 mg/L黄芪甲苷组升高程度最高。进一步实验表明,与UVB组相比,UVB+20 mg/L黄芪甲苷组ROS产生受到明显抑制(t=21.12,P<0.01)。Western印迹结果表明,与对照组比较,UVB组p53、p38、MMP-9和HMGA-1蛋白的表达升高(均P<0.01),而UVB+20 mg/L黄芪甲苷组细胞内p53、p38、MMP-9和HMGA-1蛋白的表达水平较UVB组显著降低(P<0.01)。结论黄芪甲苷可有效抑制UVB引起的表皮细胞光损伤。
黄芪;紫外线;角蛋白细胞;活性氧
中波紫外线(UVB)是引起皮肤急慢性损害乃至皮肤癌的最重要波段之一[1-2]。已证实黄芪甲苷具有多种生物学活性,包括清除氧自由基、抗衰老、抗炎、抗病毒、保护血脑屏障以及一定的抗癌活性[3-4]。目前发现黄芪甲苷具有一定的抗紫外线损伤效果[5-6]。我们通过观察黄芪甲苷对细胞氧化损伤和肿瘤相关基因表达的影响,探讨黄芪甲苷的光保护作用机制。
材料与方法
一、材料
SUV-100日光紫外线模拟器及UVB辐射度监视器(上海希格玛高技术有限公司),人永生化角质形成细胞株HaCaT细胞来自中国典型培养物保藏中心,流式细胞仪(美国EPICS公司),黄芪甲苷(中国药品生物制品检定所,批号110781-200613,标准品,纯度 ≥ 99%),二氯荧光黄二乙酸酯(DCFHDA)(美国Sigma-Aldrich公司),p53和高迁移率族蛋白A1(high mobility group protein A-1,HMGA-1)一抗(美国Santa Cruz公司),基质金属蛋白酶9(MMP-9),p38和β肌动蛋白一抗(美国Cell Signaling Technology公司),高糖DMEM培养基产自美国Gibco公司,胎牛血清产自杭州四季青生物工程材料有限公司。
二、方法
1.细胞培养和紫外线照射:HaCaT细胞在37℃、5%CO2细胞培养箱中培养。80%融合时,以0.25%胰酶消化,用含10%小牛血清的DMEM培养基调整为1×106/ml,定量接种于培养皿中继续培养。将细胞分为对照组、UVB组、黄芪甲苷组和UVB+黄芪甲苷组,其中UVB组和UVB+黄芪甲苷组细胞生长至亚融合状态时用日光紫外线模拟器对置于磷酸盐缓冲液(PBS)里的细胞进行UVB照射。根据前期研究结果[7],选取照射剂量为50 mJ/cm2,对照组和黄芪甲苷组在照光时覆以铝箔,余处理同照光组。加药组在照光前24 h和照光后加入不同浓度的黄芪甲苷孵育培养。每个处理条件重复实验3次。
2.CCK8检测细胞增殖活性:将各组细胞悬液接种于96孔板上,黄芪甲苷质量浓度为0、10、20、50、100、200 mg/L,照光后继续培养24 h,分别收集各组细胞,每孔加入10 μl CCK8溶液,细胞培养箱内继续孵育3 h,于酶标仪上测定450 nm处吸光度(A值)。细胞增殖抑制率=(对照组A值-实验组A值)/对照组A值×100%,根据检测结果选择光保护效果显著且无明显细胞毒性的最佳药物浓度(20 mg/L)进行后续实验。
3.流式细胞仪检测细胞内活性氧(ROS)水平:将HaCaT细胞接种于3.5 cm培养皿中,分组同上,黄芪甲苷浓度为20 mg/L。照光后继续培养24 h收集细胞,DCFH-DA法检测细胞内活性氧的变化。PBS洗3次,加入10 mmol/L DCFH-DA 37℃避光反应30 min,PBS洗3次,流式细胞仪检测细胞内荧光强度(激发波长为485 nm,发射波长为538 nm)。
4.Western 印 迹 测 定 p53、p38、MMP-9 和HMGA-1表达:将HaCaT细胞接种于10 cm培养皿中,分组同上,黄芪甲苷浓度为20 mg/L。照光后继续培养24 h收集细胞,提取细胞总蛋白,BCA法检测蛋白浓度,制备12%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE),每胶槽加入50 μg样本,电泳、转膜、封闭,加一抗4℃摇床孵育杂交过夜。加入二抗孵育1 h,显色并用BIO-RAD凝胶成像系统采集和分析数据。
5.统计学分析:采用SPSS 11.0软件对实验数据进行统计分析,实验结果以±s表示,各组间进行t检验或单因素方差分析,P<0.05为差异有统计学意义。
结 果
一、黄芪甲苷和UVB对HaCaT细胞增殖活性的影响
CCK8 法检测结果表明,10、20、50、100、200 mg/L黄芪甲苷处理后,HaCaT细胞的增殖抑制率分别为3.12% ±0.72%、3.23% ±0.63%、9.77% ±1.83%、19.45%±1.55%和30.72%±2.26%,与对照组相比,10 mg/L和20 mg/L黄芪甲苷对HaCaT细胞的增殖活性均无明显影响(F=1.32,P>0.05);而50~200 mg/L黄芪甲苷对细胞增殖活性有一定抑制作用(F=20.20,P<0.05)。经50 mJ/cm2UVB照射并继续培养24 h后,与对照组相比,UVB组HaCaT细胞增殖活性显著下降,细胞增殖抑制率为59.82%±3.32%(F=99.00,P<0.01);与UVB组相比,UVB+黄芪甲苷(10、20、50、100、200 mg/L)组 HaCaT 细胞增殖活性不同程度升高,细胞增殖抑制率分别为42.33% ±2.34%、28.67% ±1.55%、32.53% ±1.57%、42.41%±3.96%和43.88%±1.93%(F=19.08,P<0.01),其中20 mg/L黄芪甲苷抑制UVB损伤能力最强。因此选取20 mg/L黄芪甲苷进行后续实验。

图1 黄芪甲苷和中波紫外线对HaCaT细胞中活性氧水平的影响 1a:对照组;1b:黄芪甲苷组;1c:中波紫外线组;1d:中波紫外线+黄芪甲苷组
二、黄芪甲苷对HaCaT细胞内ROS水平的影响
与对照组细胞相比,单纯20 mg/L黄芪甲苷处理后,细胞内ROS水平由生理状态下的0.53±0.06降低至0.37±0.03(t=7.39,P<0.05)。UVB照射后,细胞内ROS水平增高至0.76±0.04,与对照组相比,t=7.43,P<0.05;20 mg/L黄芪甲苷干预处理后细胞内ROS水平显著降低至0.59±0.07,与UVB组细胞相比,t=21.12,P<0.01。见图1。
三、黄芪甲苷对HaCaT细胞内p53、p38、MMP-9和HMGA-1蛋白表达的影响
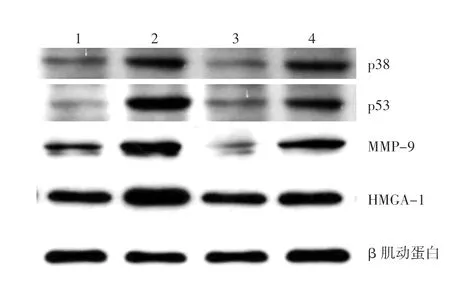
图2 黄芪甲苷对HaCaT细胞p53、p38、基质金属蛋白酶9(MMP-9)和高迁移率族蛋白A1(HMGA-1)表达的影响 1:对照组;2:中波紫外线组;3:黄芪甲苷组;4:中波紫外线+黄芪甲苷组
表1 黄芪甲苷对HaCaT细胞p53、p38、基质金属蛋白酶9(MMP-9)和高迁移率族蛋白A1(HMGA-1)表达的影响(±s)
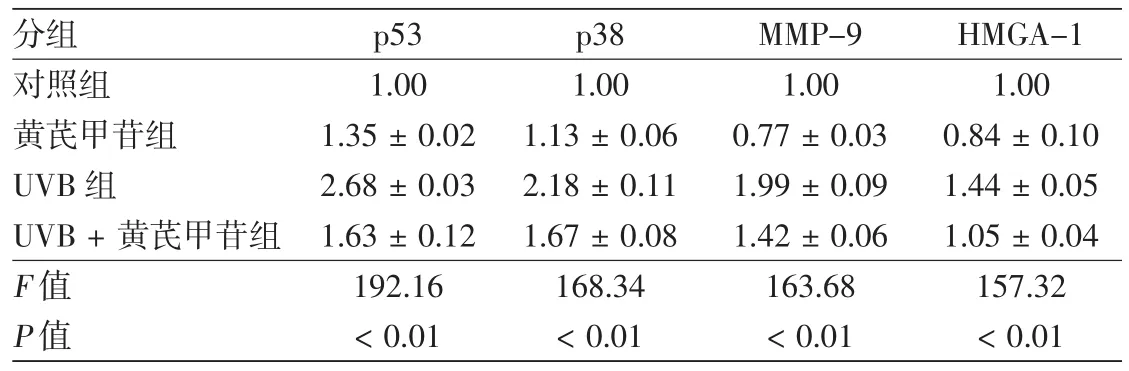
表1 黄芪甲苷对HaCaT细胞p53、p38、基质金属蛋白酶9(MMP-9)和高迁移率族蛋白A1(HMGA-1)表达的影响(±s)
注:n=3。UVB:中波紫外线
分组 p53 p38 MMP-9 HMGA-1对照组 1.00 1.00 1.00 1.00黄芪甲苷组 1.35±0.02 1.13±0.06 0.77±0.03 0.84±0.10 UVB组 2.68±0.03 2.18±0.11 1.99±0.09 1.44±0.05 UVB+黄芪甲苷组 1.63±0.12 1.67±0.08 1.42±0.06 1.05±0.04 F值 192.16 168.34 163.68 157.32 P值 <0.01 <0.01 <0.01 <0.01
与对照组比较,UVB照射可不同程度增加细胞中p53、p38、MMP-9和HMGA-1蛋白的表达水平,而在照光前后24 h加入20 mg/L黄芪甲苷干预,上述蛋白的表达水平均显著下降,差异有统计学意义(P<0.01)。 见图2,表1。
讨 论
UVB是造成皮肤损伤的重要环境因素之一,包括红斑、晒黑、炎症、免疫抑制、光老化、光致癌等。UVB可直接引起皮肤细胞DNA损伤,同时也可通过产生氧自由基及活性氧,引起DNA氧化性损伤,诱发基因突变和皮肤癌的发生。表皮角质形成细胞是UVB能量作用的主要靶部位。我们在前期研究中证实,黄芪甲苷可明显抑制长波紫外线(UVA)对人皮肤真皮成纤维细胞的损伤作用,包括抑制氧化损伤、增强细胞抗氧化防御能力、影响MMP-1和金属蛋白酶组织抑制因子-1(TIMP-1)等基因的表达等[8-9]。本实验以人角质形成细胞系HaCaT为实验对象,观察黄芪甲苷对UVB急性照射损伤的保护效果。
本实验中,不同浓度黄芪甲苷处理对生理状态细胞增殖活性有一定影响,其中10 mg/L和20 mg/L黄芪甲苷对HaCaT细胞的增殖活性无明显影响,而50~200 mg/L黄芪甲苷对细胞增殖活性有一定抑制作用,且与药物浓度成正比,表明高浓度状态下黄芪甲苷可抑制细胞生长。而UVB照射后,不同浓度的黄芪甲苷均可减轻UVB对HaCaT细胞的损伤作用,其中20 mg/L黄芪甲苷的保护效果最好。上述结果表明,在适宜药物浓度下黄芪甲苷可显著减轻UVB对细胞的损伤作用。
UVB诱导的皮肤细胞氧化损伤是造成细胞DNA损伤、免疫抑制、炎症浸润乃至皮肤癌发生的重要因素[10-11]。虽然皮肤细胞本身具有较强的清除活性氧和氧自由基的能力,但是长期UVB照射将削弱细胞抗氧化损伤的防御能力,进而促进肿瘤发生。我们应用流式细胞仪检测细胞内ROS水平以评价黄芪甲苷抗UVB氧化损伤的效能,结果表明,黄芪甲苷干预显著降低了UVB照射后细胞内ROS水平,表明黄芪甲苷具有较强的保护皮肤细胞免于UVB氧化损伤的能力。
已有研究证实,紫外线可通过DNA损伤信号,即ROS-p38-p53路径参与DNA修复、细胞周期调控、凋亡等过程[12-13]。MMP-9是MMP家族的重要成员,能降解破坏细胞外基质,与皮肤老化的发生和肿瘤浸润转移密切相关[14]。HMGA-1属于HMG家族,研究表明,HMGA-1表达是诱导正常细胞发生恶性转化的重要因素[15]。本实验结果显示,单纯黄芪甲苷处理可一定程度下调MMP-9和HMGA-1表达,提示黄芪甲苷可能具有一定的抗癌活性;同时,UVB可显著增加p53、p38、MMP-9和HMGA-1蛋白的表达水平,而黄芪甲苷干预处理则可明显抑制这些基因的表达,进而减少DNA损伤信号导致的细胞老化、凋亡和恶性转化过程。
综上所述,黄芪甲苷对于UVB引起的皮肤细胞损伤具有较强的保护效果。
[1]Wölfle U,Esser PR,Simon-Haarhaus B,et al.UVB-induced DNA damage,generation ofreactive oxygen species,and inflammation are effectively attenuated by the flavonoid luteolinin vitroandin vivo[J].Free Radic Biol Med,2011,50(9):1081-1093.
[2]康玉英,甄雅贤,顾恒.紫外线对皮肤的影响[J].中华皮肤科杂志,2007,40(12):773-775.
[3]孙豪栋,庞晓斌,李继扬.黄芪甲苷生物活性研究进展[J].中国药房,2011,22(7):657-661.
[4]Ren S,Zhang H,Mu Y,et al.Pharmacological effects of Astragaloside IV:a literature review[J].J Tradit Chin Med,2013,33(3):413-416.
[5]Yang B,Ji C,Chen X,et al.Protective effect of astragaloside IV againstmatrix metalloproteinase-1 expression in ultravioletirradiated human dermal fibroblasts[J].Arch Pharm Res,2011,34(9):1553-1560.
[6]王蓉,吴秀红,钱齐宏,等.黄芪甲苷对长波紫外线损伤人真皮成纤维细胞的保护作用[J].苏州大学学报(医学版),2010,30(3):494-497.
[7]闵玮,骆丹,林向飞,等.羟氯喹及没食子酸酯对HaCaT细胞光照射的影响[J].中华皮肤科杂志,2005,38(9):575-577.
[8]Liu X,Min W.Protective effects of astragaloside against ultraviolet A-induced photoaging in human fibroblasts[J].Zhong Xi Yi Jie He Xue Bao,2011,9(3):328-332.
[9]刘铭,骆丹,林秉奖,等.黄芪甲苷对长波紫外线影响人成纤维细胞的干预研究[J].北京中医药大学学报,2013,36(5):337-340.
[10]Valacchi G,Sticozzi C,Pecorelli A,et al.Cutaneous responses to environmental stressors[J].Ann N Y Acad Sci,2012,1271:75-81.
[11]Masaki H.Role of antioxidants in the skin:anti-aging effects[J].J Dermatol Sci,2010,58(2):85-90.
[12]Filomeni G,Piccirillo S,Rotilio G,et al.p38(MAPK)and ERK1/2 dictate cell death/survival response to different pro-oxidant stimuli via p53 and Nrf2 in neuroblastoma cells SH-SY5Y[J].Biochem Pharmacol,2012,83(10):1349-1357.
[13]Dickinson SE,Olson ER,Zhang J,et al.p38 MAP kinase plays a functional role in UVB-induced mouse skin carcinogenesis[J].Mol Carcinog,2011,50(6):469-478.
[14]Akgül B,Pfefferle R,Marcuzzi GP,et al.Expression of matrix metalloproteinase(MMP)-2,MMP-9,MMP-13,and MT1-MMP in skin tumors of human papillomavirus type 8 transgenic mice[J].Exp Dermatol,2006,15(1):35-42.
[15]Visone R,Iuliano R,Palmieri D,et al.Hmga1 null mice are less susceptible to chemically induced skin carcinogenesis[J].Eur J Cancer,2008,44(2):318-325.
2014-01-13)
(本文编辑:尚淑贤)
Protective effect of astragalosideⅣ against ultraviolet B-induced photodamage to human HaCaT keratinocytes and its mechanisms
Yang Ziliang*,Luo Dan,Qian Qihong,Du Na,Yu Xiuqin,Wang Miaomiao,Min Wei.*Department of Dermatology,First Affiliated Hospital of Soochow University,Suzhou 215006,China
Min Wei,Email:minwei@suda.edu.cn
ObjectiveTo evaluate the protective effect of astragaloside Ⅳ against ultraviolet B(UVB)-induced photodamage to human HaCaT keratinocytes,and to investigate its mechanisms.MethodsCultured immortalized human HaCaT keratinocytes were divided into four groups:blank control group receiving untreated,UVB group irradiated with 50 mJ/cm2UVB,astragalosideⅣ group treated with astragalosideⅣ,UVB+astragalosideⅣgroup treated with astragalosideⅣfor 24 hours before and after 50 mJ/cm2of UVB radiation.The concentration of astragaloside Ⅳ ranged from 10 to 200 mg/L in cell proliferation assay,and according to the results of proliferation assay,20 mg/L was determined as the optimal concentration in the other assays.At 24 hours after UVB radiation,cell counting kit-8(CCK8)assay was performed to evaluate cellular proliferative activity,flow cytometry to determine intracellular reactive oxygen species(ROS)levels,and Western blot to measure the expression levels of p53,p38,matrix metalloproteinase-9(MMP-9)and high mobility group Al(HMGA-1)protein in HaCaT cells.ResultsCompared with the control group,astragaloside Ⅳ at 10 and 20 mg/L had no inhibitory effect(F=1.32,P> 0.05),while astragalosideⅣ at 50,100 and 200 mg/L showed significantly inhibitory effect(F=20.20,P< 0.05),on the proliferation of HaCaT cells.In addition,cellular proliferative activity in the UVB group was significantly lower than that in the control group(F=99.00,P< 0.01).Compared with the UVB group,cellular proliferative activity increased to different degrees in HaCaT cells treated with both UVB and astragalosideⅣof 10-200 mg/L(F=19.08,P< 0.01),with the strongest increase observed in those treated with UVB and astragalosideⅣ of 20 mg/L.Further experiments revealed reduced intracellular ROS levels in the UVB+astragalosideⅣ(20 mg/L)group compared with the UVB group(t=21.12,P< 0.01).Western blot assay showed that the expression levels of p53,p38,MMP-9 and HMGA-1 protein were significantly higher in the UVB group than in the control group(allP<0.01),but significantly lower in the UVB+astragalosideⅣ(20 mg/L)group than in the UVB group(allP<0.01).ConclusionAstragalosideⅣcan effectively protect keratinocytes from UVB-induced photodamage.
Astragalus membranaceus;Ultraviolet rays;Keratinocytes;Reactive oxygen species
10.3760/cma.j.issn.0412-4030.2014.12.007
江苏省自然科学基金青年基金(BK2012170);江苏省卫生厅中医药科技项目(LZ11095);苏州市科教兴卫项目(KJXW2011003)
215006苏州大学第一附属医院皮肤科(杨子良、钱齐宏、杜纳、余秀琴、王淼淼、闵玮);南京医科大学第一附属医院皮肤性病科(骆丹)
闵玮,Email:minwei@suda.edu.cn
