脑转移瘤放射治疗的预后因素分析及预后模型的建立
2014-12-06朱虹吕博李云海王洪林赵森
朱虹 吕博 李云海 王洪林 赵森
1.复旦大学附属肿瘤医院闵行分院放疗科,上海 200240;
2.复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
脑转移瘤是最为常见的颅内肿瘤,25%~40%的恶性肿瘤患者最终将发生脑转移,且脑转移瘤患者的预后很差,未经特殊治疗,中位生存期仅为4周[1]。除了孤立性脑转移可以选择手术或立体定向放疗外,目前全脑放疗仍是脑转移瘤的标准治疗方式。本研究回顾性分析140例恶性肿瘤脑转移患者放疗的疗效,分析相关预后因素并探讨递归分区分析(recursive partitioning analysis classes,RPA)、脑转移基本评分(basic score for brain metastases,BSBM)及等级预后评估标准(the graded prognostic assessment index,GPA)3种预后评分指数及预后指数(prognostic index,PI)模型的临床应用 价值。
1 资料和方法
1.1 一般资料
选择2008年1月—2011年7月间在复旦大学附属肿瘤医院闵行分院放疗科收治的符合入组条件的脑转移放射治疗患者155例,均经病理确诊为原发肿瘤类型及经影像学[CT和 (或)MRI]诊断为脑转移;所有患者均接受全脑放射治疗,皆未行脑转移灶手术切除或立体定向放疗,无合并其他恶性肿瘤史,年龄≤80岁,卡氏评分(karnofsky performance score,KPS)≥50。随访至2012年7月31日,其中140例随访资料完整。其中男性50例,女性90例;年龄20~80岁,中位年龄56.5岁。
1.2 一般情况
其中单发性脑转移患者41例(29%),多发99例(71%),大都位于脑实质内。其中肺癌75例(54%)、乳腺癌45例(32%)、消化道肿瘤9例(6%)、肺癌、乳癌双原发2例(1%)、其他肿瘤9例(7%)。98例伴有颅外转移,其中以淋巴结、骨、肺、肝多见。临床表现多以进行性颅内压增高的症状和局部神经受损的体征为主,头痛、头晕是脑实质内转移瘤最常见的症状,发生率约为60%;其次为肢体肌力改变,再次为癫痫发作。
1.3 治疗方式
采用6 MV-X线照射,行全脑2侧野平行对穿照射,肿瘤剂量为(3 000~4 000)cGy/(2~4)周 (极少部分患者放疗27 Gy/9次),对单发的转移灶缩野局部追加剂量(1 000~2 000)cGy/(1~2)周。放疗期间予以甘露醇及糖皮质激素脱水 治疗。
1.4 研究方法
随访方式采用门诊、电话及HIS系统。对符合入组条件的患者,分析以下项目:①全脑放疗对患者症状的改善、颅内肿瘤的退缩情况及生存率;②分析不同病理类型肿瘤脑转移患者的生存期是否存在差异;③对影响生存预后的各种相关因素,包括年龄、性别、KPS、脑转移数目、中枢外转移、病理类型、原发灶控制、放疗剂量、转移瘤体积、血红蛋白,行单因素分析,对差异有统计学意义的因素再行多因素分析;④分析RPA、BS-BM、GPA评分与预后的关系,根据3种方式进行分组,对3组患者的生存情况进行比较;⑤各模型预测能力的评价。
1.5 统计学处理
运用IBM SPSS 19统计软件包进行统计分析:研究的终末点是总生存期,生存期从脑转移放疗开始之日计算,使用Kaplan Meier法计算生存率,对生存率曲线的比较使用Log-rank检验,经单因素分析对差异有统计学意义的变量使用Cox多因素回归模型。使用MedCalc软件通过ROC曲线下面积(area under curve,AUC)比较4种评分模式对生存期的预测能力并两两比较。AUC=0.5则检测指标无诊断价值,0.5~0.7诊断价值较低,0.7~0.9则诊断价值中等,0.9以上诊断价值 较高。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
入组患者均可评价疗效,失访15病例,140例患者随访资料完整。其中男性50例,女性90例;年龄20~80岁,中位年龄56.5岁;KPS≥70分的患者为101例,KPS<70分的患者为39例。均接受全脑放射治疗。在放疗结束后3个月,复查头颅MRI或CT(对应放疗前),肿瘤完全缓解(complete remission,CR)占12%,部分缓解(partial remission,PR)占66%,疾病稳定(stable disease,SD)占12%,疾病进展(progressive disease,PD)占10%,90%患者的临床症状获得改善。截止到随访终点,140例患者中127例已死亡,Kaplan-Meier分析结果显示,全组中位生存时间为222 d,3、6个月的生存率分别为73.9%、56.5%,1、2年生存率为38%、8.2% (图1)。
2.2 病理分型对生存期影响
数据显示,不同病理类型的肿瘤脑转移患者,放疗后其生存期差异无统计学意义(χ2=2.637,P=0.451)。
2.3 预后单因素、多因素生存分析
单因素Log-rank检验提示,KPS、脑转移数目、中枢外转移、原发灶控制、放疗剂量、血红蛋白与预后相关(P均<0.05,表1),对差异有统计学意义的因素使用Cox多因素回归模型进行预后分析,筛选出KPS(P=0.002,Wald=9.700)、中枢外转移(P=0.018,Wald=5.604)、原发灶控制(P=0.001,Wald=10.212)3个因素影响总生存期(表2)。
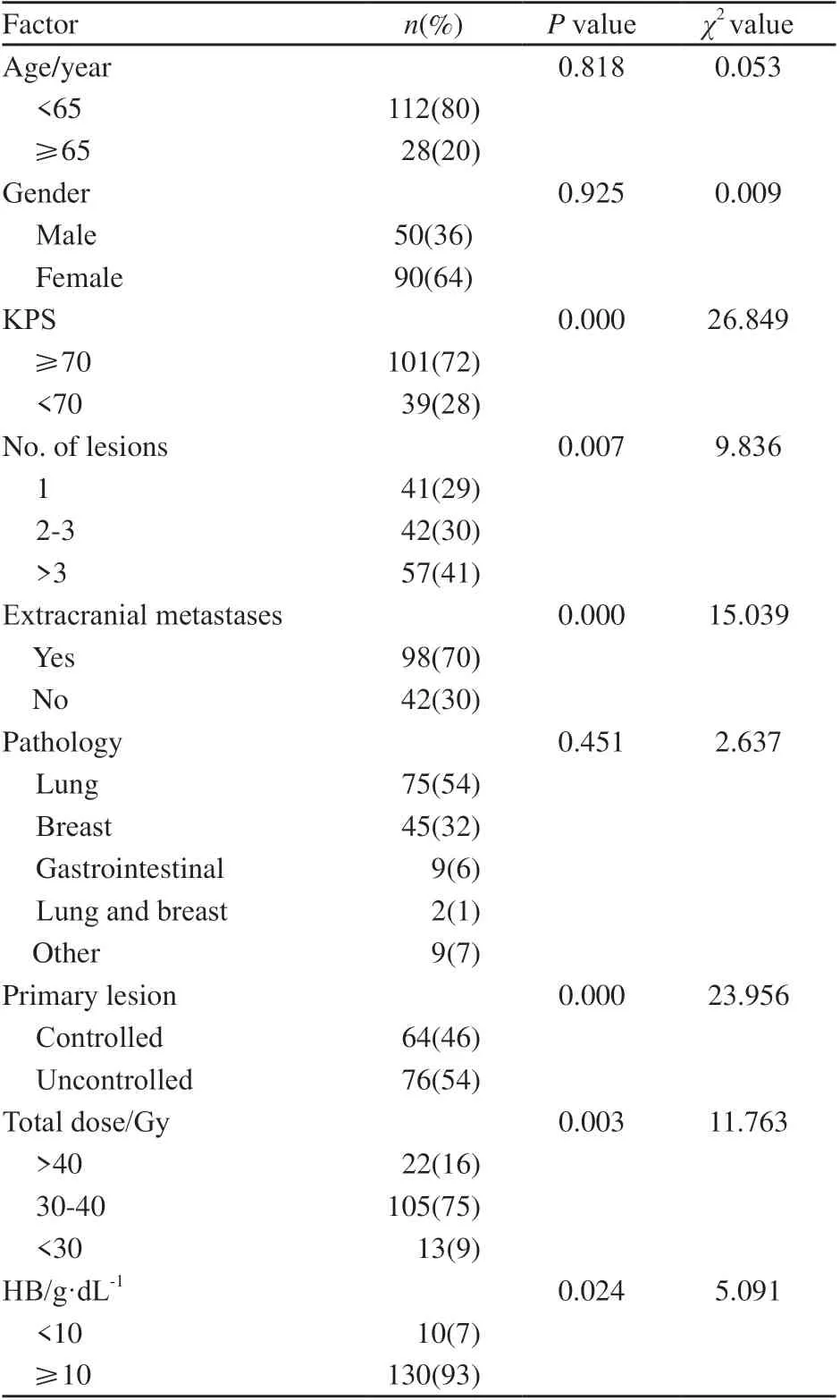
表1 单因素生存分析(Log-rank检验)Tab. 1 Univariate survival analysis (Log-rank test)
2.4 3种评分模式与预后的关系
Log-rank检验提示,RPA、BS-BM、GPA 3种评分均与预后相关。RPAⅠ、Ⅱ、Ⅲ级中位生存期分别为569、222、51 d(χ2=41.446,P=0.000),BS-BM 0、1、2、3分中位生存期分别为51、100、380、590 d(χ2=79.821,P=0.000),GPA 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4分中位生存期分别为87、60、92、173、350、420、871、450、678 d(χ2=31.296,P=0.000,图2)。
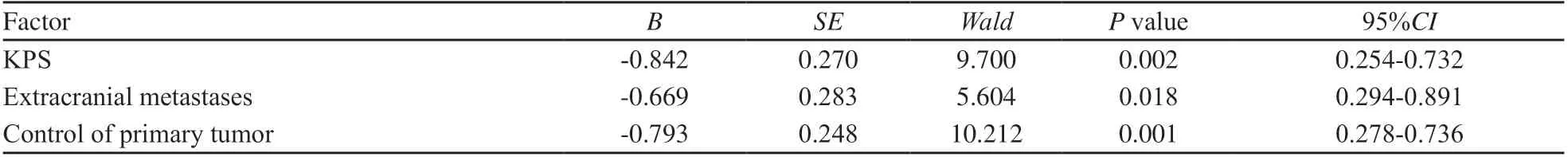
表2 多因素Cox回归分析结果Tab. 2 Multivariate Cox regression analysis
2.5 各模型预测能力的评价
本研究Cox多因素回归模型进行预后分析,筛选出KPS、中枢外转移、原发灶控制3个因素影响总生存期,根据本组数据建立预测预后的PI模型。根据PI值=预后因子1的分组值×变异系数1(β1)+预后因子2的分组值×变异系数2(β1)+…。本组PI值=-0.842×KPS分组(1或2)-0.669×中枢外转移(0或1)-0.793×原发灶控制(0或1)。按此公式对140例患者分别计算获得各PI值。将预后模型PI、RPA、BS-BM、GPA共4种预后指数评分的比较,用ROC曲线图反映预测结果(图3)。PI值分别与RPA、BS-BM、GPA两两比较预测3个月生存概率,结果显示,ROC曲线下的面积差异有统计学意义(P<0.000 1)。PI值分别与RPA(P<0.000 1)、BS-BM(P=0.001)、GPA(P=0.000 2)两两比较预测6个月生存概率,结果显示,ROC曲线下的面积差异有统计学意义(P<0.05)。以上结果表明,预测模型对于本组患者3、6个月生存概率的预测,PI优于其他评分模式(表3)。PI值预测3、6个月生存概率的ROC曲线下的面积分别为0.885、0.811(图3),最佳切变值时的灵敏度为91.67%,特异度为77.94%。
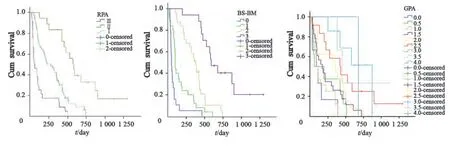
图2 RPA、BS-BM、GPA 3种评分生存曲线Fig. 2 Survival curves of three kinds of prognostic index models
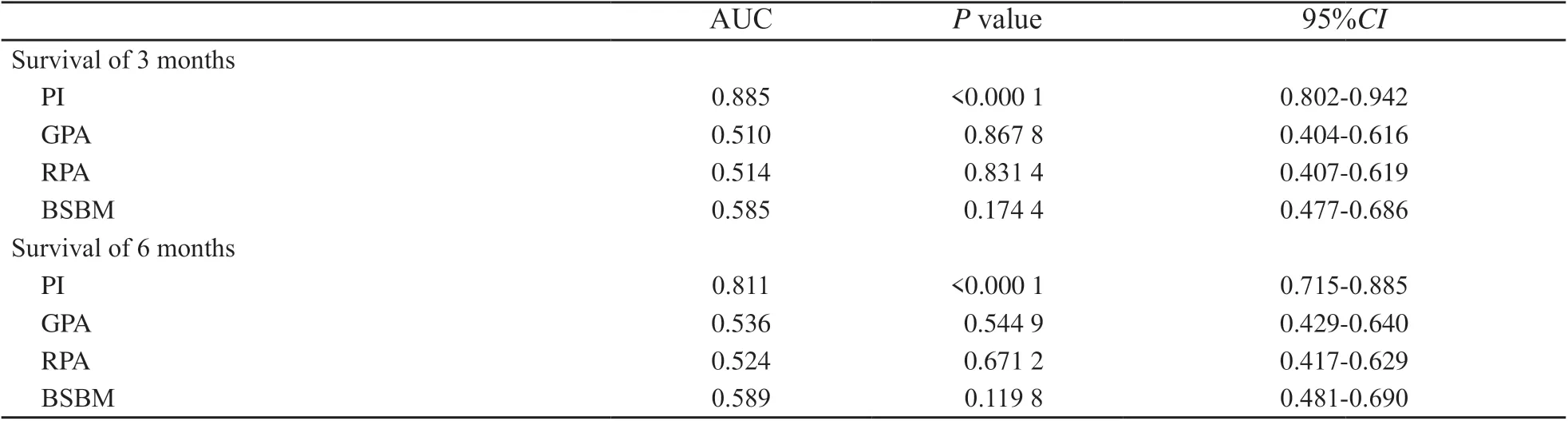
表3 各评分模型对生存预测的ROC曲线下面积Tab. 3 AUC of each scoring model to predict survival

图3 预后指数预测3、6个月生存期的ROC曲线图Fig. 3 ROC curves of prognostic index forecasting 3 and 6 months survival
3 讨 论
脑转移瘤的治疗主要以姑息治疗为主,传统治疗方法主要采用全脑放疗,对新诊断的、适合手术切除的成人单发脑转移瘤可采用手术切除;对新诊断的、直径<3 cm、占位效应轻微(中线移位<1 cm)的实性脑转移瘤,立体定向放疗也是临床常用治疗手段[2],但大多数脑转移患者治疗需要结合全脑放疗。而本组患者中29%为单发转移瘤,皆未行手术治疗,原因为个人恐惧手术、手术风险较大、其他部位多发转移、功能状态评分差,对于一般情况较好的患者脑内局部病灶在全脑放疗后采取局部加量放疗方式治疗。
对本组经全脑放疗患者的研究结果显示,全脑放疗结束后3个月,90%患者的临床症状获得改善,颅内CR占12%,PR占66%,SD占12%,PD占10%,全组中位生存时间为222 d(7.4个月),比文献报道4~6个月略长[3]。但是患者颅内症状的改善并不意味着生存质量的改善,对生存率的影响由于有其他部位病灶的存在而不易说明,患者的死亡原因并不全与脑部病灶有关,因此有必要分析预后相关因素。
对脑转移患者,研究和探讨如何提高其生存质量,延长生存期,分析影响生存期的相关因素,对指导个体化临床治疗具有重要的意义。影响脑转移瘤预后的非治疗因素很多,文献报告显示对预后有显著影响的因素有年龄、KPS评分、原发灶控制、颅外有否转移、转移灶是否多发等[3-7]。Gaspar等[3]首次提出脑转移预后指数评分模式RPA,1997年RTOG对1 200例脑转移瘤接受放射治疗的患者(部分患者先行手术切除)治疗前的各因素进行回归分析,结果显示,年龄、KPS评分、疾病状态与预后相关,根据3项标准分为RPA 3级:Ⅰ级为年龄≤65岁,KPS≥70分,肿瘤原发病灶控制且无颅外转移患者;Ⅲ级为KPS评分<70分的患者;其余为Ⅱ级,结果显示不同级别患者预后差异有统计学意义(P<0.05),Ⅰ、Ⅱ、Ⅲ级别患者中位生存期分别为7.1、4.2、2.3个月[3]。对RPA为脑转移瘤患者进行临床对比研究提供了类比标准,这一标准经多项临床研究证实了其可靠性[3-5]。Saito等[4]分析了270例脑转移的患者,其中15%行手术切除后放疗,85%仅行全脑放疗,研究结果显示,根据RPA分级全脑放疗后的中位生存期分别为Ⅰ级6.2个月,Ⅱ级4.2个月,Ⅲ级3.0个月,差异有统计学意义 (P<0.000 1)。单因素分析中,KPS>70分、经神经外科学治疗、单发脑转移预后更佳。多因素分析中显示,KPS>70分、经神经外科学治疗与生存期有肯定相关性。故笔者认为,患者一般情况良好、RPA分级为Ⅰ级、行手术切除后放疗的患者有更好的生存期。Chidel等[5]研究1组脑转移患者放疗的预后,结果显示,KPS>80分(P=0.002)及无全身性疾病(P=0.013)患者有更长生存期,多因素分析中,只有RPA分级(P=0.023)是独立的预后因子。
在国外脑转移瘤研究中已有较广泛应用,随后出现的比较为人熟知的还有BSBM、GPA等预后指数评分。Lorenzoni等[6]提出了更为简化的分组评估生存期的方法,称为BS-BM,使用3个预后因素:KPS评分、原发肿瘤的控制及颅外转移的存在,分别赋值为1和0,将其评分相加,其值在0(最差)~3(最好)之间。评分为3分患者的中位生存期为32.0个月,2分为13.1个月,1分为3.3个月,0分为1.9个月(P<0.000 1),0分患者生存时间<4个月。研究还比较了3种方式分组评估生存率的方法(RPA分级、SIR和BS-BM),在Cox分析中得出SIR和BS-BM与生存期密切相关(P=0.031和P=0.043),而由于BS-BM简便易用,故认为其更可取。
Sperduto等[7]在RTOG9508研究中发现脑转移数目可能影响患者预后,且认为原发肿瘤控制评分存在一定主观性,故RPA指数上去除了原发灶控制情况而增加了脑转移数目的影响因素,成为GPA评分,其值在0~4分,分数越高预后越好。证实GPA是一种良好的预后指数。
本研究采用Log-rank检验提示RPA、BSBM、GPA这3种预后指数评分均与预后相关,本研究结果与国内类似文献研究也基本相 似[8],该研究在乳腺癌脑转移患者中运用RPA、GPA、BS-BM、Rades、Carsten共5种预后指数评分均可预测患者生存,但该文献患者的中位总生存期及各指数分层的中位生存期均较本组长,可能是与肿瘤原发病理类型相关。在本组数据分析中不同肿瘤病理类型脑转移放疗患者的生存期差异无统计学意义,可能与样本量偏少有关。
本研究用ROC曲线图比较预测3、6个月生存期的能力,提示PI值预测3、6个月生存ROC曲线下的面积高于其他任何3种预后指数,最佳切变值时的灵敏度为91.67%,特异度为77.94%,结果满意。分析其预测效果最好的原因为此模型基于本组数据建立,对各影响因素赋予确切的权重值,而不像以往模型基本是各因素影响是等同的。有相关文献报道在乳腺癌脑转移中预后指数PI模型和RPA分级均能很好地反映预后[9]。
总之,脑转移是恶性肿瘤晚期表现和常见的致死、致残原因,放疗是主要治疗方法之一。脑转移瘤患者生存时间受多种因素影响,本组研究提示影响预后的因素主要有KPS、中枢外转移、原发灶控制,为脑转移患者的预后评估提供了临床依据。在本组数据中RPA、BSBM、GPA这3种预后评分指数皆适用,但PI模型优于其他任何一种指数,期待更大型的前瞻性研究进一步证实。
[1]殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学(第四版)[M]. 北京: 中国协和医科大学出版社, 2008, 12, 1200-1201.
[2]范存刚, 张庆俊. 解读2010年AANS/CNS《脑转移瘤治疗的循证医学指南》[J]. 中华神经外科杂志, 2010: 26(11): 1047-1049.
[3]GASPAR L, SCOTT C, ROTMAN M, et al. Recursive partitioning analysis (RPA) of prognostic factors in three Radiation Therapy Oncology Group(RTOG) brain metastases trials [J]. Int J Radiat Oncol Biol Phys, 1997, 37(4): 745-754.
[4]SAITO E Y, VIANI G A, FERRIGNO R, et a1. Whole brain radiation therapy in management of brain metastasis: results and prognostic factors [J]. Radiat Oncol, 2006, 1: 20.
[5]CHIDEL M A, SUH J H, REDDY C A, et al. Application of recursive partitioning analysis and evaluation of the use of whole brain radiation among patients treated with stereotactic radiosurgery for newly diagnosed brain metastases [J]. Int J Radiat Oncol Biol Phys, 2000, 47(4): 993-999.
[6]LORENZONI J, DEVRIENDT D, MASSAGER N, et al. Estimation of patient eligibility using three stratification systems [J]. Int J Radiat Oncol Biol Phys, 2004, 60(1): 218-224.
[7]SPERDUTO P W, BERKEY B, GASPAR L E, et al. A new prognostic index and comparison to three other indices for patients with brain metastases: an analysis of 1,960 patients in the RTOG database[J]. Int J Radiat Oncol Biol Phys, 2008, 70(2): 510-514.
[8]章倩, 陈剑, 俞晓立, 等. 乳腺癌脑转移全脑放疗预后及预后指数分析[J]. 中华放射肿瘤学杂志, 2013, 22(3): 186-189.
[9]黄晓波, 蒋国梁, 陈佳艺. 乳腺癌脑转移放射治疗的预后因素分析[J]. 中国癌症杂志, 2004, 14(1): 44-51.
