PI3K/Akt/NF-κB通路调控ABCB1/P-gp介导的人结肠癌细胞多药耐药的研究
2014-12-06隋华付晓伶潘树芳石晓兰靳宝辉朱惠蓉任建琳李琦
隋华 付晓伶 潘树芳 石晓兰 靳宝辉 朱惠蓉 任建琳 李琦*
1.上海中医药大学附属曙光医院肿瘤科,上海201203;
2.上海中医药大学附属普陀医院肿瘤科,上海200062;
3.上海市中医医院肿瘤科,上海200071
肿瘤细胞的多药耐药(multidrug resistance,MDR)基因的表达是肿瘤化疗失败的最常见而又最难解决的问题之一[1],因其机制复杂,目前尚未得到有效解决。肿瘤细胞产生耐药性与多种因素有关,其中最主要的原因是ATP结合膜转运蛋白家族过表达诱发的细胞外排作用加强,细胞内药物浓度降低,从而引起肿瘤细胞对化疗药物的敏感性降低[2]。磷脂酰肌醇-3-激酶(phosphoinositide 3-kinases,PI3K)信号通路参与肿瘤多药耐药的发生。近年来研究发现,PI3K/Akt信号转导通路在细胞增殖、分化、肿瘤的血管形成和转移等方面起着重要的作用[3-5]。有研究表明,PI3K/Akt信号转导通路的激活参与肿瘤多药耐药的发生、发展[6],但是具体的调控机制尚不明确。本实验选用人结肠癌奥沙利铂耐药细胞株HCT-116/L-OHP及其敏感株HCT-116细胞,给予PI3K信号通路特异性的抑制剂(LY29400)干预,观察细胞的药物敏感性、相关耐药蛋白P-糖蛋白(P-glycoprotein,P-gp)、LRP、MRP-2以及PI3K/Akt信号通路上下游基因的表达变化,探讨PI3K/Akt信号转导通路对人结肠癌多药耐药细胞生物功能和耐药性的影响。
1 材料和方法
1.1 材料
1.1.1 细胞与试剂
人结肠癌细胞株HCT-116及人结肠癌耐奥沙利铂细胞株HCT-116/L-OHP购自上海博谷生物科技有限公司。细胞计数试剂盒8-(cell counting kit-8,CCK-8)试剂盒购自上海同仁化工有限公司;PI3K/Akt信号通路特异性的抑制剂LY294002购于美国Serologllcais公司;奥沙利铂50 mg(批号:H20000337)购于江苏恒瑞医药股份有限公司。总RNA抽提试剂RNAiso Reagent、定量PCR试剂购于日本TaKaRa公司;GAPDH和ABCB1基因上下游引物和探针由生工生物工程(上海)有限公司设计并合成。蛋白质抽提试剂盒(Sangon S-415)、BCA蛋白质定量试剂购自上海博谷生物科技有限公司;SDS-PAGE电泳试剂购自上海博彩生物技术有限公司;兔抗人P-gp、LRP、MRP-2、Akt、p-Akt、IκB、p-IκB单克隆抗体购自美国CST公司。
1.1.2 仪器
Mastercyclerep银 质 梯 度PCR仪、Biophotometer生物分光光度计、5804R高速冷冻离心机购自德国Eppendorf公司;CKX41/U-RFLT50荧光倒置显微镜购自日本OLYMPUS公司。
1.2 方法
1.2.1 细胞培养
HCT-116/L-OHP及HCT-116细胞于含10%小牛血清的RPMI-1640培养液(含青霉素、链霉素各100 U/mL)中,在37 ℃、CO2体积分数为5%、饱和湿度培养箱中常规培养。HCT-116/L-OHP细胞的奥沙利铂维持浓度为10 μg/mL,实验在停用奥沙利铂培养2周后取处于对数生长期的细胞进行。
1.2.2 用CCK-8检测细胞增殖情况
按照H CT-116细胞株敏感组,HCT-116/L-OHP细胞株耐药组,HCT-116/L-OHP+LY294002(20 μmol/L,2 h)分组,将各组调整至1×105/mL,以每孔100 μL接种于96孔细胞培养板中,在37 ℃、CO2体积分数为5%、饱和湿度培养箱中常规培养,待细胞贴壁后3~5 h后,除对照组外各自加入含不同浓度化疗药物的培养基100 μL,每组设4个复孔。培养48 h后每孔加10%CCK-8的培养基,培养箱内继续培养1.5 h后,于酶标仪检测450 nm波长处吸光度(A值)。计算细胞的生长抑制率、耐药指数(resistance factor,RF)和逆转指数(resistance index,RI)。计算公式:生长抑制率=(1- A实验组平均值/ A对照组平均值)×100%;RF=某种药物针对抗药性细胞的IC50/某种药物针对敏感性细胞的IC50;RI=不加逆转剂时某种药物针对抗药性细胞的IC50/加入逆转剂后某种药物针对抗药性细胞的IC50。实验重复3次。
1.2.3 蛋白质印迹法(Western blot)检测P-gp、LRP、MRP-2、Akt、p-Akt、IκB、p-IκB蛋白的表达
收集处于对数生长期细胞约2×106个/组,用预冷PBS洗涤2次,吸弃PBS,加入预冷的蛋白裂解液在冰上裂解0.5 h,14 000×g离心15 min,吸弃上清液;BCA分析试剂测定蛋白质浓度。50 μg总蛋白质在SDS聚丙烯酰胺凝胶电泳中电泳,PVDF膜转膜,5%脱脂奶粉封闭非特异性抗体,然后分别加入各种抗体,按1∶1 000封闭,4 ℃过夜。次日用TBS/T洗膜3次,再加入HRP标记的二级抗体,置室温温育膜1 h,ECL显色。GAPDH作内参对照,分析灰度值进行计算灰度系数比。
1.2.4 染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)RT-PCR
按照EZ—ChIP试剂盒步骤,直接在细胞培养液中加入适量37%甲醛,致其终浓度为1%,37 ℃温育10 min,进行交联。用预冷的含1 mmol/L PMSF的PBS洗涤细胞,收集细胞至浓度为1×106个。4 ℃、3 000×g离心5 min去上清液,收集细胞后加入SDS裂解液重悬。超声破碎DNA后,4 ℃ 12 000×g离心5 min,取出20 μL样品作为阳性对照(Input)用于后续检测。其余近2 mL样品加入70 μL Protein A+G Agarose/Salmon Sperm DNA,于4 ℃缓慢摆动混匀30 min。于4 ℃,1 000×g条件下离心1 min,将上清液转移至新的2 mL离心管中,加入适量p65(NF-κB)、IgG单克隆抗体(阴性对照)4 ℃缓慢摆动混匀过夜。加入60 μL Protein A+G Agarose/Salmon Sperm DNA,于4 ℃缓慢摆动混匀60 min,以沉淀一抗识别的蛋白或相应复合物。于4 ℃,1 000×g条件下离心1 min,吸尽上清液后依次用如下溶液对沉淀进行洗涤,每次用1 mL的洗涤液5 ℃缓慢摆动洗涤3~5 min,随后于4 ℃,1 000×g条件下离心1 min,弃上清液。所获得的沉淀即可用于PCR扩增目的基因序列。
RT-PCR:沉淀加入250 μL洗脱缓冲液,Vortex混匀,室温摆动洗脱3~5 min,1 000×g离心1 min,取上清液,同样步骤再次洗脱取上清液,2次上清液混合共计约500 μL。500 μL上清液中加入20 μL 5 mol/L NaCl溶液,阳性对照的20 μL样品加入1 μL NaCl溶液,混匀。65 ℃加热4 h去除蛋白和基因组DNA之间的交联。PCR验证ChIP:提纯的DNA进行PCR分析,模板分别为无DNA对照、阴性抗体免疫共沉淀的DNA、阳性对照DNA(InputDNA)、阳性抗体免疫共沉淀的DNA。引物为针对ABCB1基因启动子的引物对(引物序列为顺义链:5’-CCACTCCTCCACCTTTGAC-3’;反义链:5’-ACCCTGTTGCTGTAGCCA-3’)。PCR产物大小为379 bp。热循环条件:95 ℃预变性3 min;94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s,共30个循环,72 ℃延伸5 min。反应结束后各取10 μL PCR产物在2%琼脂糖凝胶上电泳。
1.3 统计学处理
采用SPSS 13.0统计软件包处理数据。各组数据采用±s 表示,两独立样本均数比较,采用独立样本 t 检验,多样本均数比较采用单因素方差分析,均数间两两比较采用SNK-q检验(Student-Newman-KeμLs法),求出组间差异。P<0.05为差异有统计学意义。
2 结 果
2.1 人结肠癌HCT-116/L-OHP细胞对化疗药物敏感性的影响
奥沙利铂对H C T-1 1 6 细胞的半数抑制浓度(I C50)为(1 9.8 4±1.4 2)μ g/m L,奥沙利铂对H C T-11 6/L-O H P 细胞的I C50为(157.48±16.73)μg/mL,耐药指数为7.94,差异有统计学意义(P<0.01)。HCT-116/L-OHP细胞加入PI3K抑制剂LY294002(20 μmol/L)2 h后,奥沙利铂对其的IC50降至(53.68±3.18)μg/mL,逆转指数为2.93,与未加LY294002组比较,差异有统计学意义(P<0.01,图1)。提示抑制PI3K/Akt信号通路的激活可以增强人结肠癌HCT-116/L-OHP细胞对奥沙利铂的敏感性。
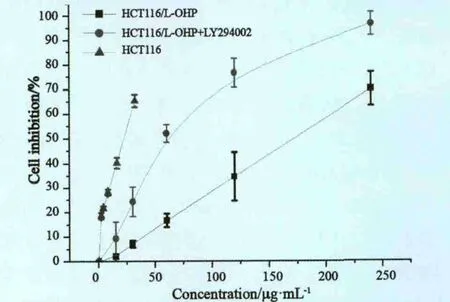
图1 LY294002对HCT-116/L-OHP细胞生存率的影响Fig.1 Effect of LY294002 on cell survival in HCT-116/L-OHP cells
2.2 人结肠癌HCT-116/L-OHP细胞对相关耐药蛋白P-gp、MRP-2、LRP表达的影响
Western blot检测结果显示,人结肠癌HCT-116/L-OHP耐药细胞的P-gp、LRP、MRP-2蛋白相对表达量均明显高于敏感细胞HCT-116(P<0.01)。将LY294002作用HCT-116/L-OHP后,P-gp的表达降低明显(P<0.01),但是LRP、MRP-2的表达差异无统计学意义(P>0.05,图2)。
2.3 LY294002对人结肠癌HCT-116/L-OHP细胞Akt、p-Akt、IκB、p-IκB表达的影响
与敏感细胞HCT-116相比,人结肠癌耐药细胞HCT-116/L-OHP的p-Akt(Thr307)、p-Akt(Ser473)以及p-IκB蛋白的相对表达量均明显升高,差异有统计学意义(P<0.01)。但是Akt和IκB蛋白的相对表达量差异无统计学意义(P>0.05),提示PI3K/Akt/NF-κB信号通路在肠癌耐药细胞中处于激活状态。当HCT-116/L-OHP细胞加入LY294002后,p-Akt(Ser473)和p-IκB蛋白的表达下调,与HCT-116/L-OHP细胞相比,差异有统计学意义(P<0.01)。但是p-Akt(Thr307)没有受到LY294002的影响,与未加入LY294002的耐药细胞相比,差异无统计学意义(P>0.05)。提示阻断PI3K/Akt信号通路后可降低HCT-116/L-OHP耐药细胞p-Akt(Ser473)和p-IκB蛋白的表达,抑制p-Akt(Ser473)的磷酸化可以阻断p-Akt/p-IκB的信号传递(图3)。
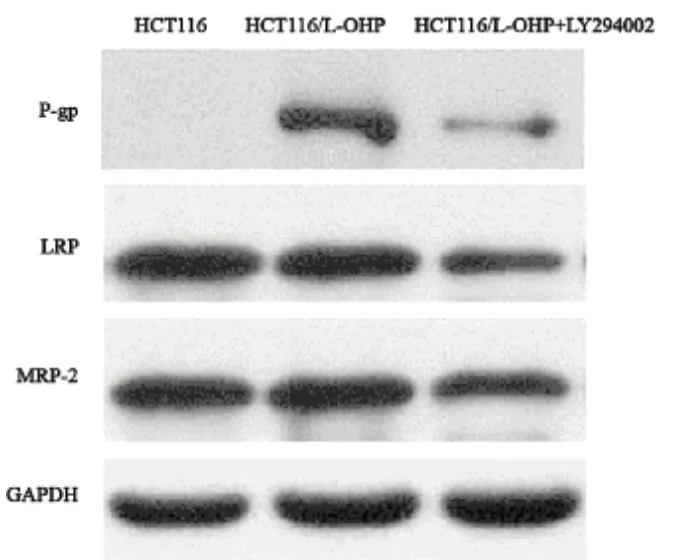
图2 LY294002对人结肠癌HCT-116/L-OHP细胞P-gp、MRP-2、LRP表达的影响Fig.2 Effect of LY294002 on P-gp, MRP-2, LRP expression in HCT-116/L-OHP cells

图3 LY294002对HCT116/L-OHP细胞内PI3K/Akt/NF-κB信号通路的影响Fig.3 Effect of LY294002 on PI3K/Akt/NF-κB signal pathway in HCT-116/L-OHP cells
2.4 NF-κB对ATP结合蛋白亚家族1抗体(ATP-binding cassette sub-family B member 1,ABCB1)基因启动子的影响
CHIP—PCR结果分析显示,空白对照无扩增产物条带;阴性IgG抗体(阴性对照)沉淀所得DNA的扩增产物少,电泳条带最弱;用未经抗体沉淀的Input DNA(阳性对照)扩增的产物电泳条带最强;用NF-κB抗体沉淀所得DNA作为模板扩增出了ABCB1基因的条带,提示NF-κB能够与ABCB1基因在启动子区域相结合,启动ABCB1基因的转录程序(图4)。
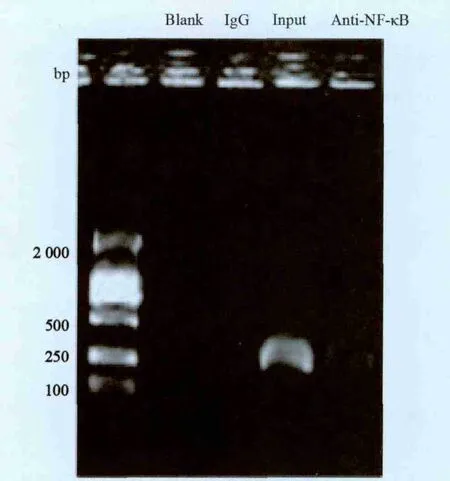
图4 NF-κB对ABCB1基因启动子的影响Fig.4 Effect of NF-κB on ABCB1 promoter
3 讨 论
大量临床研究证实,大肠癌的多药耐药与ATP结合膜转运蛋白家族中的P-gp、MRP和LRP的过表达相关[7-8]。P-gp是相对分子质量为170×103的跨膜糖蛋白,由ABCB1基因编码,具有12个跨膜区和2个细胞内ATP连结点[9]。当肿瘤细胞长期接触抗癌药物时,ABCB1基因被诱导扩增,P-gp被大量表达,其ATP结合点上连接的ATP水解后释放的能量能将抗癌药物转移到细胞外,使细胞内蓄积药物减少,降低作用靶点部位的药物浓度,导致化学治疗的效果下降乃至消失。本课题组前期研究发现,P-gp的过表达与结肠癌HCT8/V细胞的多药耐药相关[10],但是具体机制尚不明确。
近年来的研究表明,PI3K/Akt信号途径与肿瘤的多药耐药密切相关[11]。在PI3K信号转导途径中,当上游信号途径刺激细胞膜表面时,导致酪氨酸激酶自磷酸化或磷酸化其他底物后,可在细胞膜内表面产生PI3K结合位点,PI3K激活下游的Akt。活化的Akt可以通过磷酸化其473位的丝氨酸位点(Ser473)或者第307位苏氨酸位点(Thr307),进而激活或抑制其下游靶蛋白从而介导细胞的增殖、分化、凋亡、迁移和细胞周期的调控。Jiao等[12]研究发现化疗药物能通过激活PI3K显著提高磷酸化的Akt水平,最终导致乳腺癌细胞对化疗药物耐药;进一步研究证实,阻断PI3K/Akt信号转导通路可导致P-gp蛋白表达下调,从而逆转多药耐药。此外,Abdul等[13]发现在耐药的结肠腺癌细胞HT29RDB中,PI3K-Akt信号途径的阻滞剂LY294002与多柔比星联合使用能够在MRP1介导的耐药机制中发挥治疗作用,可使细胞内多柔比星药物浓度增加3倍以上。但是,PI3K/Akt信号通路的激活是如何改变ABCB1基因的表达以及影响程度,目前都尚未明确。
作为PI3K/Akt信号通路下游的核转录因子,NF-κB是一种广泛存在于真核细胞内的基因多向性转录因子,可以激活多种细胞进程的基因转录,包括炎性反应、细胞增殖、分化及凋亡等[14]。典型的NF-κB以p50-p65异源二聚体组成,在大多数细胞的静息状态下,NF-κB与其抑制分子IκB-α结合存在于细胞质中[15]。当细胞受到外界信号(如脂多糖、特异的细胞因子)刺激时,PI3K/Akt信号通路上的Akt蛋白发生磷酸化,引起一系列连锁的酶促反应,促使下游IκB-α发生磷酸化而与NF-κB解离,NF-κB激活而移位进入细胞核内,与DNA上相应位点结合来发挥生物学效应。已有研究在鼠肝癌细胞中发现,NF-κB可以直接与ABCB1b启动子区-205至+42之间的序列(5'-GGGGAATTCC-3')结合,激活ABCB1b基因的转录、扩增,诱发P-gp的过度表达[16]。
本研究显示,应用PI3K/Akt信号通路特异性抑制剂LY294002后,奥沙利铂对HCT-116/L-OHP细胞的IC50由(157.48±16.73)μg/mL降至(53.68±3.18)μg/mL,说明阻断PI3K/Akt信号通路能降低细胞的耐药性,使HCT-116/L-OHP细胞的抑制率增高。进一步研究发现,LY294002可以降低HCT-116/L-OHP细胞P-gp的表达,提示PI3K/Akt信号通路可能是通过诱导P-gp的过表达,从而引起肠癌耐药的发生。Western blot检测结果显示,LY294002主要是通过抑制HCT-116/L-OHP耐药细胞p-Akt(Ser473)和p-IκB磷酸化的发生,提示相对于HCT-116敏感细胞,HCT-116/L-OHP耐药细胞中存在PI3K/p-Akt/p-IκB信号途径的异常活化。ChIP-PCR检测结果显示,NF-κB能够与ABCB1基因在启动子区域相结合,启动ABCB1基因的转录,引起P-gp的过表达。
综上所述,PI3K信号通路通过激活人结肠癌HCT-116/L-OHP细胞的p-Akt/p-IκB信号途径,促使NF-κB与ABCB1基因在启动子区域相结合,启动ABCB1基因的转录,引起P-gp的过表达。PI3K信号通路的抑制剂LY294002可能是通过阻断该途径,从而增强耐药细胞对化疗药物的敏感性,逆转肠癌多药耐药。
[1]SUI H, ZHOU S, WANG Y, et al.COX-2 contributes to P-glycoprotein-mediated multidrug resistance via phosphorylation of c-Jun at Ser63/73 in colorectal cancer [J].Carcinogenesis, 2011, 32(5): 667-675.
[2]YU M, OCANA A, TANNOCK I F.Reversal of ATP-binding cassette drug transporter activity to modulate chemoresistance: why has it failed to provide clinical benefit? [J].Cancer Metastasis Rev, 2013, 32(1-2): 211-227.
[3]FANG Y, XUE J L, SHEN Q, et al.miR-7 Inhibits tumor growth and metastasis by targeting the PI3K/Akt pathway in hepatocellular carcinoma [J].Hepatology, 2012, 55(6): 1852-1862.
[4]GUO H, GAO M, LU Y, et al.Coordinate phosphorylation of multiple residues on single AKT1 and AKT2 molecules [J].Oncogene, 2013.doi: 10.1038/onc.2013.301.
[5]郭崇勇, 柯卫锋, 宋科瑛, 等.PI3K/AKT通路参与调控乳腺癌多药耐药和侵袭转移的研究[J].现代生物医学进展, 2012, 12(25): 4809-4812.
[6]SUI H, FAN Z Z, LI Q.Signal transduction pathways and transcriptional mechanisms of ABCB1/Pgp-mediated multiple drug resistance in human cancer cells [J].J Int Med Res, 2012, 40: 426-435.
[7]FIGUEIREDO L L, PINTAO M C, OLIVEIRA L C, et al.Determination of P-glycoprotein, MDR-related protein 1, breast cancer resistance protein, and lung-resistance protein expression in leukemic stem cells of acute myeloid leukemia [J].Cytometry B Clin Cytom, 2008, 74(3): 163-168.
[8]潘树芳, 隋华, 李琦, 等.microRNAs调控消化系肿瘤多药耐药的研究进展[J].世界华人消化杂志, 2013, 21(19): 1834-1840.
[9]WARD A B, SZEWCZYK P, GRIMARD V, et al.Structures of P-glycoprotein reveal its conformational flexibility and an epitope on the nucleotide-binding domain [J].Proc Natl Acad Sci U S A, 2013, 110(33): 13386-13391.
[10]隋华, 周利红, 刘宣, 等.COX-2介导MDR1/P-gp调控人结肠癌细胞多药耐药的研究[J].中国癌症杂志, 2011, 21(4): 241-246.
[11]张晔, 刘云鹏.PI3K/Akt信号转导通路与肿瘤多药耐药研究进展[J].中华临床医师杂志, 2011, 5(2): 446-449.
[12]JIAO M, NAN K J.Activation of PI3 kinase/Akt/HIF-1α pathway contributes to hypoxia-induced epithelialmesenchymal transition and chemoresistance in hepatocellular carcinoma [J].Int J Oncol, 2012, 40(2): 461-468.
[13]ABDUL R, SERRA V, GYORFFY B, et al.The PI3K inhibitor LY294002 blocks drug export from resistant colon carcinoma cells overexpressing MRP1 [J].Oncogene, 2006, 25(12): 1743-1752.
[14]刘海楠, 陈雷, 高彦宏.NF-κB国外最新研究进展[J].临床合理用药杂志, 2011, 4(4): 159-160.
[15]CHATURVEDI M M, SUNG B, YADAV V R, et al.NF-κB addiction and its role in cancer: ‘one size does not fit all’ [J].Oncogene, 2011, 30(14): 1615-1630.
[16]TAKADA Y, KOBAYASHI Y, AGGARWAL B B.Evodiamine abolishes constitutive and inducible NF-κB activationby inhibiting IκBα kinase activation, thereby suppressing NFκB-regulated antiapoptotic and metastatic gene expression, up-regulating apoptosis, and inhibiting invasion [J].J Biol Chem, 2005, 290(17): 17203-17212.
