胰腺癌细胞PANC-1中LSD1负向调控抑癌基因SIRT3的实验研究
2014-12-06徐近秦毅张波吉顺荣许文彦施思刘江虞先濬
徐近 秦毅 张波 吉顺荣 许文彦 施思 刘江 虞先濬
复旦大学附属肿瘤医院胰腺肝胆外科,复旦大学上海医学院肿瘤学系,胰腺肿瘤研究所,上海 200032
人类基因组计划基本完成后,研究基因的表达调控成为了解肿瘤发生机制的关键问题之一。随着研究的不断深入,科学家们发现基因的表达不仅取决于基因本身,还取决于不改变基因序列的表观遗传修饰。异常的表观遗传修饰会使基因发生错误的表达,进而引起代谢模式的异常,甚至导致肿瘤的发生、发展。表观遗传修饰主要涉及DNA甲基化、组蛋白修饰、染色质重塑以及非编码RNA调控等方式。其中组蛋白修饰因为其修饰的多样性,以及遗传密码的丰富性而备受关注,随着组蛋白乙酰化抑制剂等在治疗肿瘤患者的成功临床应用,组蛋白修饰逐渐成为肿瘤表观遗传学的研究重点[1-2]。
组蛋白赖氨酸去甲基化酶1(lysine specific demetylase1,LSD1)是第一个被发现的组蛋白去甲基化酶,通过催化组蛋白赖氨酸的去甲基化过程参与染色质结构的调整进而影响基因的转录调控[3]。LSD1通过异常的基因表达调控,在肿瘤的发生、发展、侵袭、转移以及代谢异常等方面发挥着重要的作用,是一个潜在的干预肿瘤恶性潜能的靶点[4-6]。肿瘤的代谢异常是近些年研究的热点。新陈代谢是机体生命活动的基本特征,肿瘤的恶性潜能离不开代谢模式的转变来为其提供物质和能量,大量的研究证实干预肿瘤的代谢也是一个重要的干预靶点[7-9]。在肿瘤代谢的关键调控分子中,Sirtuins 或沉默信息调节蛋白(silencing information regulator 2,Sir2)类似酶家族蛋白,因其在能量代谢,细胞氧化应激,以及细胞长寿和衰老方面的重要作用而成为肿瘤代谢异常的研究热点分子。该家族中的分子去乙酰化酶3(sirtuin3,SIRT3),位于线粒体内,是线粒体内的肿瘤抑制因子,通过调控细胞内的活性氧水平和糖代谢水平而发挥抑癌基因的功能。SIRT3在肿瘤细胞中的低表达或者缺失会激发肿瘤细胞的恶性潜能已经成为共识,但是其低表达的分子机制还有待深入研究[10-13]。
本文通过RNA干扰(RAN interference,RNAi)、免疫共沉淀(co-immunoprecipitation,CoIP)、染色质免疫共沉淀(chromatin immunoprecipitation assay,ChIP)及启动子活性分析实验,研究PANC-1细胞中LSD1与SIRT3基因转录调控的关系,并为深入研究LSD1与胰腺肿瘤代谢异常提供了重要依据。
1 材料和方法
1.1 细胞培养
PANC-1细胞和HEK293T细胞购自中国科学院上海生命科学研究院细胞资源中心,培养基为含有10%胎牛血清的DMEM培养基(GIBCO公司),在37 ℃,CO2体积分数为5%的条件下培养。
1.2 质粒构建
LSD1和PGC-1α的蛋白编码区域分别克隆至真核表达载体pCMV-C-FLAG和pCMV-CHA中,得到FLAG融合的LSD1和HA融合的PGC-1α。
1.3 CoIP实验
FLAG-LSD1质粒和HA-PGC-1α质粒转染PANC-1细胞48 h后,用预冷的PBS清洗细胞2次。用1 mL RIPA缓冲液[20 mmol/L Tris-HCl(pH为8.0),1% NP40,150 mmol/L NaCl,10% Glycerol,Roche cocktail抑制剂]冰上裂解30 min,随后超声破碎3次 ,功率100 W,超声5 s,间隙20 s。12 000 r/min离心10 min后,去离心后,将细胞上清液与偶联了FLAG抗体的亲和胶(Sigma公司)共同在4 ℃旋转结合4 h。用RIPA缓冲液洗涤6次后,用FLAG肽竞争性洗脱1 h。洗脱样品与2XSDS-PAGE上样缓冲液混合,100 ℃水浴5 min。
1.4 蛋白质印迹法(Western blot)检测
样品与蛋白上样缓冲液煮沸5 min,SDSPAGE电泳分离样品。湿法将蛋白转移至Portran硝酸纤维素膜,用含有5%脱脂奶粉的PBST室温封闭1 h。一抗与膜共同温育2 h至过夜。PBST洗膜3次,每次10 min,二抗与膜共同温育1 h,再用PBST洗膜3次,ECL显色。
1.5 免疫荧光检测
将FLAG-LSD1质粒和HA-PGC-1α质粒共转至在玻片上培养的PANC-1细胞中,培养36 h,用PBS洗涤1次,3.7%的多聚甲醛固定10 min,PBST洗涤2次,每次5 min。0.5%的Triton-X100破膜10 min,随后用PBST+1% BSA洗涤2次。PBST(1%)BSA封闭30 min。将一抗稀释到PBST/BSA中,与玻片室温温育2 h或者4 ℃过夜,PBST/BSA洗涤3次,每次10 min,加二抗温育1 h。PBST/BSA洗涤3次,每次5 min,加含有DAPI的封片剂封片,4 ℃避光保存。激光共聚焦显微镜观察,拍照。
1.6 ChIP实验
ChIP实验采用Millipore公司的ChIP试剂盒(EZ CHIP KIT),所用的LSD1和PGC-1α抗体购自Abcam公司,检测SIRT3基因启动子区域的引物顺义链:5′-TACGTCTACCTGGGCGCGCCGG-3′;反义链:5′-CAAGGAGTCCTCCGGACTCGC-3′。
1.7 LSD1基因敲除细胞株的构建
构建pLKO.1-shLSD1的慢病毒表达克隆用来稳定表达针对LSD1的shRNA,21 bp的靶位点分别为CCACGAGTCAAACCTTTATTT 和CCAACAATTAGAAGCACCTTA。共转pLKO.1-shLSD1、psPAX和pMD2.G至HEK293T细胞中,48 h后收集培养基上清液得到慢病毒颗粒。用慢病毒颗粒感染PANC-1细胞,并用嘌呤霉素进行抗性筛选,得到稳定表达shLSD1的PANC-1细胞株。
1.8 实时荧光定量PCR
TRIzol法提取总RNA,反转录采用Invitrogen公司的SuperScriptⅢ试剂盒,定量PCR采用TAKARA公司的试剂盒。针对LSD1的引物为LSD1顺义链:5’-GCTCGGGGCTCTTATTCCTA-3’;LSD1反义链:5’-CCCAAAAACTGGTCTGCAAT-3’;针对SIRT3的引物为SIRT3顺义链:5′-ACCCAGTGGCATTCCAGAC-3′;S I R T 3 反 义 链:5′-G G C T T G G G G T T G TGAAAGAAG-3′;内参引物为β-actin顺义链5′-AGAGCTACGAGCTGCCTGAC-3′;β-actin反义链:5′-AGCACTGTGTTGGGTACAG-3’。
1.9 双荧光素酶报告基因分析
SIRT3基因的启动子克隆至载体pGL2-Basci中,得到pGL2-SIRT3克隆,转染PANC-1细胞,分析PGC-1α以及LSD1对SIRT3基因启动子活性的影响。试剂盒采用Promega公司的双荧光素酶报告基因检测系。
1.10 统计学处理
2 结 果
2.1 干扰LSD1对PANC-1细胞中SIRT3表达的影响
设计针对LSD1的shRNA序列,构建慢病毒表达载体,包装慢病毒后,感染PANC-1细胞后,检测LSD1的干扰效果以及干扰LSD1后SIRT3表达水平的变化。与对照细胞相比,两条shRNA能够有效地干扰LSD1表达,mRNA水平分别下调72%和57%,差异有统计学意义(P<0.001和P=0.026)。同时在干扰LSD1表达的PANC-1细胞中,SIRT3的转录水平明显上调,与对照细胞相比分别上调4.32和5.72倍,差异有统计学意义(P=0.028和P<0.001)。Western blot检测结果显示,在LSD1基因敲除的细胞中,SIRT3蛋白水平明显上升(图1)。
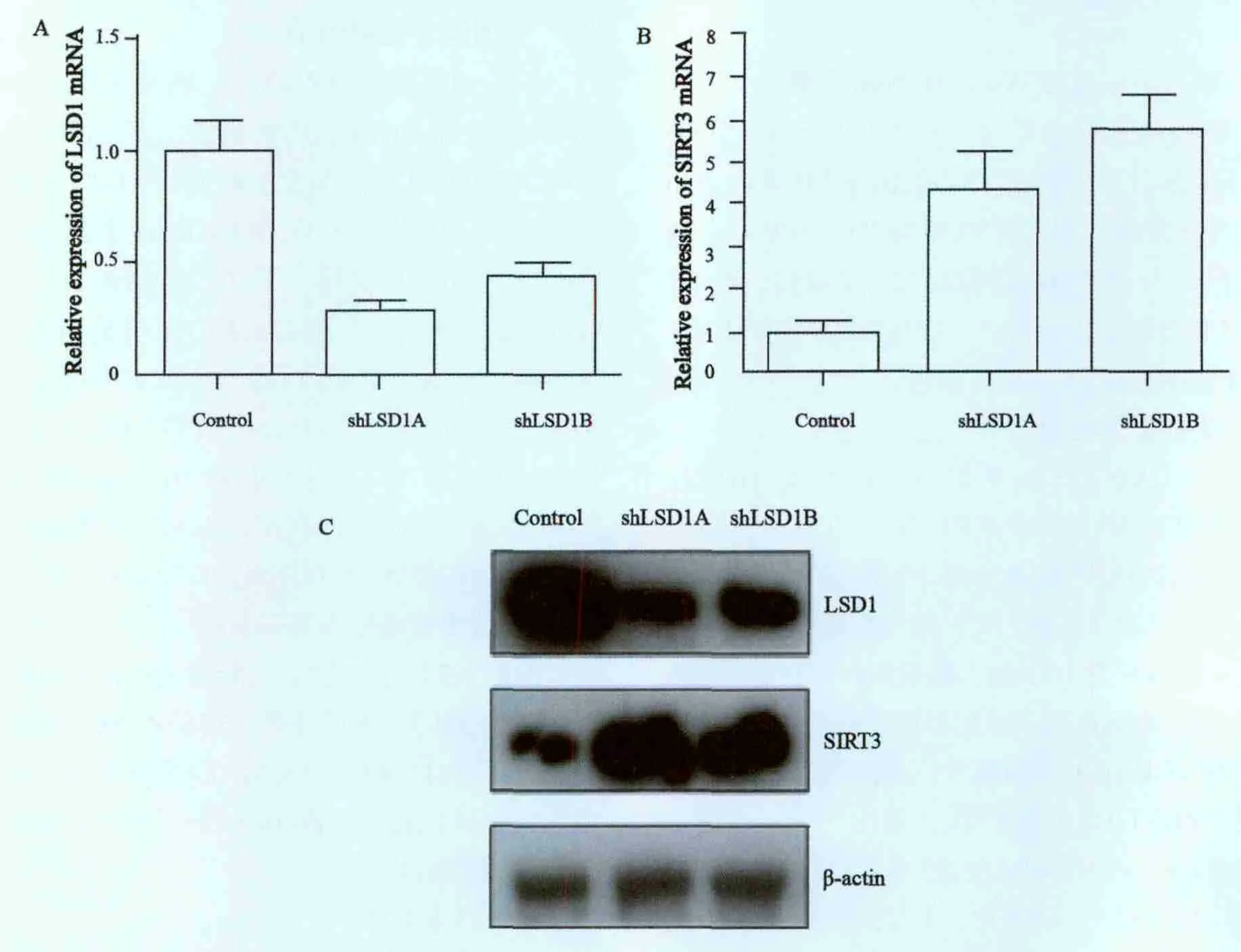
图1 干扰LSD1对PANC-1细胞中SIRT3表达的影响Fig.1 Effect of LSD1 knock-down on the expression of SIRT3
2.2 LSD1与PGC-1α相互作用
在PANC-1细胞中转染FLAG-LSD1和HAPGC-1α,通过CoIP的方法发现,LSD1与PGC-1α存在相互作用。在PANC-1细胞中,再次通过CoIP的方法,以LSD1的抗体进行免疫沉淀,在免疫沉淀产物中检测PGC-1α,证实LSD1与PGC-1α存在内源的相互作用。通过免疫荧光,发现LSD1与PGC-1α在细胞核内存在共定位(图2)。
2.3 LSD1与PGC-1α共定位于SIRT3基因的启动子区域
采用LSD1抗体进行ChIP实验,发现LSD1可以结合SIRT3基因的启动子。进一步采用PGC-1α抗体进行ChIP实验,发现PGC-1α也可以结合在SIRT3基因的启动子上。在证实LSD1和PGC-1α可以结合在SIRT3基因的启动子区域后,采用二次ChIP实验,发现LSD1和PGC-1α可以共同结合在SIRT3基因的启动子上(图3)。
2.4 LSD1抑制PGC-1α对SIRT3启动子转录活性的调控
PGC-1α是一个已知的调控SIRT3转录的转录因子,通过荧光素酶报告基因实验进行启动子活性分析发现,LSD1可以显著抑制PGC-1α对于SIRT3基因启动子的激活效应,抑制效率为19.6%,差异有统计学意义(P<0.001)。进而证实LSD1是PGC-1α的辅抑制子,可以抑制SIRT3基因的转录(图4)。
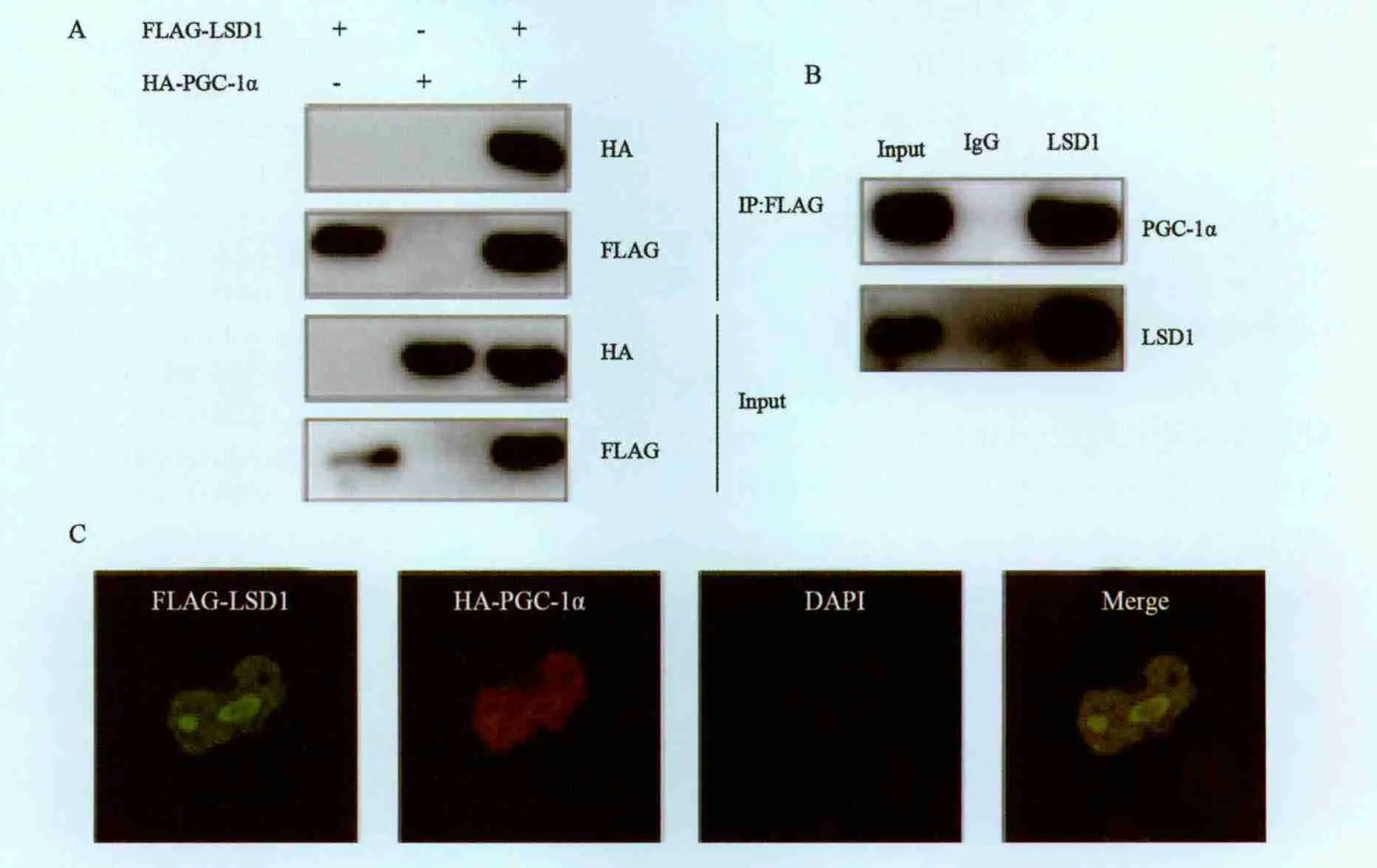
图2 LSD1与PGC-1α相互作用Fig.2 LSD1 interacted with PGC-1α

图3 LSD1与PGC-1α共定位于SIRT3基因启动子区域Fig.3 LSD1 and PGC-1α co-occupy the same chromatin region in SIRT3 promoter
3 讨 论
LSD1的发现是表观遗传学研究领域的重要进展。LSD1可以结合在基因的染色质区域,通过调节染色质的结构调控基因的表达,通过调控细胞增殖和分裂相关因子的表达影响肿瘤的发生、发展。基于LSD1在表观遗传调控方向的重要作用,其在肿瘤中的作用也逐渐得到重视。随着肿瘤代谢异常与肿瘤恶性潜能的关系研究不断深入,LSD1在肿瘤代谢方面的作用也逐渐引起关注[14-15]。
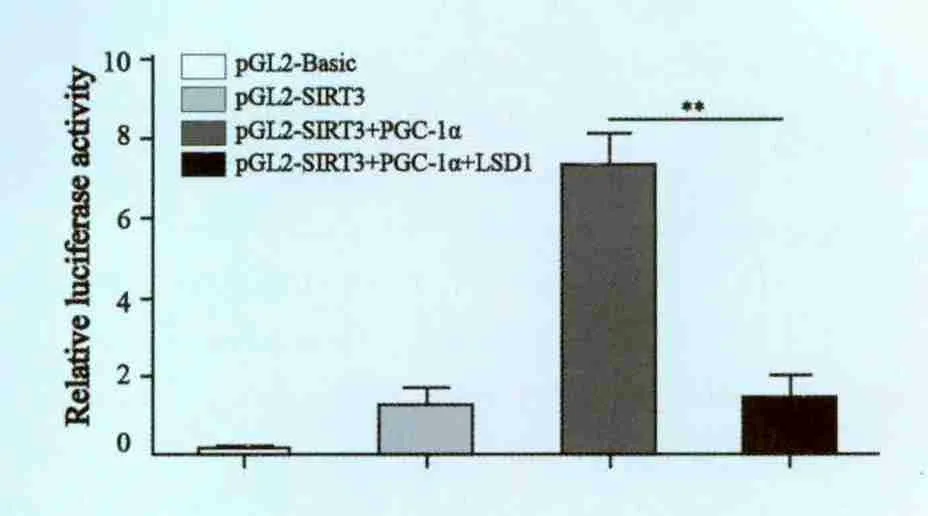
图4 LSD1抑制PGC-1α对SIRT3启动子转录活性的调控Fig.4 LSD1 inhibits PGC-1α transcriptional activity on SIRT3 expression
本研究发现,LSD1可以负向调控肿瘤代谢重要调控因子SIRT3的表达。细胞内SIRT3的表达主要受到PGC-1α的调控,PGC-1α是核受体的辅因子,最早发现于1998年,在细胞的葡萄糖、脂肪酸以及线粒体的氧化应激方面起着重要的作用,是治疗肥胖、糖尿病等疾病的药物靶点[16-17]。通过CoIP以及免疫荧光检测蛋白共定位的实验,我们在PANC-1细胞中验证了LSD1与PGC-1α的相互作用,为揭示LSD1在胰腺癌中代谢异常方面的作用提供了重要依据。
综上所述,LSD1可以与PGC-1α相互作用而调控重要代谢调控因子SIRT3的表达。本研究为研究肿瘤代谢表观遗传调控提供了新的思路,也为研究改善胰腺肿瘤代谢异常而抑制胰腺癌恶性潜能提供了新的分子靶标。
[1]DAWSON M A, KOUZARIDES T.Cancer epigenetics: From mechanism to therapy [J].Cell, 2012, 150(1): 12-27.
[2]FEINBERG A P, TYCKO B.The history of cancer epigenetics [J].Nature reviews Cancer, 2004, 4(2): 143-153.
[3]SHI Y, LAN F, MATSON C, et al.Histone demethylation mediated by the nuclear amine oxidase homolog lsd1 [J].Cell, 2004, 119(7): 941-953.
[4]WANG Y, ZHANG H, CHEN Y, et al.Lsd1 is a subunit of the nurd complex and targets the metastasis programs in breast cancer [J].Cell, 2009, 138(4): 660-672.
[5]LYNCH J T, HARRIS W J, SOMERVAILLE T C.Lsd1 inhibition: A therapeutic strategy in cancer? [J].Expert Opin Ther Targets, 2012, 16(12): 1239-1249.
[6]FERRARI-AMOROTTI G, FRAGLIASSO V, ESTEKI R, et al.Inhibiting interactions of lysine demethylase lsd1 with snail/slug blocks cancer cell invasion [J].Cancer Res, 2013, 73(1): 235-245.
[7]TEICHER B A, LINEHAN W M, HELMAN L J.Targeting cancer metabolism [J].Clini Cancer Res, 2012, 18(20): 5537-5545.
[8]BIRSOY K, SABATINI D M, POSSEMATO R.Untuning the tumor metabolic machine: Targeting cancer metabolism: A bedside lesson [J].Nature Med, 2012, 18(7): 1022-1023.
[9]CANTOR J R, SABATINI D M.Cancer cell metabolism: One hallmark, many faces [J].Cancer Dis, 2012, 2(10): 881-898.
[10]HOUTKOOPER R H, PIRINEN E, AUWERX J.Sirtuins as regulators of metabolism and healthspan [J].Nature Rev Mol Cell Biol, 2012, 13(4): 225-238.
[11]ALHAZZAZI T Y, KAMARAJAN P, VERDIN E, et al.Sirtuin-3 (sirt3) and the hallmarks of cancer [J].Genes Cancer, 2013, 4(3-4): 164-171.
[12]FINLEY L W, CARRACEDO A, LEE J, et al.Sirt3 opposes reprogramming of cancer cell metabolism through hif1alpha destabilization [J].Cancer cell, 2011, 19(3): 416-428.
[13]FINLEY L W, HAIGIS M C.Metabolic regulation by sirt3: Implications for tumorigenesis [J].Trends Mol Med, 2012, 18(9): 516-523.
[14]HINO S, SAKAMOTO A, NAGAOKA K, et al.Fad-dependent lysine-specific demethylase-1 regulates cellular energy expenditure [J].Nat Commun, 2012, 3: 758.doi: 10.1038/ncomms1755.
[15]OUYANG H, QIN Y, LIU Y, et al.Prox1 directly interacts with lsd1 and recruits the lsd1/nurd complex to epigenetically co-repress cyp7a1 transcription [J].PloS One, 2013, 8(4): e62192.
[16]GIRALT A, HONDARES E, VILLENA J A, et al.Peroxisome proliferator-activated receptor-gamma coactivator-1alpha controls transcription of the sirt3 gene, an essential component of the thermogenic brown adipocyte phenotype [J].J Biol Chem, 2011, 286(19): 16958-16966.
[17]VAZQUEZ F, LIM J H, CHIM H, et al.Pgc1alpha expression defines a subset of human melanoma tumors with increased mitochondrial capacity and resistance to oxidative stress [J].Cancer Cell, 2013, 23(3): 287-301.
