西南地区水稻细菌性条斑病菌对申嗪霉素及噻唑锌敏感基线的建立
2014-12-05周丽洪姬广海
周丽洪,韩 阳,杨 俊,李 淼,姬广海
(云南农业大学植物保护学院,云南昆明 650201)
水稻细菌性条斑病(bacterial leaf streak,简称BLS)是由Xanthomonas oryzae pv.oryzicola(Xoc)侵染引起的细菌性病害.1918年,Reinking[1-2]首先报道了菲律宾水稻上发生的细菌性条斑病.1955年在我国广东省首次发现该病[3].1957年方中达等[4]做了病原菌鉴定,并将该病害命名为水稻条斑病,其病原菌命名为稻生黄单胞菌(Xanthomonas oryzicola n.sp.Fang et al).该病是目前威胁我国南方稻区水稻生产的重要病害,也是我国、美国和澳大利亚等国重要的检疫性水稻病害[5].该病的发生具有流行性、暴发性和毁灭性等特点,严重时减产50%以上.
植物病原菌抗药性是植物保护领域内一个难以解决的问题,当病原物群体中存在潜在的抗药基因时,在药剂选择压力下便会出现抗药性.我国对植物病原菌抗药性研究多针对病害抗性的监测与生物学特性[6],到目前为止,先后应用于植物病害的杀菌剂已达数百种之多,用药量持续上升[7-10].目前细菌性条斑病及水稻白叶枯病的防治主要依赖噻枯唑、链霉素、申嗪霉素、噻唑锌等杀菌剂来进行病害防治[11-18].已有研究证明烟草野火病菌、梨火疫病菌等已对链霉素产生了抗性[19-21];2013 年,Zhang等[22]测定了中国江浙地区水稻白叶枯菌对噻唑锌的敏感基线并得到了噻唑锌抗性突变菌株;关于申嗪霉素等农药在稻田中的残留问题也不断被提出[23],使用抗菌素防治病害潜在的安全性问题令人担忧.虽然生物防治不断被提出[24-25],但仍然无法高效控制病害,所以对控病药剂的研究也应该继续深入.目前并无关于水稻条斑病菌对申嗪霉素、噻唑锌的抗药性的研究报道.因此,及时建立水稻细菌性条斑病菌对申嗪霉素、噻唑锌的敏感基线以及开展抗药性风险评价等相关研究,对该杀菌剂的田间科学使用、抗药性监测与治理和延长药剂的使用寿命具有重要指导意义.
1 材料和方法
1.1 材 料
供试药剂:1%申嗪霉素(phenazino-1-carboxylic acid),上海乐农生物制品股份有限公司;20%噻唑锌(zinc thiazole),浙江新农化工股份有限公司.
供试菌株:2008年至2012年,从云贵川3省的条斑病发生地采集样品.采用平板划线分离法,对采来的标本病叶进行病原菌分离、纯化、保存及致病性测定[26-27].选取43株条斑病菌,测定各菌株对申嗪霉素及噻唑锌的敏感性.菌株来源、数量及编号详见表1.

表1 供试菌株及菌株来源Tab.1 The strains tested and source of strains
1.2 方 法
1.2.1 抗菌谱的测定
将在营养肉汤培养基(nutrition agar,简称NA)平板上生长的病原菌用灭菌移菌环移到装有液体NB的三角瓶中,恒温震荡(28℃,170 r·min-1)48 h,得到菌悬液.申嗪霉素设置4个浓度梯度:将原液稀释 10、30、50、100.噻唑锌设置5 个浓度梯度:将原液稀释 100、125、150、175、200 倍.
采用离体平板抑菌圈法[28-30]:在灭菌培养皿中加入浓度为3×108CFU(菌落形成单位,colong-forming unit)的病原菌悬液100 μL后加入培养基.混匀后在无菌条件下用吹风机吹干待用.在每块平板上放置6个牛津杯(直径0.6 cm、高1.0 cm),用移液枪分别向每个牛津杯内加入不同浓度的申嗪霉素或噻唑锌药液100 μL,对照用无菌水100 μL,然后将平板放置在28℃培养箱培养.各浓度设置3个重复.将平板放在恒温箱中28℃培养,每天观察一次,并记载抑菌圈的变化情况.
1.2.2 敏感基线的建立
通过测定不同药剂浓度下的抑菌圈的直径(mm),计算药剂对细菌生长的抑制率,抑制率=(抑菌圈的直径-牛津杯直径)/牛津杯直径.使用DPS数据处理系统[31]计算药剂的有效抑制中浓度(EC50)、毒力回归方程和相关系数(r),比较不同地区的水稻细菌性条斑病菌对申嗪霉素及噻唑锌的敏感性,根据水稻细菌性条斑病菌的敏感性频率分布建立水稻细菌性条斑病菌对申嗪霉素及噻唑锌的敏感基线.将抑制率换算成机率值,将药剂浓度换算成浓度对数,以浓度对数为横坐标,抑制率为纵坐标,用Microsoft Office Excel软件求出回归方程及致死中浓度(EC50).
2 结果和分析
2.1 噻唑锌对水稻条斑病菌的室内抑制率测定分析
云南、贵州、四川水稻条斑病菌对噻唑锌的敏感性测定结果显示:不同菌株对噻唑锌的敏感性存在显著性差异,供试菌株 EC50值范围在 0.439 ~2.549 μg·mL-1,平均值为 1.641 μg·mL-1.来自云南临沧的30-1-3菌株噻唑锌敏感性最低,其EC50值为2.549 μg·mL-1;来自云南瑞丽的菌株20-4-1,噻唑锌敏感性最高,其EC50值为0.439 μg·mL-1;敏感性最高和最低菌株的EC50值相差5.806倍,且均来自于云南省低海拔高纬度的延边地区,说明云南省条斑病菌株对噻唑锌敏感性涵盖范围最广,云南省条斑病菌噻唑锌抗性丰富度最高(表2).
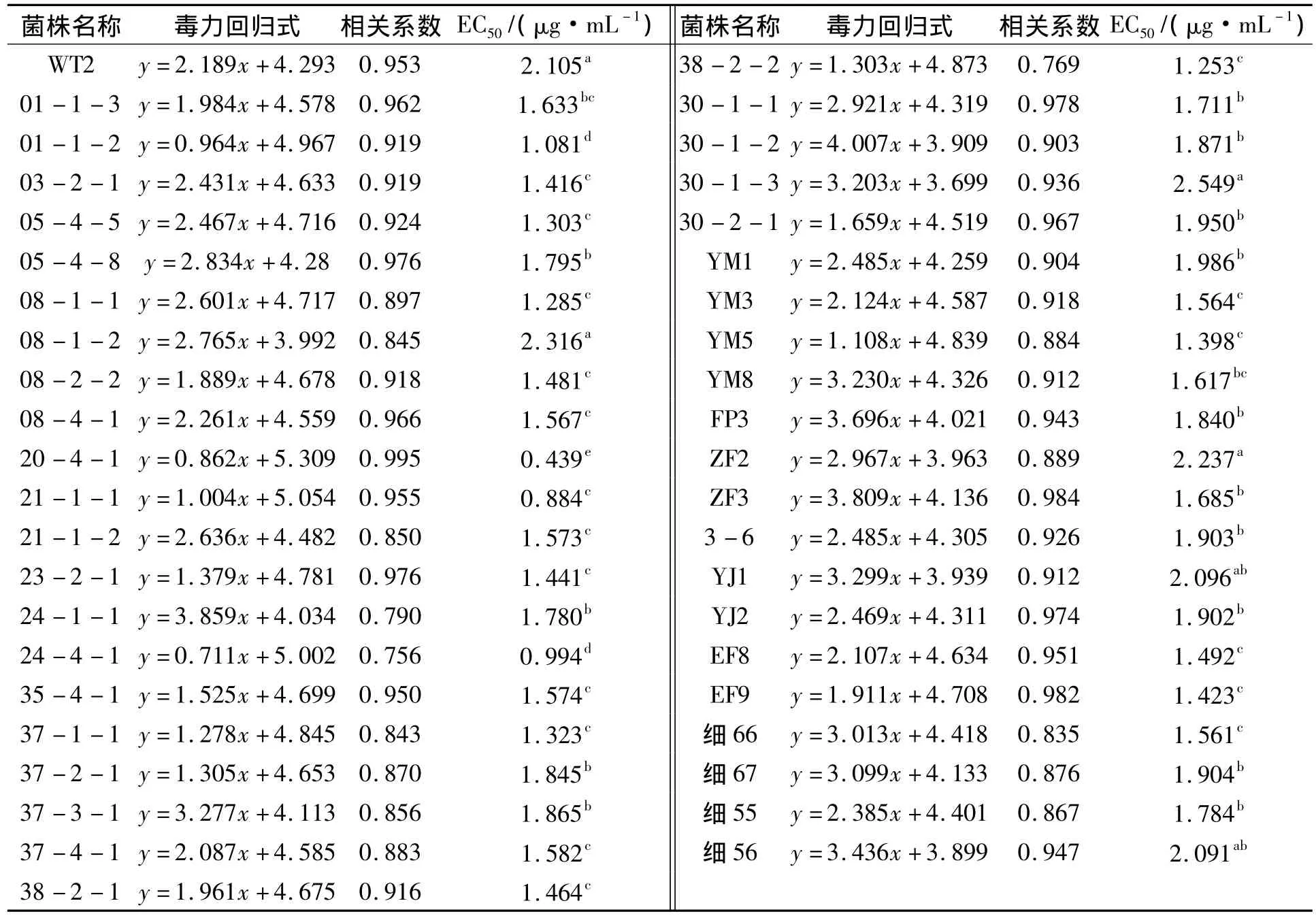
表2 噻唑锌对供试菌株的EC50值Tab.2 The EC50value of the strains to zinc thiazole
不同地区菌株群体对噻唑锌的敏感性测定结果显示:不同地区菌株的EC50差异性显著.其中云南红河的菌株对噻唑锌的敏感性最低,即EC50均值最大,为1.986 μg·mL-1;四川西昌的菌株对噻唑锌的敏感性最高,EC50均值最低,为 1.458 μg·mL-1;云南省菌株 EC50值涵盖范围最广,为 0.439 ~ 2.549 μg·mL-1,其中也包含了噻唑锌敏感性最低和最高的菌株,说明了云南省菌株对噻唑锌抗性的多样性较四川和贵州更丰富;四川西昌的菌株对噻唑锌的敏感性最高,即西昌地区的条斑病菌株对噻唑锌的抗性较低,表明噻唑锌可以继续用于西昌条斑病的防控;同理噻唑锌则不太适合继续用于云南红河州、德宏州、楚雄州等地区条斑病的防控(表3).
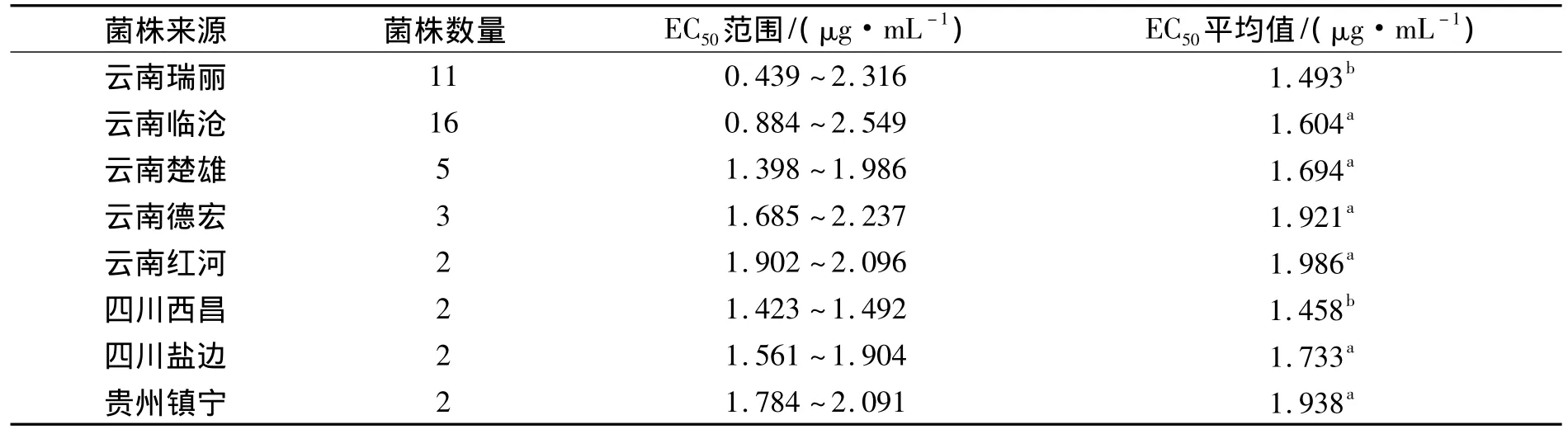
表3 各地区菌株群体对噻唑锌的EC50均值比较Tab.3 The EC50value of the strains from different regions to zinc thiazole
2.2 申嗪霉素对水稻条斑病菌的室内抑制率测定分析
云南、贵州、四川水稻条斑病菌对申嗪霉素的敏感性测定结果显示:不同菌株对申嗪霉素的敏感性存在显著性差异,供试菌株 EC50值范围在 0.035 ~1.598 μg·mL-1,平均值为 0.868 μg·mL-1.来自云南临沧的菌株21-1-1对申嗪霉素敏感性最低,其EC50值为1.598 μg·mL-1;来自四川盐边的菌株细66对申嗪霉素敏感性最高,其EC50值为0.035 μg·mL-1;申嗪霉素敏感性最高和最低菌株的EC50值相差45.657倍;以上结果显示,云南临沧可能已经出现申嗪霉素抗性菌株,也表明申嗪霉素目前仍适用于四川延边条斑病的防控,却不再适用于云南临沧是、瑞丽市、德宏州等地区条斑病的防控(表4).
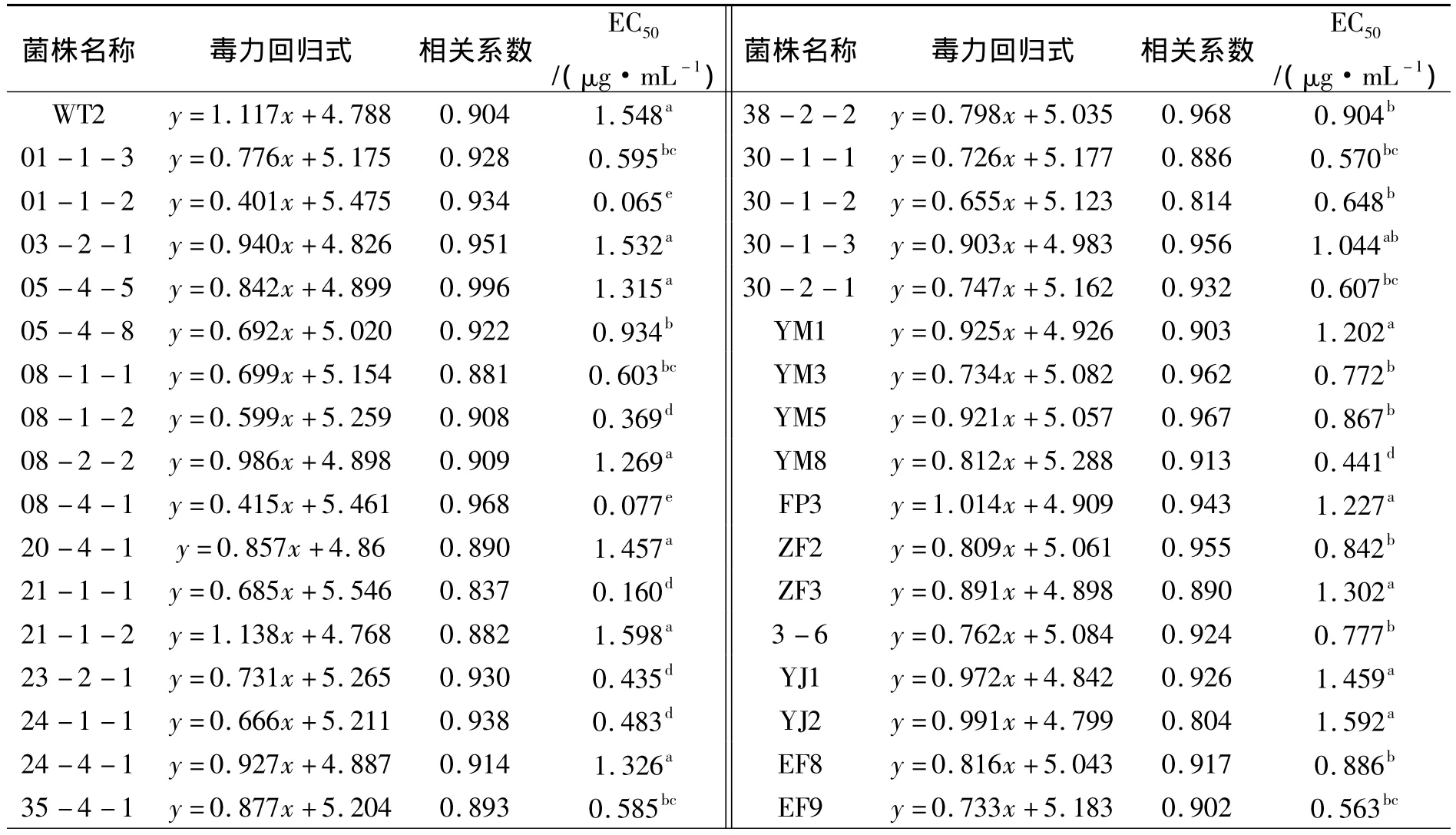
表4 申嗪霉素对供试菌株的EC50值Tab.4 The EC50value of the strains to phenazino-1-carboxylic acid
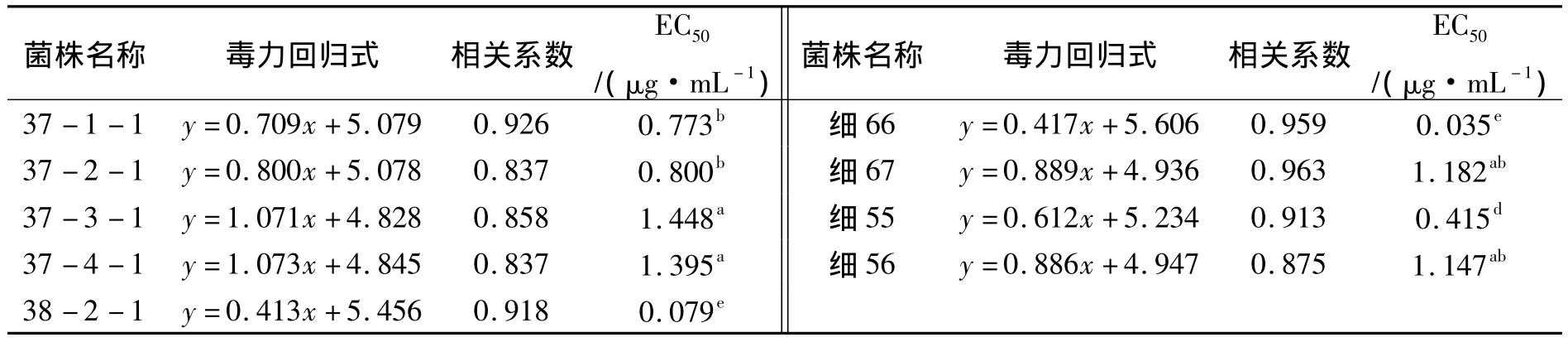
续表4
不同地区菌株群体对申嗪霉素的敏感性测定结果显示:不同地区菌株的EC50差异性显著.其中云南红河的菌株对申嗪霉素敏感性最低,即EC50均值最大,为1.526 μg·mL-1;四川盐边的菌株对申嗪霉素敏感性最高,EC50均值最低,为0.609 μg·mL-1;云南省菌株 EC50值涵盖范围最广,为 0.065 ~1.598 μg·mL-1,其中也包含了对申嗪霉素敏感性最高的菌株和敏感性偏低的菌株,说明了云南省菌株对申嗪霉素抗性的多样性较四川和贵州更丰富;四川盐边的菌株对申嗪霉素的敏感性最高,即盐边地区的条斑病菌株对申嗪霉素的抗性较低,表明申嗪霉素可以继续用于盐边条斑病的防控;同理申嗪霉素则不太适合继续用于云南红河州、德宏州、瑞丽市、临沧市、玉溪市地区条斑病的防控(表5).
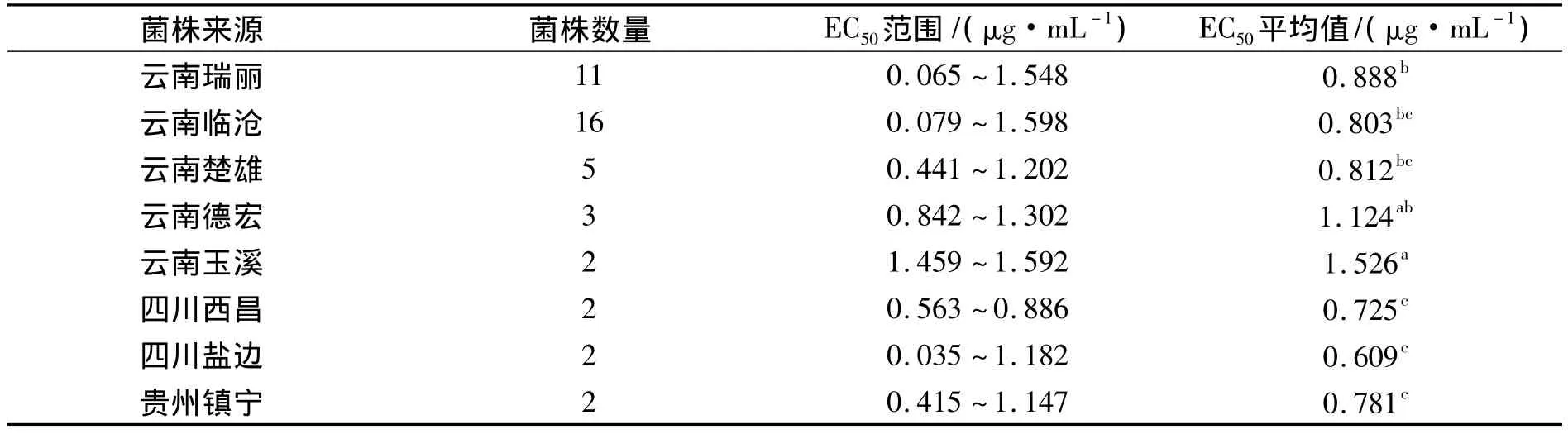
表5 各地区菌株群体对申嗪霉素的EC50均值比较Tab.5 The EC50value of the strains from different regions to phenazino-1-carboxylic acid
2.3 水稻细菌性条斑病菌对噻唑锌及申嗪霉素的敏感基线的建立
作者通过平板抑菌圈法测定了云南、四川、贵州3省43个水稻条斑病菌株对新型农药噻唑锌及申嗪霉素的敏感性.检测结果显示,不同地区的43个菌株对噻唑锌及申嗪霉素的敏感性呈现连续性变化.从频率分布看,呈现近似正态分布.根据野生敏感型病原群体对药剂敏感性为正态分布的原理,确定测得的43个菌株对噻唑锌及申嗪霉素 EC50值的平均值分别是1.641、0.868 μg·mL-1,故该研究将1.641、0.868 μg·mL-1分别作为水稻细菌性条斑病菌对噻唑锌和申嗪霉素的敏感性基线[32].
3 讨论
病原菌对杀菌剂抗药性的发展严重影响药剂的使用效力,对于一种新杀菌剂,了解其抗性风险,可加强对新候选物的研究,从而有利于新化合物合成、新药剂的研究开发、新产品的登记使用、延长药剂使用寿命等.农药的大量使用和抗性菌株的出现,使得农药的抗性监测工作被推上历史进程.该研究通过测定云贵川3省条斑病菌株对新型农药噻唑锌及申嗪霉素的敏感性,建立了西南地区水稻条斑病菌对噻唑锌及申嗪霉素的敏感基线,分别为 1.641、0.868 μg·mL-1.
作者通过离体试验平板抑菌圈法,测定了来自于云南、贵州、四川3省的43个水稻细菌性条斑病菌株对新型农药噻唑锌及申嗪霉素的敏感性.
研究结果显示:供试菌株对噻唑锌的抗药性整体高于申嗪霉素;不同地区水稻条斑病菌株对噻唑锌的敏感性存在显著差异,云南省条斑病菌株对噻唑锌的敏感性涵盖范围最广,说明云南省条斑病菌对噻唑锌的抗性丰富度最高,也表明了云南省条斑病菌的多样性丰富度最高;四川西昌的菌株对噻唑锌敏感性最高,即西昌地区的条斑病菌株对噻唑锌的抗性较低,表明噻唑锌可以继续用于西昌条斑病的防控;同理噻唑锌则不太适合继续用于云南红河州、德宏州、楚雄州等地区条斑病的防控.43株供试菌株对噻唑锌的 EC50平均值为1.641 μg·mL-1,未发现对噻唑锌敏感性显著降低的菌株,所以将1.641 μg·mL-1作为西南地区水稻细菌性条斑病菌对噻唑锌的敏感基线,该基线的建立可作为今后田间抗药性监测的依据[33].
对云南、贵州、四川水稻条斑病菌对申嗪霉素的敏感性的测定结果显示:不同地区的菌株对申嗪霉素的敏感性同样存在显著性差异;云南、四川、贵州三省菌株的申嗪霉素EC50值范围分别为:0.065~1.598、0.035 ~1.182、0.415 ~1.147 μg·mL-1,其中云南省菌株 EC50值范围最广,包含对申嗪霉素抗性最高和偏低的菌株,说明云南省水稻条斑病菌对申嗪霉素抗性丰富度最高.结果显示,申嗪霉素目前仍适用于四川延边条斑病的防控,却不再适用于云南临沧市、瑞丽市、德宏州等地区条斑病的防控.43株供试菌株EC50平均值为0.868 μg·mL-1,对申嗪霉素敏感性最高和最低菌株的EC50值相差45.657倍;未发现对噻唑锌敏感性显著降低的菌株,所以将0.868 μg·mL-1作为西南地区水稻细菌性条斑病菌对噻唑锌的敏感基线,该基线的建立可作为今后田间抗药性监测的依据[34]。
研究植物病原菌对杀菌剂产生抗药性的原因和抗性机制,及时了解田间菌株的抗性情况,对有效防止或延缓对杀菌剂抗药性的产生具有重要意义,此不仅可以加深对杀菌剂抗药性的认识,还为正确提出和制定科学的抗药性治理策略提供理论依据[35-36].农业生产过程中应用药剂的混用和轮换交替可以延缓抗药性的产生.
研究数据显示,对噻唑锌及申嗪霉素两种药剂抗药性最高的菌株,即EC50值最高的菌株均来自云南省临沧市,猜测该市有过度使用噻唑锌及申嗪霉素的可能.供试菌株是否存在多种药剂的交互抗性尚需进一步研究.据报道,目前已发现3种链霉素抗性的机制[37-38].但云南还未发现天然抗链霉素、噻唑锌及申嗪霉素的水稻白叶枯和条斑菌株,也没有关于噻唑锌及申嗪霉素抗性机制及抗性突变菌株的相关报道,条斑病菌对各类农药是否具有交互抗药性也未明确,作者课题组将针对这些问题进行深入研究.
[1]童贤明,徐静.水稻条斑病研究概况[J].植物检疫,1996,10(3):173-177.
[2]Reinking O A.Philippine economic plant disease[J].Philippine Journal of Science,1918,13:165-274.
[3]刘姮,李雪琴.水稻条斑病的研究概述[J].植物检疫,2001,5:51-54.
[4]方中达,任欣正,陈泰苍.水稻白叶枯病及条斑病和李氏禾条斑病病原细菌的比较研究[J].植物病理学报,1957,3(2):99-124.
[5]国家质检总局.中华人民共和围进境植物检疫性有害生物名录[EB/OL].(2007-05-29)[2012-10-12].http://www.1inyi.gov.en/20060404/artieLe/2007-08/36378.htm.
[6]闫秀琴,刘慧平,韩巨才.我国植物病原菌抗药性的研究进展[J].农药学报,2001,40(12):4-6.
[7]张承来,欧晓明.植物病原物对杀菌剂的抗药性机制概述[J].湖南化工,2000,30(5):7-10.
[8]高霞,刘君丽,司乃国,等.稻瘟病菌对烯肟菌胺敏感基线的建立[J].农药,2009,48(11):840-842.
[9]任璐,韩巨才,刘慧平.番茄早疫病菌对异菌脲的敏感基线及其抗性突变体的生物学特性[J].农药学学报,2010,12(2):155-160.
[10]叶滔,马志强,韩秀英,等.禾谷镰孢茵对杀菌剂戊唑醇敏感基线的建立[J].农药,2011,50(11):848-850.
[11]周明国.植物病原菌抗药性[J].农药市场信息,2001(8):23-26.
[12]马忠华,周明国,叶钟音.水稻白叶枯病菌对噻枯唑抗药性的测定方法[J].南京农业大学学报,1996,19(S):147-149.
[13]沈光斌,周明国.水稻白叶枯病菌对噻枯唑的抗药性监测[J].植物保护,2002,28(1):9-11.
[14]刘友勋,成国英,涂立超,等.中南4省水稻细菌性条斑病菌致病型的比较[J].华中农业大学学报,2004,23(5):504-506.
[15]Xie G,Wang H.Comparison of several bactericides against bacterial Leaf streak of rise[J].Zhejiang Agricultural Science,1991(5):233-235.
[16]Zhu M,Ye D,Zhang Z,et al.Test on control effect of new zhimeisu et al.medicament to principle diseases of rice[J].Plant Protection,1992(18):26-27.
[17]温广月,张穗,张红艳,等.新型微生物源农药申嗪霉素对水稻纹枯病菌的毒力测定及田间药效[J].植物保护,2008,34(4):143-145.
[18]魏方林,戴金贵,许丹倩,等.创制农药噻唑锌对水稻细菌性病害的田间药效[J].中国农药,2007(12):810-811.
[19]沈建新,董国堃,张水妹,等.水稻条斑病发生流行与综防技术[J].植物保护,2002,28(1):33-34.
[20]李梅云.烟草野火病病原菌对农用链霉素的抗药性测定[J].中国农学通报,2007,23(12):328-332.
[21]Russo N L,Burr T J.Isolation of streptomycin-resistant isolates of Erwinia amylovora in New York[J].Plant Disease,2008,92(5):714-718.
[22]Zhang C,Wu H,Li X,et al.Baseline sensitivity of natural populations and resistance of mutants of Xanthomonas oryzae pv.oryzae to a novel bactericide,zinc thiazole[J].Plant Pathology,2013,62:1378-1383.
[23]占绣萍,赵莉,樊晓青,等.申嗪霉素在稻田环境中的HPLC残留分析方法研究[J].现代农药,2009(2):39-41.
[24]王星云,宋卡魏,张荣意.枯草芽孢杆菌 B68拮抗物质对香蕉冠腐病菌的抑菌作用及其稳定性测定[J].中国生物防治,2007,23(4):391-393.
[25]Hughes R K,Dickerson A G.The effect of ethylene on phenylalanine ammonialyase(PAL)induction by a fungal elicitor in Phaseolus vulgaris[J].Physiological and Molecular Plant Pathology,1989,34:361-378.
[26]周丽洪,王永吉,韩阳,等.丽格海棠细菌性叶斑病病原菌鉴定[J].西南师范大学学报:自然科学版,2012,37(12):56-61.
[27]Zhou L H,Han Y,Ji G H,et al.First report of bacterial leaf spot disease caused by Pseudomonas syringae pv.syringae on Panax notoginseng[J].Plant Disease,2013,97(5):685.
[28]方中达.植病研究方法[M].北京:中国农业出版社,1998:155-157.
[29]张丽辉,王永吉,廖林,等.生防菌06-4对魔芋软腐病的防治及机理的初步研究[J].湖南农业大学学报:自然科学版,2011,37(3):286-289.
[30]王永吉,张丽辉,魏兰芳,等.生防细菌C3的鉴定及对魔芋软腐病的防效研究[J].西南大学学报:自然科学版,2012,34(2):17-22
[31]唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002:648.
[32]杨丽娜,穗原,陈长卿,等.烟草野火病菌对春雷霉素的敏感性测定及敏感基线建立[J].江苏农业科学,2012,40(5):79-80,86.
[33]陈明丽,纪明山,刘志恒,等.辽宁省稻瘟病菌对烯肟菌酯的敏感性检测[J].农药,2008,47(2):142-144.
[34]张传清,章祖平,孙品雷,等.山核桃干腐病菌对7种杀菌剂的敏感性比较及其对苯醚甲环唑敏感基线的建立[J].农药学学报,2011,13(1):84-86.
[35]张宇君,李俊,赵伟,等.水稻白叶枯病菌对拌种灵抗药性分子机制研究[J].中国农业科学,2005,38(1):64-69.
[36]向平安,周燕,高必达.辣椒疮痴病菌(Xanthomonas vesicatoria)和水稻细菌性条斑病菌(X.oryzae pv.oryzicola)的质粒及其与耐链霉素和耐铜性关系[J].植物病理学报,2003,33(4):330-333.
[37]Glazener J A.Accumation of phenolic compounds in cells and formation of lignin-like polymers in cell walls of young tomato fruits after inoculation with Botrytis cinerea[J].Physiology Plant Pathology,1982,20:11.
[38]Chithrashree,Udayashankar A C,Chandra Nayaka S.Plant growth-promoting rhizobacteria mediate induced systemic resistance in rice against bacterial leaf blight caused by Xanthomonas oryzae pv.oryzae[J].Biological Control,2011,59(2):114-122.
