草本纤维生物提取菌株产果胶酶的组分研究
2014-12-05成莉凤冯湘沅刘正初段盛文郑科郑霞
成莉凤,冯湘沅,刘正初,段盛文,郑科,郑霞
(中国农业科学院麻类研究所,长沙410205)
果胶酶是指能分解果胶质的一类酶的总称。根据底物及作用方式不同,果胶酶主要分为果胶裂解酶 (PG)、果胶解聚酶 (PL)和果胶酯酶 (PE)。不同果胶酶组分的应用侧重的领域不同,果胶裂解酶多用于纺织工业的麻类生物脱胶、棉生物精炼等[1];果胶解聚酶多用于植物病毒的纯化、纸浆漂白、医药原料提取等 ;果胶酯酶多用于食品工业的果汁橙清、咖啡发酵等[4]。
果胶酶作为非纤维素降解的复合酶系关键组分之一,引起了麻类生物脱胶专家的高度关注,但国内外有关草本纤维生物提取清洁生产酶制剂的研究报道很少,只有通过深入研究草本纤维生物提取工艺中非纤维素降解的本质,才能为高效利用草本纤维资源的生物质产业迅速发展提供有效途径[5,6]。中国农科院麻类研究所工程酶项目组用草本纤维原料富集培养筛选到3株具有高效的非纤维素降解功能的菌株P1、P2和P3,本研究拟选取这3个菌株作为研究材料,系统分析其表达的果胶酶组分和测定其酶活力大小,为进一步开发菌株的新用途和探讨草本植物非纤维素生物降解机理提供科学依据。
1 材料与方法
1.1 供试菌种
菌株P1、P2和P3由中国农业科学院麻类研究所工程酶项目组选育并保藏。
1.2 主要试剂和仪器
聚半乳糖醛酸钠 (No.P3850,Sigma)、橘子果胶 (No.P9561,Sigma)。酶标仪 (Thermo,美国)、冷冻离心机 (Sigma,德国)、便携式 pH计 (HANNA,Romania)、电子天平 (METTLER TOLEDO,瑞典)、超声波破碎仪 (Branson,美国)。
1.3 培养基
选择培养基:橘子果胶0.5%,蛋白胨0.5%,牛肉膏0.3%,酵母膏0.2%,NaCl 0.5%,琼脂粉0.2%。
种子培养基:葡萄糖1%,牛肉膏0.5%,蛋白胨0.5%,NaCl 0.5%。配置固体培养基,需要添加2%琼脂粉[7]。
发酵培养基:蛋白胨1.5%,牛肉膏0.3%,酵母膏0.2%,NaCl 0.35%,KH2PO40.1%,MgSO40.05%[8]。
1.4 菌种培养方法
从本项目组保藏的斜面菌苔挑取一环菌种接种至5.0 mL种子培养基,充分混匀,35°C静置培养5.0-6.0 h。稀释后涂布于种子培养基平板,35°C静置培养18-20 h,分离单菌落。挑选典型菌落接种于5.0 mL种子培养基,35°C培养5 h;接种到含100 mL种子培养基的小三角瓶,35°C、180 r/min培养6 h;按2%接种量接种含300 mL发酵培养基的摇瓶,35°C、180 r/min培养18-20 h,即为成熟发酵液。
1.5 粗酶液制备
取成熟的发酵液50 mL,3000 r/min,4°C条件下离心10 min,收集上清液即为胞外酶液。分别用50 mL预冷的生理盐水洗涤菌体两次,并用等量的缓冲溶液重悬菌体,将菌悬液在4°C条件下用超声波破碎仪裂解细胞。收集细胞裂解液,10000 r/min,4°C条件下离心10 min,上清液即为胞内酶液。
超声参数设置:强度30%,超声5 s,间隔5 s,时间分别设为20 min、25 min、30 min、35 min和40 min。以果胶解聚酶作参考,分析酶活变化,确定最佳的菌体超声破壁时间[9]。
1.6 果胶酶活力测定
1.6.1 果胶解聚酶活力测定
用pH 9.0的0.05 mol/L甘氨酸-氢氧化钠缓冲液配置5.0 mg/mL的聚半乳糖醛酸钠溶液。取2.0 mL底物预热至50°C,添加1.0 mL适当稀释的酶液,50°C准确反应10 min,立即加入2.0 mL DNS。沸水浴中显色2.0 min,冰水浴迅速冷却,加ddH2O定容至15 mL。以煮沸灭活的相同酶液,做相同反应为阴性对照,测定样品的OD520[10]。果胶解聚酶活力定义为:底物每分钟释放出相当于1.0 μmol半乳糖醛酸的还原糖所需的酶量为1个酶活力单位,以IU表示。
1.6.2 果胶裂解酶活力测定
用pH 9.0的0.05 mol/L甘氨酸-氢氧化钠缓冲液配置5.0 mg/mL的聚半乳糖醛酸钠溶液。取2.0 mL底物预热到50°C,添加1.0 mL适当稀释倍数的酶液和6.0 μL 1.0 mol/LCaCl2溶液,充分混匀,50°C准确反应10 min,煮沸灭活。用沸水浴充分灭活的酶液,作相同反应处理的溶液为对照,测定OD235。果胶裂解酶定义为:底物每分钟释放出相当于1.0 μmol不饱和半乳糖醛酸酐所需的酶量为1个酶活力单位 (以IU表示),235 nm波长下消光系数为4600/(M·cm)。
1.6.3 果胶酯酶活力测定
用pH 6.0柠檬酸-Na2HPO4缓冲液配置5.0 mg/mL的橘子果胶 (DE≥85%)溶液。取10 mL 0.5%果胶溶液,40°C水浴平衡5.0 min,加入2.0 mL适当稀释的酶液,40°C保温30 min后,煮沸终止反应,用0.02 mol/L NaOH滴定产生的羧基基团。以煮沸灭活的酶液做相同的处理作阴性对照。酶活力单位定义为:底物每分钟释放出1.0 μmol羧酸所需的酶量为一个酶活力单位 (以IU表示)。
1.7 数据分析
每个试验设置3个平行组,采用Excel 2007对试验数据进行图表制作及方差分析。
2 结果与分析
2.1 果胶解聚酶活力比较
对3个菌株进行超声波破壁时间进行选择,结果 (图1)表明:3个菌株测得的胞内果胶裂解酶的相对酶活力均是随超声时间的延长而增大,当超声到一定时间后基本稳定。超声破碎细胞的原理主要与空化效应有关。在一定的时间内,空化作用持续,细胞破碎数目快速增长。当达到一定时间后,大部分细胞已经破碎,再延长超声时间,则相对酶活变化不大。从酶活力回收和能耗考虑,P1、P2和P3菌体的超声时间选择分别设为:35 min、40 min和40 min,其余超声参数相同。
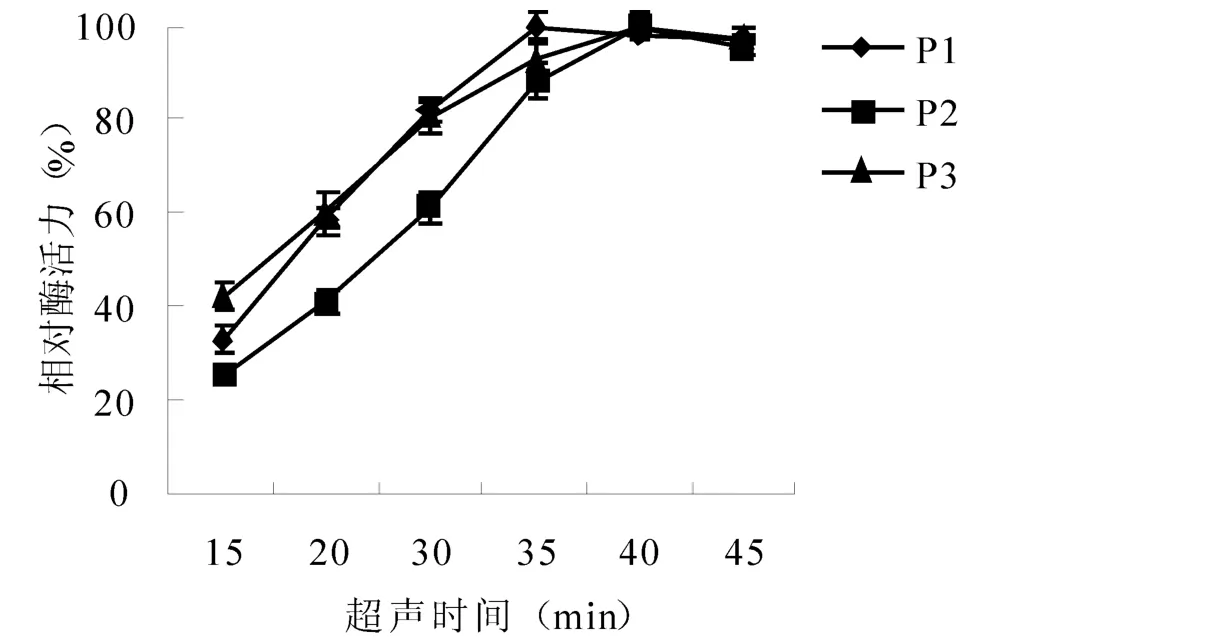
图1 菌体细胞破壁时间与胞内酶活力关系Fig.1 Relationship between ultrasonic cell wall-breaking time and intracellular enzyme activity
通过DNS法测定果胶解聚酶活力,结果 (表1)显示:(1)菌株P1表达的胞外果胶解聚酶活力最高,达71.66 IU/mL,是其胞内酶的7倍;(2)菌株P2表达的果胶解聚酶活力最低,胞内酶和胞外酶活力均不大于10 IU/mL;(3)菌株P3表达的胞内果胶解聚酶活力为39.09 IU/mL,是胞外果胶解聚酶的3倍左右。因此,在测定的3个菌株中,菌株P1表达胞外果胶裂解酶酶活力最高,便于实际生产应用。

表1 不同菌株产生的果胶解聚酶活力Tab.1 Polygalacturonase activities produced from different strains
2.2 果胶裂解酶活力比较
通过C=C光吸收法测定果胶裂解酶活力,结果 (图2)显示:(1)菌株P3表达的果胶裂解酶活力为210.7 IU/mL,并且胞内酶活力远大于胞外酶活力;(2)菌株P2表达的胞内果胶裂解酶活力和胞外酶活力相当;(3)菌株P3表达的胞内果胶解聚酶活力最低,胞外酶活力和胞内酶活力均小于50 IU/mL。因此,在测定的3个菌株中,菌株P3表达果胶裂解酶总酶活力最高,具有明显优势。

图2 不同菌株产生的果胶裂解酶活力Fig.2 Pectin lyase activities produced from different strains
2.3 果胶酯酶活力比较
通过酸碱滴定法测定果胶酯酶活力,结果 (图3)显示:(1)菌株P2表达的胞外果胶酯酶活力为76.7 IU/mL,并且是其胞内酶活力的2倍左右;(2)菌株P1表达的胞外果胶酯酶活力约为20 IU/mL,也是胞内酶活力的2倍;(3)菌株P3表达的胞内果胶解聚酶活力和胞外酶活力均小于10 IU/mL。因此,在测定的3个菌株中,菌株P2表达果胶裂解酶胞内活力和胞外酶活力均为最高。

图3 不同菌株产生的果胶酯酶活力Fig.3 Pectinesterase activities produced from different strains
3 讨论
本文通过DNS法、C=C光吸收法和酸碱滴定法对其发酵生产的果胶酶进行组分分析和酶活力测定,发现3个菌株表达的果胶酶组分多,均包含了果胶解聚酶、果胶裂解酶和果胶酯酶。据国内外的报道,果胶种类繁多,其彻底降解需要果胶裂解酶、果胶水解酶、果胶酯酶等一系列酶的协同作用[11,12]。本研究的出发菌株具有降解草本纤维非纤维素能力可能与其表达的果胶酶组分全面有关,在后续进一步探讨草本植物非纤维素生物降解机理的研究中,果胶酶作为重点课题之一值得关注。
据报道,兰颖辉[13]对黑曲霉产果胶酶不同组分的培养条件进行了优化,其聚半乳糖醛酸酶、果胶裂解酶和果胶酯酶分别提高到523.7 U/mL、8.47 U/mL和76.7 U/mL。在目标菌株P3的培养基添加不同的诱导物,其产生的果胶裂解酶 (210.7 IU/mL)、果胶解聚酶 (39.1 IU/mL)和果胶酯酶 (2.17 IU/mL)也有可能进一步提高。
本文系统比较了同一菌株表达3种果胶酶组分的胞内酶和胞外酶活力,其相对大小各异,没有统一规律。菌株P1的三种果胶酶组分均是胞外酶活力大于胞内酶活力,菌株P2的胞外果胶酯酶大于胞内果胶酯酶,其余两种组分的胞外酶活力与胞外酶活力相当,而菌株P3的果胶裂解酶和果胶解聚酶均是胞内酶活力大于胞外酶活力。从基因的角度分析,到底是胞内表达还是胞外表达可能与编码该酶的基因是否带有信号肽有关[14]。在实际生产应用中,一般会优先考虑胞外酶,因为胞外酶分离纯化成本低、蛋白质容易正确折叠、修饰等,而胞内酶分离还需要微生物细胞破壁破膜,增加工艺的复杂性。有些胞内酶不能正确折叠和修饰,还会形成包涵体,即使纯化出来也不一定能成功复性[15]。从生产应用的角度来看,菌株P1还可以通过合适的培养基诱导,大大提高其分泌的三种果胶酶活力,从而达到生产应用的要求。菌株P3表达的果胶酯酶在降解高度酯化果胶的效果方面值得进一步研究,有望投入到食品加工业[16]。
[1]Yachmenev V G,Bertoniere N R and Blanchard E J.Effect of sonication on cotton preparation with alkaline pectinase[J].Textile Research Journal,2001,71:527 -533.
[2]Murad H A,Azzaz H H.Microbial pectinases and ruminant nutrition [J].Research Journal of Microbiology,2011,6(3):246-269.
[3]王芸,华兆哲,刘立明,等.碱性果胶酶在重组毕赤酵母中高效表达的关键因素研究[J].微生物学通报,2008,35(3):341-345.
[4]Sharma N,Rathore M,Sharma M.Microbial pectinase:sources,characterization and applications[J].Reviews in Environmental Science and Biotechnology,2013,12:45-60.
[5]刘正初.生物制剂在草本纤维质农产品加工业中的应用进展[J].中国农业科技导报,2013,15(5):17-23.
[6]刘正初,张运雄,冯湘沅,等.清洁型草本纤维生物提取工艺的污染机理研究[J].中国农业科学,2008,41(2):546-551.
[7]Liu Z C,Duan S W,Sun Q X,et al.A rapid process of ramie bio-degumming by Pectobacterium sp.CXJZU-120[J].Textile Research Journal,2012,82(15):1 -7.
[8]顾佳佳.欧文氏杆菌变异菌株CXJZ-120果胶酶纯化及其酶学基础研究[D].乌鲁木齐:新疆农业大学硕士学位论文,2007.
[9]孙雷,朱孝霖,李环,等.基因工程菌1020耐热木聚糖酶的纯化.生物技术,2005,15(5):51-53.
[10]成莉凤.DCE-01菌株果胶酶基因克隆与表达及其多样性研究[D].北京:中国农业科学院博士学位论文,2013.
[11]Murad H A,Azzaz H H.Microbial pectinases and ruminant nutrition [J].Research Journal of Microbiology,2011,6(3):246-269.
[12]林影.生物酶在造纸工业绿色制造中的应用[J].生物工程学报,2014,30(1):83-89.
[13]兰颖辉.果胶酶不同组分发酵条件的优化及酶学性质研究[D].天津:天津科技大学硕士学位论文,2006.
[14]宿玲恰.重组Thermobifida fusca角质酶的高效胞外表达及其分子机制[D].无锡:江南大学博士学位论文,2013.
[15]Jayani R S,Saxena S,Gupta R.Microbial pectinolytic enzymes:A review [J].Process Biochemistry,2005,40:2931 -2944.
[16]成莉凤,李琦,刘正初,等.DCE-01菌株果胶酯酶基因克隆与表达 [J].食品工业科技,2013,34(15):162-165.
