姜黄素对鼻咽癌细胞系CNE-1 RECK基因表达及甲基化的影响
2014-12-04王柏琦陈艳华蒋丽琴程爱兰
王柏琦,陈艳华,蒋丽琴,程爱兰
(南华大学 1.附属第二医院 肿瘤内科; 2.医学院 肿瘤研究所, 湖南 衡阳 421001)
研究论文
姜黄素对鼻咽癌细胞系CNE-1RECK基因表达及甲基化的影响
王柏琦1,2,陈艳华1,蒋丽琴1,程爱兰2*
(南华大学 1.附属第二医院 肿瘤内科; 2.医学院 肿瘤研究所, 湖南 衡阳 421001)
目的探讨姜黄素对鼻咽癌细胞RECK基因表达及甲基化的影响,并探讨可能的机制。方法体外培养鼻咽癌细胞系CNE-1,用1、10和30 μmol/L 姜黄素处理后,用Western blot和实时定量PCR分别检测RECK基因以及DNA甲基化酶1(DNMT1)的蛋白和mRNA表达;高效液相色谱-电喷雾质谱检测RECK甲基化,同时用MTT检测CNE-1细胞增殖,EMSA法检测核转录因子Sp1的DNA结合活性。结果CNE-1细胞未刺激时RECK表达水平较低,而经1~30 μmol/L姜黄素处理后,能显著增强RECK蛋白和mRNA的表达(Plt;0.05)。30 μmol/L 姜黄素处理CNE-1细胞后,RECK启动子甲基化水平降低至31% (Plt;0.05),全基因组甲基化水平降低39% (Plt;0.05),细胞系的甲基化活性减少了72% (Plt;0.05)。同时,姜黄素能显著降低CNE-1细胞中DNMT1的蛋白和mRNA表达 (Plt;0.05),也能减低CNE-1细胞的存活率 (Plt;0.05)。EMSA结果显示,姜黄素处理后,CNE-1细胞中Sp1的DNA活性显著降低。结论姜黄素可能通过上调RECK基因表达,降低细胞内甲基化水平,从而抑制CNE-1细胞生长。
鼻咽癌;伴有kazal域的富含半胱氨酸的逆转诱导蛋白(RECK);甲基化;姜黄素
鼻咽癌(nasopharyngeal carcinoma)是我国南方地区最常见的恶性肿瘤之一,其病情隐匿,恶性程度高且较早发生远处转移[1]。鼻咽癌的病因很多,病毒感染、家族史、营养状况、年龄等因素均与本病的发生存在一定关联[2]。近年来,DNA甲基化等表观遗传学的改变在肿瘤中的发病日益受到重视[3]。正常情况下,DNA甲基化是机体内一种基本生理过程,它在DNA甲基转移酶(DNA methyltransferases, DNMTs)的作用下将胞嘧啶转化为5-甲基胞嘧啶(5′-cytosine-guanosine),这在维持染色质结构、DNA构象、稳定性及DNA与蛋白质相互作用方面发挥重要作用[4]。然而在某些病理条件下,DNA异常甲基化可导致多种癌基因的激活和(或)抑癌基因的失活,如伴有kazal域的富含半胱氨酸的逆转诱导蛋白(reversion-inducing-cysteine-rich protein with kazal motifs, RECK)、Ras相关区域家族1A(RASSF1A)等,而这些抑癌基因的失活与鼻咽癌的发生密切相关[5]。
姜黄素是一种二酮类化合物,已有研究显示姜黄素对多种肿瘤细胞具有抑制作用[6]。但姜黄素能否影响鼻咽癌细胞中RECK基因的甲基化,目前仍不清楚。本研究拟从姜黄素入手,观察食源性物质能否影响鼻咽癌CNE-1细胞系中RECK基因的表达和甲基化,以此为肿瘤鼻咽癌的预防提供参考。
1 材料与方法
1.1 材料
姜黄素(纯度98%)、甲醇、乙腈(HPC级别)、甲酸铵、乙酸铵、碳酸氢铵、地西他滨、5-甲基2-脱氧胞苷(5mdC)、2-脱氧鸟苷、核酸磷酸酶、蛇毒液磷酸酶、碱性磷酸酶、碱磷酸去氧核苷酸(2.5 mmol/L)(Sigma公司)。EpiQuik DNMT活性检测试剂盒(Epigentek公司),DNeasy DNA提取试剂盒(Qiagen公司),核蛋白提取试剂盒(Pierce公司)。
1.2 细胞培养与活性鉴定
CNE-1鼻咽癌细胞系(ATCC)用含有10%胎牛血清和1%青霉素、链霉素的RPMI-1640培养基于37 ℃、5% CO2培养箱中培养24 h。MTT法检测细胞的增殖活性。100 μL细胞(约3×103个)接种于96孔板中培养过夜,每组设3复孔。第2天换成含5%胎牛血清和1%青霉素、链霉素的RPMI-1640培养基,并加入不同浓度的姜黄素,继续培养72 h。结束前4 h各孔加入MTT溶液20 μL(5 g/L),随后弃上清,并加入200 μL二甲基亚砜,充分混匀,用酶标仪测定各孔的吸光度值(A570),并计算抑制率。抑制率=(对照组A值-实验室A值)/对照组A值×100%。
1.3 Western blot与甲基化活性分析
细胞处理完毕后,800 r/min离心5 min,弃上清,冰冷的PBS洗涤细胞2次。加入200 μL细胞裂解缓冲液重悬浮细胞(裂解液含蛋白酶抑制剂cocktail Set Ⅲ,1 mmol/L β-甘油磷酸酯、1 mmol/L 钒酸钠、1 mmol/L氟化钠、1 mmol/L 苯甲磺酰基氟化物、20 mmol/L pH 7.0 HEPES、150 mmol/L NaCl、 0.1% NP40),冰上裂解40 min。1 000 r/min离心15 min后,获取上清。经5%~15%聚丙烯酰胺凝胶电泳后, Western blot检测RECK或DNMT1的表达。CNE-1细胞核蛋白中的甲基化活性按EpiQuikTMDNMT试剂盒检测说明书进行。
1.4 DNA提取和水解
获取1×107个姜黄素处理后的CNE-1细胞,按照Qiagen试剂盒操作步骤提取基因组DNA用于全细胞甲基化分析。DNA根据参考文献[7]提供的方法进行,即200 ng基因组DNA于100 ℃、3 min热处理变性,置于冰上冷却后,加入1/10体积的醋酸铵(0.1 mol/L,pH 5.3)和2 U的核酸酶P1,45 ℃孵育2 h后,加入1/10体积的NH4HCO3(1 mol/L)和0.002 U的毒液磷酸二酯酶 Ⅰ,37 ℃孵育1 h。随后加入0.5 U碱性磷酸酶,37 ℃培养1 h。
1.5高效液相色谱-电喷雾质谱(HPLC-ESI-MS/MS)检测DNA甲基化
液相色谱包括HPLC 系统(Agilent公司1100型)、色谱柱(Waters公司Atlantis dC18柱)和预柱(Waters公司)。流动相为0.1%甲酸-甲醇,流速为0.2 mL/min。电喷雾离子模式为正离子,扫描范围为m/z 100~2 000, 离子源温度450 ℃, 喷雾电压为415 kV,破簇电压为55 V,入口电压6 V。碰撞能13 V,气帘气为138 kPa, 气体1为221 kPa, 气体2为379 kPa, 碰撞气体为41 kPa[7]。采用Sciex Analyst software软件(版本1.3.1) 处理数据。
1.6 Real-time RT-PCR分析
采用定量RT-PCR检测RECK和NDMT1的表达。细胞处理完毕,用Trizol试剂提取总RNA,取2 μg RNA用于反转录并进行RT-PCR。反应条件是: 50 ℃ 2 min,95 ℃ 3 min, 然后95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,总共40个循环。反应在ABI prism 7700上进行。所得的数据与内参(18S)之比作为相对值。
1.7 电泳迁移位移实验(EMSA)
根据试剂盒步骤提取核蛋白,核提取物和32P标记的含Sp1基序的寡核苷酸和DNMT1启动子寡核苷酸进行EMSA实验,步骤按照参考文献[8]提供的方法进行。提取的核蛋白加入化学合成的含Sp1结合位点的DNMT1启动子区寡核苷酸探针。互补寡核苷酸、退火,并用Klenow片段标记32P-dCTP。
2 结果
2.1姜黄素增加CNE-1细胞RECKmRNA和蛋白表达
CNE-1细胞在基础状态下RECK蛋白表达水平较低,而经10和30 μmol/L 姜黄素处理后,细胞内RECK蛋白的表达显著增高(图1A)。不同浓度的姜黄素也能增强其mRNA的表达,其趋势与蛋白表达一致(图1B)。

A.RECK protein expression detected by Western blot;B.RECK mRNA expression by real time PCR; 1.control;2.1 μmol/L curcumin;3.10 μmol/L curcumin; 4.30 μmol/L curcumin; *Plt;0.05 compared with control图1 姜黄素对CNE-1细胞RECK mRNA及蛋白表达的影响Fig 1 Effect of curcumin on RECK mRNA and protein expression in CNE-1 cells
2.2姜黄素降低RECK启动子区域以及全基因组以及细胞核DNA甲基化
30 μmol/L 姜黄素处理CNE-1细胞后,与对照组相比,RECK启动子甲基化水平降低了31%,全基因组甲基化水平降低39%,CNE-1细胞核的甲基化活性减少了72%(Plt;0.01)(表1)。

表1 姜黄素对CNE-1细胞RECK基因启动子、全基因以及细胞核蛋白甲基化活性的影响
*Plt;0.05,**Plt;0.01 compared with control.
2.3 姜黄素下调CNE-1细胞DNMT1表达水平
CNE-1细胞DNMT1表达水平较高,而用1、10或30 μmol/L姜黄素处理细胞后,DNMT1蛋白水平显著降低(图2A),其mRNA表达也相应减少(图2B)。
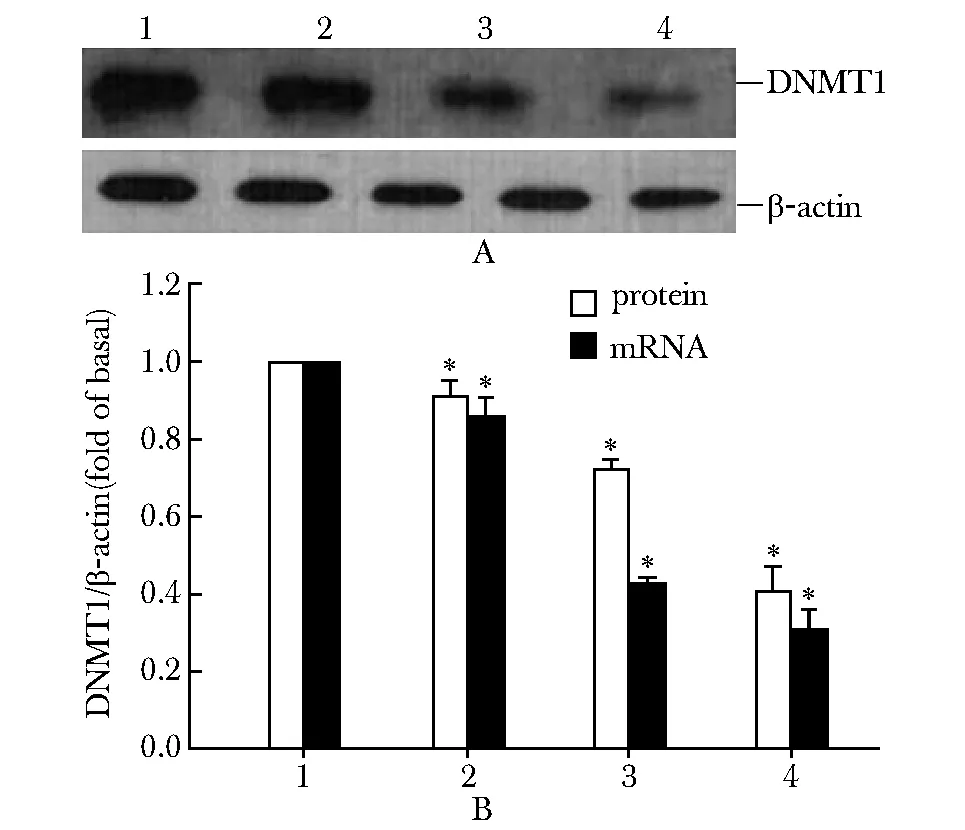
A.DNMT1 protein expression detected by Western blot;B.DNMT1 mRNA expression by real time PCR; 1.control; 2.1 μmol/L curcumin;3.10 μmol/L curcumin; 4.30 μmol/L curcumin; *Plt;0.05 compared with control图2 姜黄素对CNE-1细胞DNMT1 mRNA及蛋白表达的影响Fig 2 Effect of curcumin on DNMT1 mRNA and protein expression in CNE-1 cells
2.4姜黄素对鼻咽癌细胞增殖以及对Sp1转录因子的影响
CNE-1细胞在浓度为10和30 μmol/L姜黄素作用下的存活率分别为44%和23%。此外,姜黄素也能呈剂量依赖性方式降低CNE-1细胞Sp1的DNA结合活性(图3泳道2~4),而加入100倍剂量未标记的Sp1竞争探针(冷探针)后(图3泳道5),对照组的滞后条带减弱,而非特异性竞争探针对滞后条带无明显影响(图3泳道6)。

A.cytotoxicityof curcumin was evaluated using MTT assay;B.DNA-binding activity of Sp1 by EMSA; 1.control;2.1 μmol/L curcumin;3.10 μmol/L curcumin; 4.30 μmol/L curcumin; 5.control nuclear extracts with 32P-labed oligonucleotides and 100× unlabed Sp1 oligonucleotides; 6: control nuclear extracts with 32P-labed oligonucleotides and 100× unlabed NF-κB oligonucleotides; *Plt;0.05 compared with control图3 姜黄素对CNE-1细胞增殖以及Sp1 DNA结合活性的影响Fig 3 The anti-proliferative activity and Sp1 DNA- binding activity of curcumin in CNE-1 cells
3 讨论
RECK基因是一种抑癌基因,广泛存在于机体各种组织细胞中,调控细胞的生长增殖等功能。而在胃癌、胰腺癌、乳腺癌以及食管癌等恶性肿瘤细胞中RECK基因呈低表达,且基因中存在异常的甲基化[9]。本研究证实姜黄素能有效上调鼻咽癌细胞中因甲基化而失活的RECK基因mRNA和蛋白的表达。同时,RECK的激活还与降低其启动子甲基化有关。此外,姜黄素也能抑制CNE-1细胞中DNMT1表达,并能影响Sp1的DNA结合活性,因此姜黄素对DNMT1的抑制可能是通过影响转录因子Sp1而实现的。因此,姜黄素可能通过抑制DNMT1的表达,从而抑制RECK基因DNA甲基化而增强其抑制肿瘤生长功能,最终抑制鼻咽癌生长增殖。姜黄素抑制DNMT1的表达,降低RECK启动子甲基化从而重新激活RECK,这可能是其化学预防鼻咽癌的一种新的分子机制。有研究显示,使用姜黄素处理鼻咽癌细胞,能导致E-钙黏蛋白表达增高以及促进癌细胞凋亡,这与核苷酸DNA甲基化抑制剂相似[10]。此外,一些超甲基化沉默的抑癌基因如GSTP1和MGMT也能被其他外源性药物重新激活[11],这也从侧面证明了姜黄素能诱导DNA去甲基化以及重新激活由此沉默的抑癌基因。
表观遗传学化学疗法是近年逐渐开展的一种新型治疗策略,并已在白血病治疗中取得了一定的效果[12]。目前,DNA去甲基化试剂如地西他滨和氮胞苷已经在临床上用于骨髓增生异常综合征的治疗[13]。但是,要实现这种新疗法的临床应用对包括鼻咽癌在内的实体瘤来说还有待进一步研究,姜黄素作为一种去甲基化药物可能为鼻咽癌提供一种新的预防手段,因为姜黄素不良反应低,可长期使用,来源丰富。细胞周期研究证实姜黄素能将鼻咽癌细胞阻滞于G2/M期,并能显著降低S期细胞比例。此外,对于那些无复制功能的细胞群如干细胞,氮胞苷类药物往往无效。因此与依赖于S期的氮胞苷类药物相比,姜黄素的适用范围更广。
[1] Huang TR, Zhang SW, Chen WQ,etal. Trends in nasopharyngeal carcinoma mortality in China, 1973—2005[J]. Asian Pac J Cancer Prev, 2012,13:2495- 2502.
[2] Han BL, Xu XY, Zhang CZ,etal. Systematic review on Epstein-Barr virus (EBV) DNA in diagnosis of nasopharyngeal carcinoma in Asian populations[J]. Asian Pac J Cancer Prev, 2012,13:2577- 2581.
[3] Hutajulu SH, Indrasari SR, Indrawati LP,etal. Epigenetic markers for early detection of nasopharyngeal carcinoma in a high risk population[J]. Mol Cancer, 2011,10:48.doi:10.1186/1476- 4598- 10- 48.
[4] Fendri A, Khabir A, Hadri-Guiga B,etal. Epigenetic alteration of the Wnt inhibitory factor-1 promoter is common and occurs in advanced stage of Tunisian nasopharyngeal carcinoma[J]. Cancer Invest, 2010,28:896- 903.
[5] Liu S, Ren S, Howell P,etal. Identification of novel epigenetically modified genes in human melanoma via promoter methylation gene profiling[J]. Pigment Cell Melanoma Res, 2008,21:545- 558.
[6] Pan Y, Wang M, Bu X,etal. Curcumin analogue T83 exhibits potent antitumor activity and induces radiosensitivity through inactivation of Jab1 in nasopharyngeal carcinoma[J]. BMC Cancer, 2013,13:323.doi:10.1186/1471- 2407- 13- 323.
[7] Liu Z, Liu S, Xie Z,etal. Characterization ofinvitroandinvivohypomethylating effects of decitabine in acute myeloid leukemia by a rapid, specific and sensitive LC-MS/MS method[J]. Nucleic Acids Res, 2007,35:e31.doi:10.1093/nar/gkl1156.
[8] Liu S, Liu Z, Xie Z,etal. Bortezomib induces DNA hypomethylation and silenced gene transcription by interfering with Sp1/NF-kappaB-dependent DNA methyltransferase activity in acute myeloid leukemia[J]. Blood, 2008,111:2364- 2373.
[9] Noda M, Takahashi C, Matsuzaki T,etal. What we learn from transformation suppressor genes: lessons from RECK[J]. Future Oncol, 2010,6:1105- 1116.
[10] 韦强, 韦敏怡, 梁秀就, 等. 上皮钙黏素/链接素黏附复合体在鼻咽癌组织中的表达及意义[J]. 基础医学与临床, 2007,27:789- 792.
[11] Niture SK, Velu CS, Smith QR,etal. Increased expression of the MGMT repair protein mediated by cysteine prodrugs and chemopreventative natural products in human lymphocytes and tumor cell lines[J]. Carcinogenesis, 2007,28:378- 389.
[12] Thomas X. DNA methyltransferase inhibitors in acute myeloid leukemia: discovery, design and first therapeutic experiences[J]. Expert Opin Drug Discov, 2012,7:1039- 1051.
[13] Si J, Boumber YA, Shu J,etal. Chromatin remodeling is required for gene reactivation after decitabine-mediated DNA hypomethylation[J]. Cancer Res, 2010,70:6968- 6977.
Effect of curcumin on RECK expressionand methylation in nasopharyngeal carcinoma cells CNE-1
WANG Bai-qi1,2, CHEN Yan-hua1, JIANG Li-qin1, CHENG Ai-lan2*
(1.Dept. of Oncology,the Second Affiliated Hospital, University of South China;2.Cancer Research Institute, Medical College, University of South China, Hengyang 421001, China)
ObjectiveTo investigate the effect of curcumin on reversion-inducing-cysteine-rich protein with kazal motifs (RECK) gene expression and methylation, and then to analyze potential mechanism.MethodsNasopharyngeal carcinoma cell line CNE-1 was cultured, and stimulated by 1, 10 and 30 μmol/L curcumin for 48 h, expression of RECK and DNA methyltransferases 1 (DNMT1) gene mRNA and protein were examined by Western blot and real-time PCR respectively.RECKmethylation was determined by HPLC chromatographic and mass spectrometric methods. Cell proliferation was assessed by MTT assay, and the DNA-binding activity of nuclear factor Sp1 was detected by EMSA.ResultsThe expression level of RECK was very low in unstimulated cells, and 1~30 μmol/L could decrease the protein and mRNA level (Plt;0.05). 30 μmol/L of curcumin could decrease the promoter methylation level to 31% of the basal level (Plt;0.05), and the global DNA methylation level and the methylation activity of the nuclear extract were also decreased about 39% (Plt;0.05) and 72% (Plt;0.05),respectively. Western blot showed that curcumin may also decrease the protein and mRNA level of DNMT1 (Plt;0.05) and survival rate (Plt;0.05). In addition, the DNA-binding activity of Sp1 decreased after curcumin treatment.ConclusionsCurcumin may inhibit CNE-1 cells growth by up-regulation ofRECKgene expression and down-regulation of its methylation.
nasopharyngeal carcinoma; reversion-inducing-cysteine-rich protein with kazal motifs (RECK); methylation; curcumin
2013- 10- 21
2013- 12- 24
国家自然科学基金(81372894)
*通信作者(correspondingauthor):ailan_cheng@hotmail.com
1001-6325(2014)06-0729-05
R 739.62
A
