利用流式细胞术检测LPS刺激活化后小鼠腹腔巨噬细胞体积的变化
2014-12-04王文蝶陈朱波姜明红
刘 音,刘 硕,王文蝶,朱 军,陈朱波,姜明红
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 医学分子生物学国家重点实验室, 北京 100005)
研究论文
利用流式细胞术检测LPS刺激活化后小鼠腹腔巨噬细胞体积的变化
刘 音,刘 硕,王文蝶,朱 军,陈朱波,姜明红*
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 医学分子生物学国家重点实验室, 北京 100005)
目的探讨小鼠腹腔巨噬细胞经脂多糖(LPS)刺激活化后体积的变化。方法LPS刺激小鼠腹腔巨噬细胞3和24 h后,用倒置显微镜观察细胞的形态,用ELISA法检测细胞上清中IL-6的含量,用流式细胞术定量检测细胞活化后的体积。结果小鼠腹腔巨噬细胞在正常状态下呈圆型,细胞边缘光滑无伪足,胞质内无空泡。经LPS刺激3 h后,小鼠腹腔巨噬细胞的表面积变大,伸出伪足,伪足的数量和长度随时间延长而逐渐增多和增长,胞质内的空泡也逐渐增加; 24 h后,细胞表面积明显增大,伪足牵拉使细胞形状呈梭型。LPS处理后细胞上清中IL-6的含量较对照组显著增加(Plt;0.01)。流式细胞术检测发现细胞的前向角散射光(FSC)的数值(代表细胞大小)随LPS刺激时间的延长而增加,3和24 h分别增加了11.0%(Plt;0.05)和20.2%(Plt;0.01);侧向角散射光(SSC)的数值(代表表面颗粒数)也逐渐增加,3和24 h分别增加了21.6% (Plt;0.05)和68.0% (Plt;0.01)。结论流式细胞术可以定量检测小鼠腹腔巨噬细胞经LPS活化后的体积变化,为天然免疫细胞的活化研究提供了新的检测手段。
LPS;巨噬细胞;活化;流式细胞术
巨噬细胞是重要的天然免疫细胞,具有吞噬清除异物、加工提呈抗原和合成分泌细胞因子等生物学功能,参与维持机体正常的生理和病理状态[1]。革兰氏阴性菌细胞壁成分脂多糖(lipopolysaccharide,LPS)能够激活巨噬细胞表面Toll样受体(Toll-like recepter 4,TLR4)[2],从而触发一系列下游信号通路,产生炎性因子,发挥生物学效应。以往对巨噬细胞形态学方面的研究主要借助于光学显微镜观察细胞的吞噬功能,而利用流式细胞术和双光子荧光显微镜则能够更准确地观察和评价巨噬细胞的吞噬过程和能力[3]。但是,在巨噬细胞受LPS刺激的活化过程中,巨噬细胞的体积是否发生了变化,这种变化对细胞内免疫信号通路的传递有什么意义,目前鲜有报道。本研究利用流式细胞术检测小鼠腹腔巨噬细胞在LPS刺激后的体积变化,为天然免疫细胞对病原体的防御机制研究提供新的思路和手段。
1 材料与方法
1.1 实验材料
SPF级C57BL/6J近交系雄性小鼠,,8周龄,体质量20~25 g(北京维通利华实验动物技术有限公司,NO.11400500001308),在室温18~22 ℃ 和相对湿度为65%~75%的SPF级屏障系统内饲养,自由摄食和饮水。脂多糖(lipopolysaccharides,LPS;Escherichia coli 0111:B4)(Sigma公司)。ELISA试剂盒(Ramp;D公司)
1.2 实验方法
1.2.1 小鼠腹腔巨噬细胞的分离及培养:常规方法收集小鼠腹腔巨噬细胞[4],以5×105/孔接种于12孔培养板中,用含10%小牛血清的DMEM培养基于37 ℃、5% CO2的培养箱中培养,2 h后换液,弃去未贴壁细胞,贴壁细胞即为小鼠腹腔巨噬细胞。
1.2.2 光镜观察小鼠腹腔巨噬细胞形态变化:小鼠腹腔巨噬细胞接种于12孔板, 24 h后加入100 ng/mL的LPS刺激,3和24 h分别在光镜下观察细胞形态变化。
1.2.3 ELISA方法检测小鼠腹腔巨噬细胞上清中IL-6的含量:经LPS刺激0、3、8和24 h后,收集细胞上清,按照说明书测定IL-6的含量。
1.2.4 流式细胞仪检测小鼠腹腔巨噬细胞体积变化:用LPS分别刺激3和24 h后,收集孔内细胞,PBS调整细胞浓度为1×109/L,使用流式细胞仪检测。在流式细胞仪(BD-AriaII)的散点图上调整圈定巨噬细胞群,比较未处理组(对照组)与LPS刺激不同时间点组(实验组)前向角散射光(forward scatter,FSC)与侧向角散射光(side scatter,SSC)数值的变化。
1.3 统计学分析
所有数据均经过3次以上重复实验,SPSS15.0软件分析数据,组间比较采用单因素方差分析。
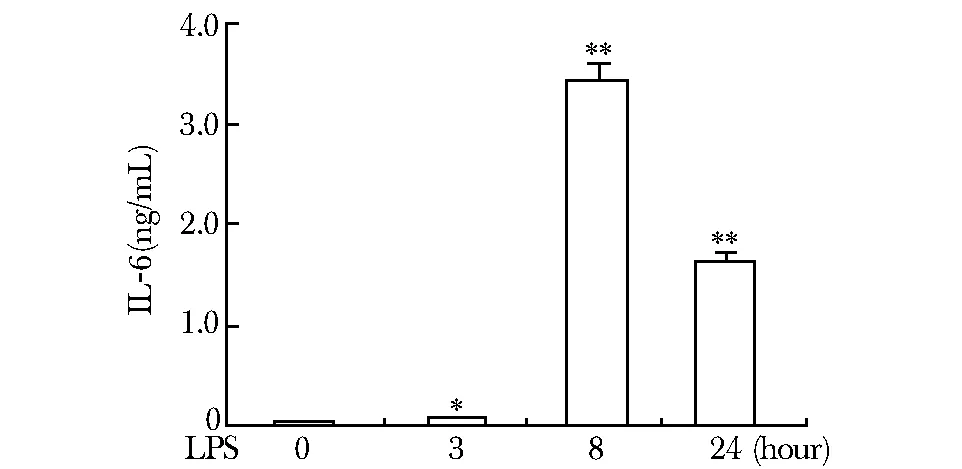
*Plt;0.05, **Plt;0.01 compared with control(0 hour)图1 小鼠腹腔巨噬细胞经LPS刺激后细胞上清中的IL-6含量变化Fig 1 The change of IL-6 level in supernatant of LPS- induced mouse peritoneal macrophages
2 结果
2.1 LPS处理后巨噬细胞分泌IL-6的水平
经LPS处理后,细胞上清中IL-6的含量在3 h有所增加 (Plt;0.05),8 h显著增加(Plt;0.01),24较8 h相对减少,但仍显著高于未刺激组(0 h)(Plt;0.01)(图1)。
2.2 LPS处理后巨噬细胞形态的变化
LPS处理3 h后,光镜下观察到未处理组的细胞大小均匀,呈圆形,中间凹陷,边缘突起,具有明显的立体结构,边缘光滑整齐。处理组3 h后,细胞变大,大小不均一,伸出很多伪足,胞质内出现很多空泡。处理24 h后,细胞表面积变得更大,伪足牵拉细胞使细胞呈梭型,细胞间的伪足相互融合,细胞边界不清晰。细胞扁平,缺乏立体结构(图2)。
2.3 LPS处理后巨噬细胞体积的变化
LPS处理3和24 h,随着刺激时间的延长,FSC值较未处理组显著增加 (Plt;0.01)。SSC值在3和24 h也随着LPS刺激时间的延长(Plt;0.01),细胞表面的颗粒数明显增加,24 h增加最为显著(图3,表1)。

A.control;B.LPS stimulation 3 hours;C.LPS stimulation 24 hours图2 光镜下观察小鼠腹腔巨噬细胞经LPS刺激后不同时间点细胞形态的变化

A.control;B.LPS stimulation 3 hours;C.LPS stimulation 24 hours图3 LPS处理后不同时间点小鼠腹腔巨噬细胞体积及表面颗粒数的变化

LPSstimulation(hours)FSC-ASSC-Adatapercentageincrease(%)datapercentageincrease(%)098276 -71474 -3109117 11.0*86887 21.6*24118135 20.2**120057 68.0**
*Plt;0.05,**Plt;0.01 compared with control (0 hour).
3 讨论
天然免疫系统是机体抵御病原体入侵的第一道防线,天然免疫系统由物理屏障、天然免疫细胞和天然免疫分子组成。巨噬细胞属于天然免疫细胞,具有抗原提呈功能,在天然免疫和适应性免疫中起桥梁作用。巨噬细胞在受到病原体侵袭后,能够通过表面或胞内的模式识别受体(pattern recognition receptor,PRR)识别病原体相关分子模式,从而激活下游信号通路,产生炎性因子等,发挥其抗病原体的能力[4]。以往对巨噬细胞形态学的研究,多采用光学显微镜或是荧光显微镜进行观察,或结合流式细胞术检测其表面分子的变化[5- 6],但对于其受到病原体刺激后的形态学及体积变化尚缺乏详细的报道。长期以来由于技术原因,一直没有比较精确且能大量测定细胞体积的方法。传统的细胞的体积检测方法为同位素掺入和蛋白含量测定等,但这些方法具有同位素污染等弊端,操作非常不便。随着流式细胞仪的普遍应用和检测技术的日臻成熟,本研究试图利用该技术为检测细胞体积变化提供一种快捷、稳定、重复性好和成本低廉的方法。
本研究利用LPS刺激巨噬细胞,发现细胞上清中IL-6水平显著增加,说明LPS激活了巨噬细胞的炎性因子信号通路,提示该细胞处于活化状态。利用光学显微镜发现LPS刺激后小鼠腹腔巨噬细胞的空泡增多,伸出数个伪足,细胞表面积明显增大,具明显的时间依赖性关系,即刺激时间越长,细胞表面积越大,但无法判断细胞体积是否增大。流式细胞术的检测结果证实,细胞经LPS处理后FSC数值增大,与SSC数值呈正相关关系,说明细胞表面颗粒数增多的同时,细胞体积也增大,与LPS的刺激时间成明显的依赖关系,说明利用流式细胞术可以定量地测定细胞活化后的体积变化。而当巨噬细胞的体积在LPS刺激后显著增大后,细胞内多种重要分子的表达水平发生了剧烈地变化,除了为增强天然免疫的信号通路外,可能也是为了维持其在细胞内的分子浓度,以完成正常的细胞生命活动及重要的生化反应。通过测定细胞的体积变化,更有助于理解了天然免疫细胞的分子防御机制。
本研究证明流式细胞术能够检测细胞的体积变化,为判断天然免疫细胞的活化状态提供了一种简单实用的检测方法,也为信号通路的机制研究提供新的辅助手段。同时,细胞体积也有可能成为天然免疫细胞研究的重要参数。
[1] 李丹, 任亚娜,范华骅. 巨噬细胞的分类及其调节性功能的差异 [J]. 生命科学,2011,23:249- 254.
[2] Brown J, Wang H, Hajishengallis GN,etal. TLR-signaling networks: an integration of adaptor molecules, kinases, and cross-talk [J]. J Dent Res,2011,90:417- 427.
[3] 刘光伟,马海霞,吴优,等. 应用双光子显微镜和流式细胞仪定性及定量确定小鼠巨噬细胞的吞噬功能 [J]. 细胞生物学杂志,2007,29:291- 295.
[4] Monroe KM,McWhirter SM,Vance RE. Induction of type I interferons by bacteria [J]. Cell Microbiol,2010,12:881- 890.
[5] Cui S,Wienhoefer N,Bilitewski U. Genistein induces morphology change and G2/M cell cycle arrest by inducing p38 MAPK activation in macrophages [J]. Int Immunopharmacol,2014,18:142- 150.
[6] Maeβ MB,Wittig B,Cignarella A,etal. Reduced PMA enhances the responsiveness of transfected THP-1 macrophages to polarizing stimuli [J]. J Immunol Methods,2014,402:76- 81.
Determination of volume change ofLPS-stimulated mouse peritoneal macrophages by flow cytometry
LIU Yin, LIU Shuo, WANG Wen-die, ZHU Jun, CHEN Zhu-bo, JIANG Ming-hong*
(Dept. of Immunology, National Laboratory of Medical Molecular Biology, Institute of Basic Medical Sciences, CAMS, Beijing 100005, China)
ObjectiveTo determine the volume change of mouse peritoneal macrophages after LPS-stimulation.MethodsAfter stimulation with LPS for 3 and 24 hours, the cell morphological changes were observed under phase-contrast microscope, the content of IL-6 in the cell supernatant was measured with ELISA (enzyme linked immunosorbent assay), and the volume changes were analyzed with flow cytometry, respectively.ResultsIn normal condition, mouse peritoneal macrophages are round with smooth edge and without vacuoles. After stimulated by LPS, the surface area of mouse peritoneal macrophages become larger than before. Pseudopodium and vacuoles can also be seen and as stimulation time extended, their number increased. Especially after 24 hours, mouse peritoneal macrophages turned into fusiform, and their pseudopodia fused with each other. After LPS stimulation, the content of IL-6 in the cell supernatant dramatically increased, illustrating the secretory pathway of inflammatory factor has been activated by LPS and the peritoneal macrophages have been activated. Flow cytometry observed increasing FSC (demonstrating cell
size) by 11.0% (Plt;0.05) after 3 hours and 20.2% (Plt;0.01) after 24 hours, as well as SSC (demonstrating paticles in cell surface) increased by 21.6% (Plt;0.05) after 3 hours and 68.0% (Plt;0.01) after 24 hours.ConclusionsFlow cytometry can determine the volume changes of mouse peritoneal macrophages quantitatively, providing new method for studying the activation and function of innate immunity cells.
LPS;macrophage;activation;flow cytometry
2014- 01- 13
2014- 04- 16
国家(重点)实验室专项经费(2060204)
*通信作者(correspondingauthor):jiangminghong@163.com
1001-6325(2014)06-0767-04
R 392-33
A
