一种基于水解过程的多糖快速鉴别方法
2014-12-03马耀宏孟庆军杨艳杨俊慧史建国张利群郑岚刘伟霞
马耀宏,孟庆军,杨艳,杨俊慧,史建国,张利群,郑岚,刘伟霞
(1.山东省科学院生物研究所,山东省生物传感器重点实验室,山东济南250014;2.山东农业大学,山东泰安271018;3.山东省计算中心,山东济南250014)
糖类是生物体内除蛋白质和核酸以外的又一类重要的物质,蕴涵十分丰富的生物学信息,是细胞识别和信息遗传等重要生物学功能的参与者,近年来已成为生命科学研究的热点[1-2]。
多糖,尤其是水溶性多糖,由于在免疫调节、抗肿瘤、抗病毒、抗氧化和降血糖等方面具有独特的生理活性与功能[3-4],相关研究进展迅速。随着该研究领域仪器分析手段的不断进步,有关多糖结构与功能关系的研究备受关注[5-6]。目前对多糖结构功能研究常用的大型仪器分析技术有气质联用、紫外及红外光谱分析、核磁共振、高效液相、X射线晶体扫描以及原子力显微技术等[7-8]。但是,由于多糖结构特点的复杂性,使得单一仪器分析手段具有一定的局限性。气相色谱法测定糖类所遇到的主要困难是糖类本身没有足够的挥发性,必须将其转化为挥发性衍生物才能进行测定。高效液相色谱法由于使用通用的示差折光检测器灵敏度低而受到限制;若使用紫外或荧光检测器来提高分析灵敏度,糖类化合物须先经过标记衍生,操作繁杂;并且衍生反应的发生总伴随样品的损失,这对目前分析要求的日益提高不利。传统的电泳法及20世纪80年代后期迅速发展起来的高效毛细管电泳法能进行糖的分离检测,但重复性相对较差,该技术的稳定性能达不到实际需求。核磁共振技术解决了糖苷键构型问题,但难以分辨非异头质子的位移,解析方法十分繁杂。通常要弄清楚一个多糖的结构往往需要数种大型仪器与化学分析方法结合,同时花费专业研究人员几个月甚至整年的时间与精力。这些实验方法由于测试周期长,根本无法在生产过程中使用。多糖的快速分析与鉴别是多糖研究领域的热点问题。本文研究了水溶性多糖水解过程中还原糖(还原性末端数)和葡萄糖的水解过程变化规律,通过分析水解过程图谱,实现了对树舌、灵芝和虫草多糖的快速鉴别,目前国内外未见相关研究报道。
1 材料与方法
1.1 材料
1.1.1 仪器
HH-S型恒温水浴锅,上海羌强仪器设备有限公司;JPI-5型架盘天平,苏州博泰伟业电子科技有限公司;YH-1型电子万用炉,金坛市诺艺实验仪器厂;SBA-40D型生物传感分析仪 山东省科学院生物研究所;SGD-IV-D型全自动还原糖测定仪,山东省科学院生物中心;81-2型磁力恒温搅拌器,上海思乐自动化科技有限公司;DS-1型高速组织捣碎机,上海满贤经贸有限公司;20RP-52D型自动高速冷冻离心机,内蒙古农大动物科学与医学学院;A-2电热鼓风干燥箱,福建省泉州宇博电子厂。
1.1.2 试剂
0.15 mol/L盐酸的配制:用移液管取37% 浓盐酸6.25 mL,用蒸馏水定容至1 000 mL。
0.10 mol/L氢氧化钠溶液的配制:称量氢氧化钠4.0 g,加入到盛有适量蒸馏水的烧杯中,用蒸馏水定容至1 000 mL。
1.00 g/L葡萄糖标准溶液的配置:精密称量烘干后的无水葡萄糖1.000 0 g,用蒸馏水定容至1 000 mL。
1.2 方法[9-10]
1.2.1 胞外粗多糖的制备
分别取培养成熟的树舌、灵芝和虫草发酵液,以发酵液中残留还原糖低于0.01%为基准,用5 000 r/min离心机离心15 min,并用0.2 μm过滤器过滤,获得上清液。上清液加入1.5~3倍无水乙醇沉淀多糖30 min。醇沉液体用10 000 r/min,离心15 min,弃上清液。沉淀置于60℃电热鼓风干燥箱中烘干24 h,获得胞外粗多糖样品。
1.2.2 胞内多糖的制备
虫草发酵液经离心后的菌丝体沉淀,用蒸馏水冲洗3~4次,菌丝体中加入适量5% 氯化钠溶液,放入组织捣碎机中,高速捣碎30 min。捣碎的菌丝体液,用超声波进行细胞破碎。破碎菌丝体溶液100℃煮沸2 h。溶液冷却后,用高速离心机10 000 r/min离心10 min,取上清液,加入1.5倍体积的无水乙醇,静置过夜,10 000 r/min离心10 min,取沉淀,于60℃烘箱中烘干,即得虫草胞内粗多糖样品。
1.2.3 多糖的酸水解方法
精密称取0.300 0 g多糖样品,于100 mL小三角瓶中,加入30.0 mL蒸馏水充分溶解,再加入30.0 mL 0.15 mol/L盐酸,混匀,沸水浴5 h。水解前半个小时每隔5 min,以后每隔10 min取0.50 mL的水解液,将水解液迅速冷却并加入0.30 mL浓度为0.10 mol/L的氢氧化钠溶液终止水解反应,后微调水解液pH值至7.0,获得该样品的不同水解时间的水解液测试样品。
1.2.4 水解过程参数的测定方法
还原糖含量使用SGD-IV-D型全自动还原糖测定仪测定,每次取样量0.5 mL;葡萄糖含量采用SBA-40D型葡萄糖酶电极法,每次取样量20 μL。
2 结果与分析
2.1 树舌多糖水解过程图谱
平行测定两次树舌多糖水解过程中葡萄糖、还原糖的含量变化。称取树舌粗多糖0.299 8 g,按1.2.3和1.2.4的测定方法,测定结果见图1;平行测定称取树舌粗多糖0.300 3 g,按同样方法测定,结果见图2。
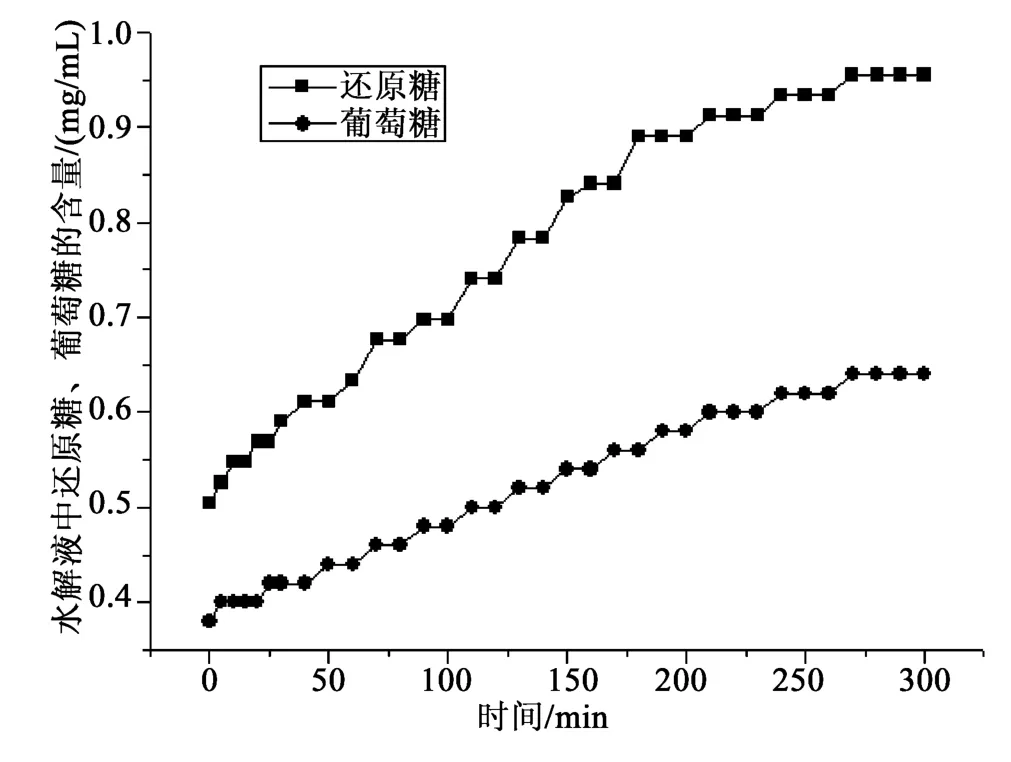
图1 树舌多糖水解过程图谱Fig.1 Hydrolysis process map of Ganoderma applanatum Pat polysaccharides
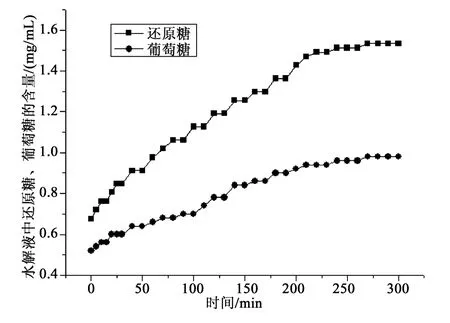
图2 平行测定树舌多糖水解过程图谱Fig.2 Paralleldetermination hydrolysis processmap of Ganoderma applanatum Pat polysaccharides
由图1图谱可知,多糖水解过程中葡萄糖和还原糖含量随时间逐步增加。葡萄糖含量在糖水解过程中占还原性糖的比例由起始时的75%左右逐渐降低至65%左右;由图2图谱可见同样的结果。图1~2显示葡萄糖和还原糖在时间进程上数值稳定,葡萄糖占还原糖比值稳定。由图1和图2比对可以看出,同一种树舌多糖样品水解图谱是稳定的,图形相似。
2.2 灵芝多糖水解过程图谱
平行测定两次灵芝多糖水解过程中葡萄糖、还原糖的含量变化。称取灵芝粗多糖0.300 3 g,按1.2.3和1.2.4的测定方法,结果见图3;平行测定称取灵芝粗多糖0.300 2 g,按同样的测定方法,结果见图4。
由图3可知,灵芝多糖水解过程中葡萄糖和还原糖含量随时间逐步增加。葡萄糖含量在灵芝多糖水解过程中占还原性糖的比例由启始时的70%左右逐渐提高为80%左右;由图4可见同样的结果。图3~4显示葡萄糖和还原糖在时间进程上数值稳定,葡萄糖占还原糖比值稳定。
由图3~4可知,水解5 h后,该灵芝粗多糖水解液中葡萄糖占还原糖的比例分别为80%、78%。图3和图4的比对分析显示,同一种灵芝多糖样品水解图谱是稳定的。
2.3 虫草胞内多糖水解过程图谱
称取虫草胞内粗多糖0.300 3 g,按1.2.3和1.2.4水解过程参数的测定方法,结果见图5,平行测定称取虫草胞内粗多糖0.300 5 g,按同样的方法测定,结果见图6。
由图5~6可知,虫草胞内多糖在该水解条件下水解液中几乎不含葡萄糖,多糖水解过程中还原糖含量随时间逐步增加。图谱1~2显示葡萄糖和还原糖在时间进程上数值稳定,还原糖水解速率几乎相同。还可以看出,同一种虫草胞内多糖样品水解图谱是稳定的。
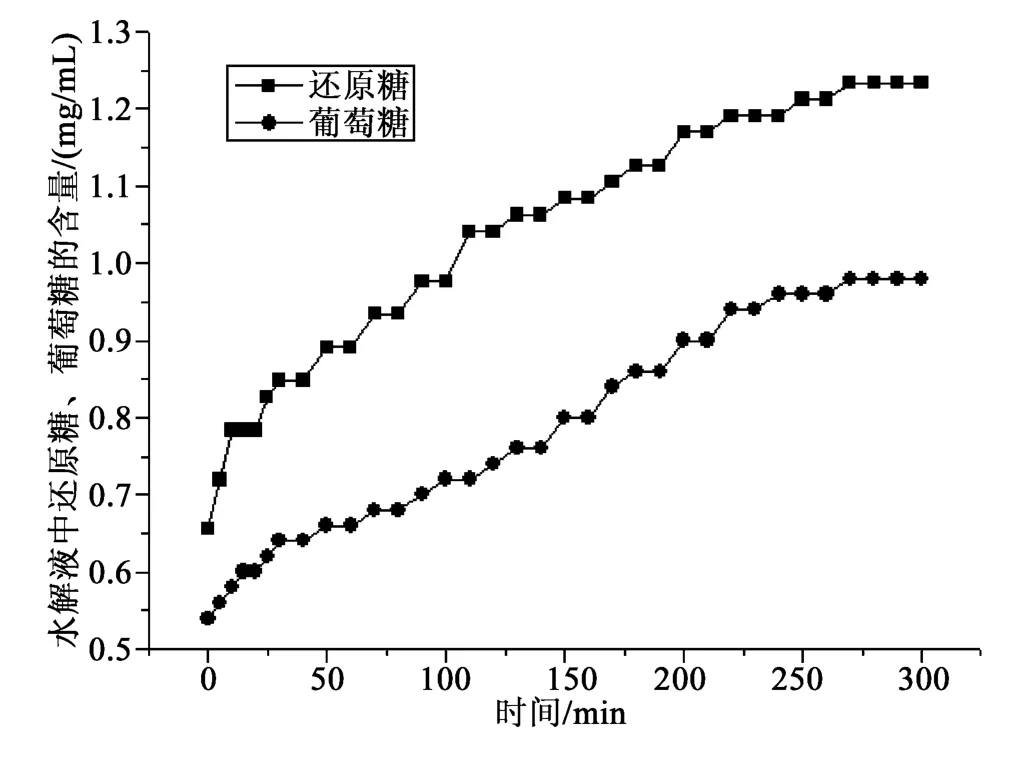
图3 灵芝多糖水解过程图谱Fig.3 Hydrolysis process map ofGanoderma lucidum polysaccharides
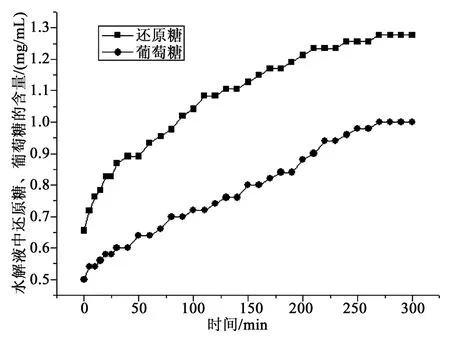
图4 平行测定灵芝多糖水解过程图谱Fig.4 Paralleldetermination hydrolysis processmap of Ganoderma lucidum polysaccharides
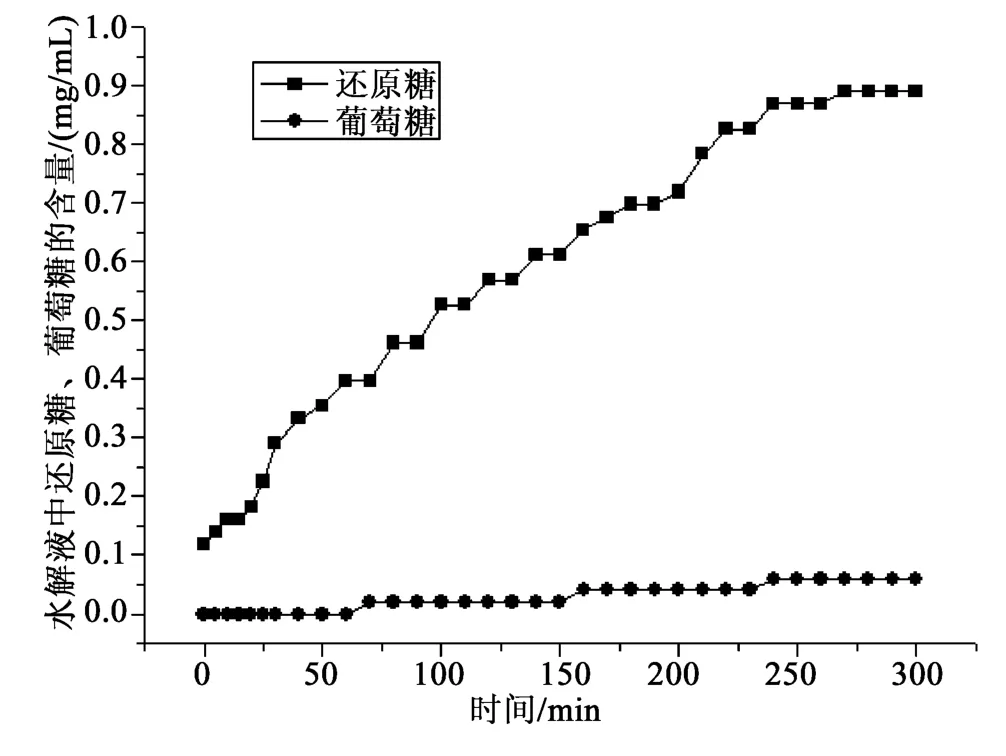
图5 虫草胞内多糖水解过程图谱Fig.5 Hydrolysis process map of Cordyceps polysaccharides
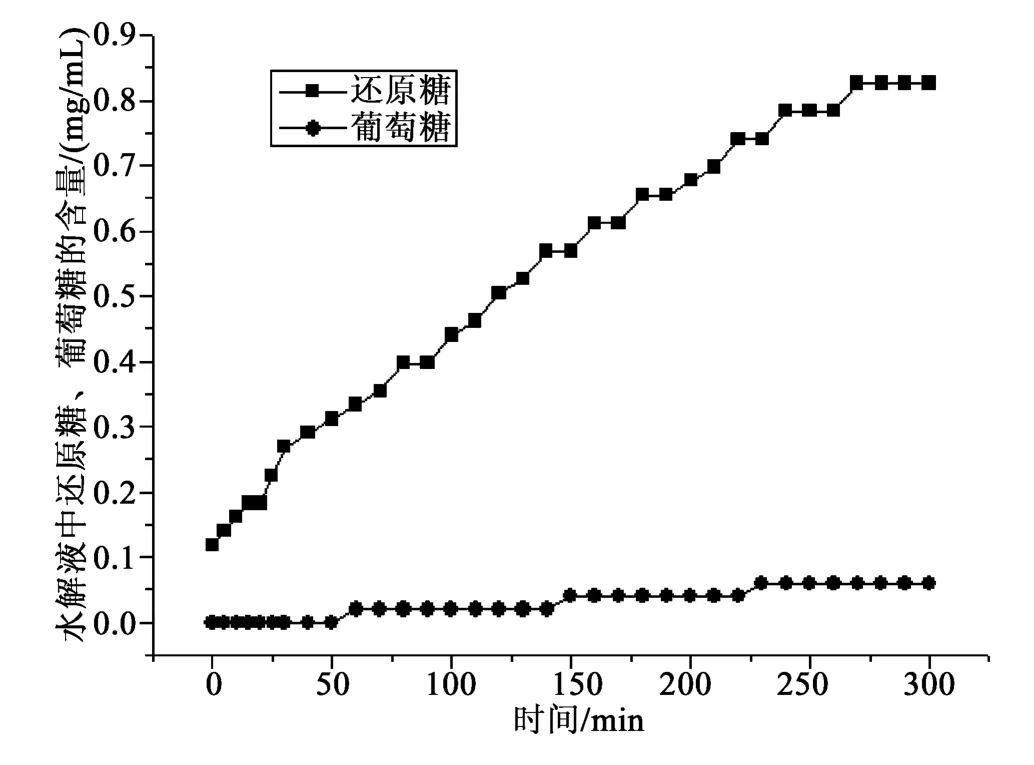
图6 平行测定虫草胞内多糖水解过程图谱Fig.6 Paralleldetermination hydrolysis processmap of Cordyceps polysaccharides
3 结论
(1)在精密控制多糖水解的条件下,同一种树舌、灵芝和虫草胞内多糖的水解图谱是稳定且可以重复的。
(2)通过比较树舌、灵芝和虫草胞内多糖的水解图谱,发现它们之间的区别非常明显。每一种多糖的水解图谱具有各自的特征,同种多糖水解过程参数测定数值稳定,且参数之间对应关系稳定。比对不同多糖水解过程中葡萄糖、还原糖含量的水解图谱,可以实现对不同来源的多糖的快速鉴别分析。
(3)如果建立更多的单糖快速分析传感器,如半乳糖、木糖以及甘露糖等,用来记录标准水解条件的多糖的水解过程,建立多糖水解过程图谱库,开发比对分析软件,就能够根据水解过程图谱来实现对多糖的快速分析,同时获得该多糖的更多信息。如果能够进一步从水解过程中分辨到相对分子量、糖苷键、异构形式和单糖构型等水解信息,就有可能建立基于水解过程的多糖快速分析方法。
[1]RADEMACHER T W,PAREKH R B,DWEK R A.Glycobiology[J].Annual Review of Biochemistry,1988,57:785-838.
[2]PERSIN Z,STANA-KLEINSCHEK K,FOSTER T J,et al.Challenges and opportunities in polysaccharides research and technology:The EPNOE views for the next decade in the areas of materials,food and health care[J].Carbohydrate Polymers,2011,84(1):22 -32.
[3]CHEN R Z,MENG FL,LIU Z Q,et al.Antitumor activities of different fractions of polysaccharide purified from Ornithogalum caudatum Ait[J].Carbohydrate Polymers,2010,80(3):845 - 851.
[4]BELSKA N V,GURIEV A M,DANILETS M G,et al.Water-soluble polysaccharide obtained from Acorus calamus L.classically activates macrophages and stimulates Th1 response[J].International Immunopharmacology,2010,10(8):933 -942.
[5]WU J,DENG X,ZHANG Y,et al.Application of atomic force microscopy in the study of polysaccharide[J].Agricultural Sciences in China,2009,8(12):1458 -1465.
[6]CHEN Y Y,DING Y,WANG W,et al.Determination of polysaccharide in Radix pseudostellariae extract by size-exclusion highperformance liquid chromatography[J].Tsinghua Science & Technology,2007,12(4):389 -393.
[7]谢明勇,聂少平.天然产物活性多糖结构与功能研究进展[J].中国食品学报,2010,10(2):1-10.
[8]刘玉红,王凤山.真菌多糖结构研究进展[J].中国药学杂志,2007,42(8):561-564
[9]郑岚.液体发酵制备真菌多糖及多糖水解特性研究[D].济南:山东轻工业学院,2011:1-95
[10]郑岚,马耀宏,杨俊慧,等.树舌产糖培养基的选择及树舌粗多糖的纯化[J].食品与发酵工业,2011,37(8):112-116.
