肺气肿合并间歇低氧大鼠模型肝脏的氧化应激及炎症损伤*
2014-12-03刘亚萌高梦丽陈宝元
刘亚萌 高梦丽 曹 洁 冯 靖 陈宝元
慢性阻塞性肺疾病(chronic obstructive pulmo⁃nary disease,COPD)和阻塞性睡眠呼吸暂停(obstruc⁃tive sleep apnea,OSA)目前均被认为可能是一种系统性疾病[1-2]。OSA间歇低氧(intermittent hypox⁃emia,IH)模式类似于缺血/再灌注,为OSA引起机体损伤的主要的病生理基础。研究发现IH 4周后,肝脏比心血管系统可能遭受更严重的氧化应激及炎症损伤[3]。氧化应激和炎症反应在COPD的发生、发展及急性加重过程中同样也发挥着重要作用[4]。同时罹患COPD和OSA即Flenley所谓的“呼吸重叠综合征(overlap syndrome,OS)”。目前关于OS的肝脏的氧化应激及炎症损伤临床和实验研究较少,本研究建立肺气肿合并睡眠IH大鼠模型,旨在探讨该模型肝脏的氧化应激及炎症损伤特点。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 60只健康雄性Wistar大鼠,清洁级,6周龄,质量150~180 g,购自中国医学科学院放射医学研究所实验动物中心。用随机数字表法分为4组,分别为正常组(A组)、肺气肿组(B组)、间歇低氧组(C组)及肺气肿合并间歇低氧组(D组),每组15只。
1.1.2 试剂和仪器 (1)大前门烤烟型香烟(焦油含量约23 mg/支,尼古丁含量约1 mg/支)购自天津卷烟厂;混合气体购自天津六方气体公司;HE染色液,超氧化物歧化酶(SOD)、丙二醛(MDA)及过氧化氢酶(CAT)测定试剂盒,ELISA试剂盒均够自南京建成生物科技公司。(2)熏烟箱(容积约72 L)和密封箱均为储物箱和大号密封盒改制;氧浓度检测仪为瑞士夏美顿公司生产;低流量流速表为余姚工业自动化仪表厂生产;氧气减压器购自天津减压器厂;血气分析仪为瑞士罗氏AVL 995;日本Olympus光学显微镜及图像采集系统;北京航空航天大学多功能彩色病理图像分析系统;可见光分光光度计、微量式移液器、组织匀浆器、37℃烤箱和酶标仪均由天津医科大学内分泌研究所提供。
1.2 方法
1.2.1 肺气肿合并睡眠间歇低氧大鼠模型的建立 A组:正常饲养,不予处理。B组:常氧状态,每天熏烟2次,每次30 min。C组:每天于9:00—17:00以5%O2/平衡N230 s和空气90 s交替通气约8 h/d。D组:每天熏烟2次,每次30 min,于9:00—17:00以5%O2/平衡N230 s和空气90 s交替通气约8 h/d。按以上条件连续饲养8周。
1.2.2 标本的留取与处理 试验开始8周后,从各组随机抽取5只大鼠,取股动脉血测定其血气值。将各组剩余的10只大鼠麻醉后在操作台上仰卧位固定,取肺、肝脏组织各1块,置于4%甲醛溶液中固定,24 h内石蜡包埋、切片、HE染色,光镜观察。取一块肝脏组织充分研磨后,严格按SOD、MDA及CAT测定试剂盒的说明操作,测定其浓度。取1块约100 mg肝组织置于液氮中,充分剪碎匀浆后离心收集上清,用ELISA试剂盒测定肝脏白细胞介素(IL)-6及肿瘤坏死因子(TNF)-α水平。
1.2.3 肺组织病理半定量图像分析 肺泡腔及肺泡密度的测量及计算。(1)肺平均内衬间隔(MLI):以视野正中为中心划“十”字交叉线,计数通过该交叉线的肺泡间隔数(Ns),测出十字线的总长度(L),以L/Ns得到MLI,该数值可反映肺泡平均直径(μm)。(2)平均肺泡数(MAN):计数每个视野内的肺泡数(Na),测出每个视野的面积(S)约为1.89 mm2。以Na/S计算各个视野的MAN,其数值可反映肺泡密度[5]。
1.2.4 观察指标及肝脏炎症评分方法 炎细胞浸润程度(未见炎细胞浸润为正常,偶见炎细胞浸润为较轻,少量炎细胞浸润为中度,大量炎细胞浸润为重度)、炎细胞浸润范围(未见炎细胞浸润为正常,每视野炎细胞的浸润在5%以下为较轻、5%~10%为轻度、11%~20%为中度、21%~50%为较重、50%以上为重度)、肝细胞水肿程度(肝细胞未见水肿为正常,肝细胞胞浆疏松为较轻,肝细胞肿胀为中度,肝细胞肿胀破裂为重度)、肝细胞水肿范围及肝细胞点状坏死范围(同炎症细胞浸润范围判断标准)。以上每项均按正常0分,较轻1分,轻度2分,中度3分,较重4分,重度5分,满分为5分。每只大鼠的病理切片随机读取3个视野,每项指标表示为该指标实际得分占所能获得最高预计分数(5分×5项)的百分比[6]。
1.3 统计学方法 采用SPSS 16.0统计软件处理,数据均做正态性检验和方差齐性检验,计量资料以均数±标准差(x±s)表示,多组间均数比较应用单因素方差分析,组间多重比较采用Bonferroni法,相关性分析采用Pearson法,以Plt;0.05为差异有统计学意义。
2 结果
2.1 预实验各组大鼠的血气值 A组大鼠数据基本符合正常生理状态下的血气值;B组p(O2)略有下降,基本符合大鼠肺气肿的状态;C组和D组大鼠p(O2)<60 mmHg(1 mmHg=0.133 kPa),基本符合大鼠间歇低氧的状态,各组大鼠血气值见表1。
Table 1 The blood gas analysis of preliminary experiment in four groups of rats表1 预实验各组大鼠血气值 (n=5,±ss)
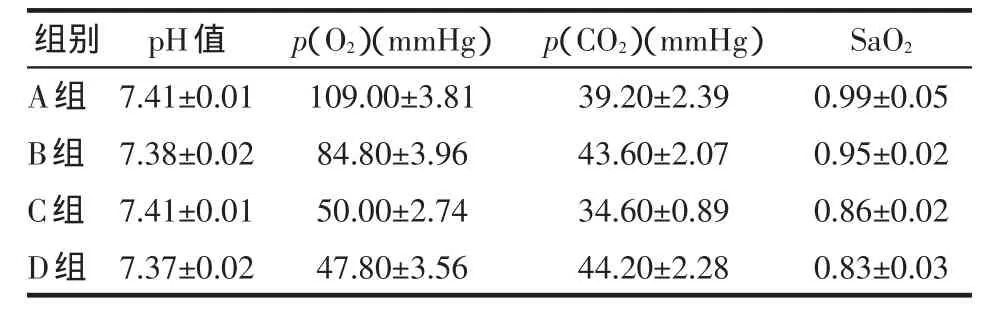
Table 1 The blood gas analysis of preliminary experiment in four groups of rats表1 预实验各组大鼠血气值 (n=5,±ss)
SaO2:动脉血氧饱和度
组别A组B组C组D组pH值7.41±0.01 7.38±0.02 7.41±0.01 7.37±0.02 p(O2)(mmHg)109.00±3.81 84.80±3.96 50.00±2.74 47.80±3.56 p(CO2)(mmHg)39.20±2.39 43.60±2.07 34.60±0.89 44.20±2.28 SaO2 0.99±0.05 0.95±0.02 0.86±0.02 0.83±0.03
2.2 肺泡腔及肺泡密度测量结果 经肺组织半定量分析其各组大鼠的肺泡密度,B、D组符合肺气肿形成标准。B、D组MLI均大于A、C组,B、D组MAN均低于A、C组,见表2。
2.3 肝脏氧化应激及炎症反应的指标比较 B、C和D组大鼠肝脏总SOD及CAT的活力值均低于A组,且D组明显低于B、C组。B、C和D组大鼠肝脏的MDA水平均高于A组,且D组明显高于B、C组。B、C、D组肝脏IL-6、TNF-α的含量及肝脏炎症损伤病理评分均高于A组,且D组肝脏IL-6、TNF-α的含量及肝脏炎症损伤病理评分明显高于B、C组,见表3。
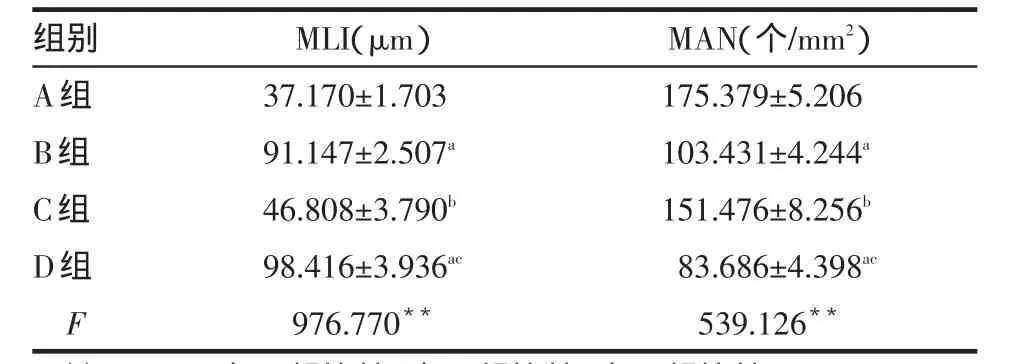
Table 2 Comparison of MLI and MAN values between four groups of rats表2 各组大鼠MLI及MAN结果比较 (n=10,x±s)
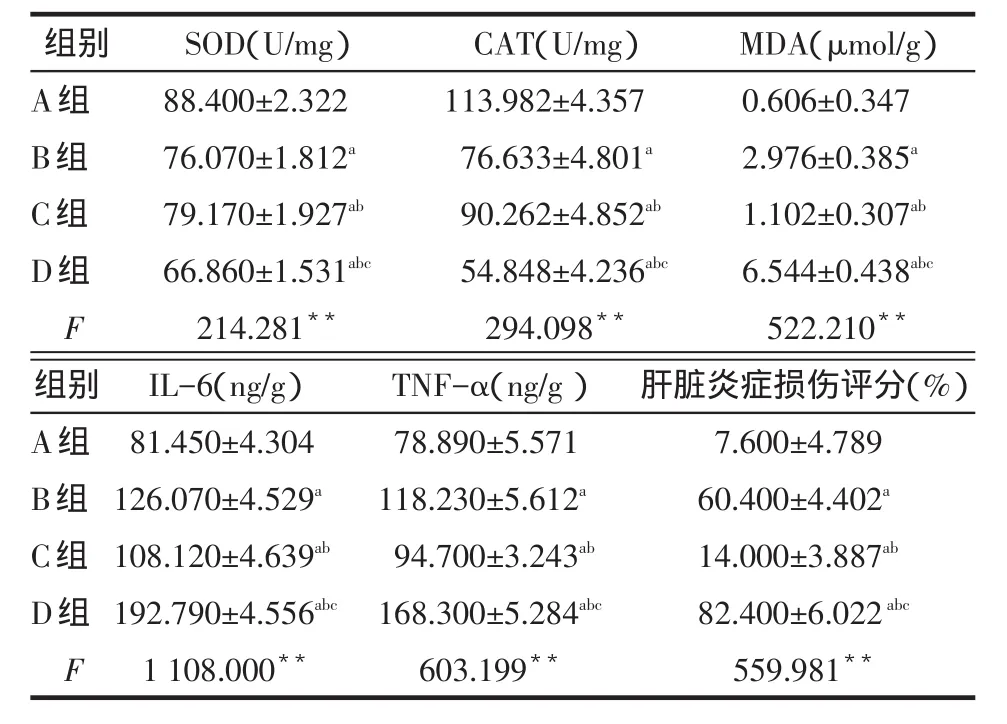
Table 3 Indicators of liver oxidative stress and inflammatory response表3 肝脏氧化应激及炎症反应的指标 (n=10,x±s)
2.4 炎性因子与肝损伤程度的相关性分析 肝脏IL-6、TNF-α的含量与肝脏炎症损伤的评分呈正相关(r分别为0.743、0.929,均P<0.001)
3 讨论
3.1 既往关于单纯COPD及单纯OSA肝脏损伤的研究 COPD的肝脏损伤已经被大家广为认识。COPD被认为既是氧化应激性疾病,又是全身炎症反应性疾病[7]。研究发现,肝炎、肝硬化、脂肪肝、肝癌、酒精肝等肝病的发生、发展与自由基损伤有关,氧化应激可能是肝病的共同发病机制[8]。因此,肝脏作为机体代谢的主要器官,COPD引起的全身氧化应激水平的升高和炎症反应势必会影响肝脏。在一项关于2 284例COPD患者1~3年的调查研究中发现,至少14%COPD患者存在肝功能的异常[9]。近年来,OSA导致肝脏损伤的研究也越来越受到重视。大量的实验和临床研究将OSA和肝损害联系起来。研究发现小鼠暴露于IH环境35 d即可出现肝脏SOD等抗氧化酶活性的降低,导致肝脏的氧化应激损伤[10]。慢性IH可通过氧化应激和激活前炎性转录因子,如核因子(NF)-κB,造成肝脏损伤[11]。
3.2 氧化应激及炎症损伤指标的确立 SOD和CAT均是生物体内重要的抗氧化酶,可以清除生物体内的自由基,对抗和阻断氧自由基对细胞造成的损害。MDA是氧自由基攻击细胞膜脂质过氧化的代谢终产物。SOD、MDA、CAT的高低可以反映机体或组织的氧化应激状态。IL-6及TNF-α为重要的炎症反应前介质。目前认为氧化应激和炎症反应均与COPD及OSA的肺外并发症有关[1,12],因此测定肝脏SOD、MDA、CAT、IL-6及TNF-α的水平可以反映COPD及OSA的肝脏氧化应激及炎症损伤状态。
3.3 研究发现及原因 本研究发现肺气肿组、间歇低氧组和肺气肿合并间歇低氧组肝脏SOD、CAT水平均低于正常对照组,而肝脏MDA、IL-6、TNF-α的水平及肝脏的炎症损伤评分均高于正常对照组。提示IH和肺气肿均可引起肝脏氧化与抗氧化的失衡及炎症反应,与既往的研究结果一致[6,13-14]。但本研究同时发现肺气肿合并间歇低氧组的肝脏SOD、CAT水平明显低于单纯肺气肿和单纯间歇低氧组,肝脏MDA、肝脏IL-6、TNF-α的水平及炎症损伤评分明显高于单纯肺气肿和单纯间歇低氧组,推测IH和肺气肿可以协同降低肝脏的抗氧化能力,打破氧化与抗氧化之间的平衡,加重肝脏的氧化应激程度,同时导致NF-κB激活增加,NF-κB的增加导致IL-6及TNF-α等炎症因子大量释放,炎症因子再激活NF-κB,级联放大加重肝脏的炎症反应,导致细胞和组织损伤加重。低氧可以导致机体或组织的氧化应激及炎症损伤,且低氧的程度和机体或组织的氧化应激及炎症损伤水平呈正相关。研究发现,COPD合并OSA时较单纯OSA或单纯COPD的低氧程度加重[15-16],且OSA间歇低氧模式引起机体氧化应激及炎症损伤主要是在再氧合的过程中[17-18],因此再氧合的过程进一步加重低氧导致的氧化应激及炎症损伤。因此OS低氧和再氧合均可能是COPD和OSA引起肝脏氧化应激和炎症损伤过程中存在协同作用的原因。
[1]Albu A,Fodor D,Poantă L,et al.Markers of systemic involvement in chronic obstructive pulmonary disease[J].Rom J Intern Med,2012,50(2):129-134.
[2]Gonzalez NC,Wood JG.Alveolar hypoxia-induced systemic inflam⁃mation:what low PO(2)does and does not do[J].Adv Exp Med Bi⁃ol,2010,662:27-32.
[3]Jun J,Savransky V,Nanayakkara A,et al.Intermittent hypoxia has organ-specific effects on oxidative stress[J].Am J Physiol Regul In⁃tegr Comp Physiol,2008,295(4):R1274-1281.
[4]Lin JL,Thomas PS.Current perspectives of oxidative stress and its measurement in chronic obstructive pulmonary disease[J].COPD,2010,7(4):291-306.
[5]Mapel DW,Marton JP.Prevalence of renal and hepatobiliary dis⁃ease,laboratory abnormalities,and potentially toxic medication ex⁃posures among persons with COPD[J].Int J Chron Obstruct Pulmon Dis,2013,8:127-134.
[6]Feng J,Chiang AA,Wu Q,et al.Sleep-related hypoxemia aggravates systematic inflammation in emphysematous rats[J].Chin Med J(Engl),2010,123(17):2392-2399.
[7]Biljak VR,Rumora L,Cepelak I,et al.Gamma-glutamyltransferase and C-reactive protein in stable chronic obstructive pulmonary disease[J].Coll Antropol,2013,37(1):221-227.
[8]Muriel P.Role of free radicals in liver diseases[J].Hepatol Int,2009,3(4):526-536.
[9]McKenzie DK,Butler JE,Gandevia SC.Respiratory muscle function and activation in chronic obstructive pulmonary disease[J].J Appl Physiol,2009,107(2):621-629.
[10]Rosa DP,Martinez D,Picada JN,et al.Hepatic oxidative tress in an animal model of sleep apnoea:effects of different duration of expo⁃sure[J].Comp Hepatol,2011,10(1):1.
[11]姜秋芳,陈宝元,董丽霞,等.慢性间歇低氧对大鼠肝脏的损伤及4-羟基-2,2,6,6-四甲基哌啶的干预作用[J].中华结核和呼吸杂志,2012,35(3):189-192.
[12]Lurie A.Inflammation,oxidative stress,and procoagulant and throm⁃botic activity in adults with obstructive sleep apnea[J].Adv Cardiol,2011,46:43-66.
[13]da Rosa DP,Forgiarini LF,Baronio D,et al.Simulating sleep apnea by exposure to intermittent hypoxia induces inflammation in the lung and liver[J].Mediators Inflamm,2012;2012:879419.
[14]Feng J,Wang QS,Chiang A,et al.The effects of sleep hypoxia on coagulant factors and hepatic inflammation in emphysematous rats[J].PLoS One,2010,5(10):e13201.
[15]Lacedonia D,Carpagnano GE,Aliani M,et al.Daytime PaO2 in OSAS,COPD and the combination of the two(overlap syndrome)[J].Respir Med,2013,107(2):310-316.
[16]Lee R,McNicholas WT.Obstructive sleep apnea in chronic obstruc⁃tive pulmonary disease patients[J].Curr Opin Pulm Med,2011,17(2):79-83.
[17]冯靖,陈宝元,郭美南,等.内皮细胞在不同间歇缺氧方式时核因子κB和细胞间黏附分子1的变化[J].中华结核和呼吸杂志,2007,30(3):202-206.
[18]高梦丽,刘春霞,冯靖,等.不同间歇低氧方式对内皮细胞c-fos mRNA表达水平的影响[J].天津医药,2013,41(10):945-948.
