HPLC法同时测定帕罗醇中的4种光学异构体含量
2014-12-03郭文敏郑利刚白晓雪石药集团中奇制药技术石家庄有限公司石家庄050035石家庄职业技术学院石家庄05008
郭文敏,郑利刚,邢 浩,白晓雪[.石药集团中奇制药技术(石家庄)有限公司,石家庄 050035;.石家庄职业技术学院,石家庄 05008]
帕罗醇有2个手性中心,共有4个光学异构体,反式左旋帕罗醇是帕罗西汀合成中的关键手性起始原料;而根据开发立体异构体新药的技术要求[1],需要对手性起始原料的所有光学异构体进行严格控制,以确保终产品药物的安全性、有效性、质量可控性。文献[2]中报道的方法只能检测顺式与反式2对非对映异构体,不能同时检测帕罗醇中可能存在的4个光学异构体(A反式左旋帕罗醇、B反式右旋帕罗醇、C顺式右旋帕罗醇、D顺式左旋帕罗醇),因而有必要首先建立一套适合的分析方法对A的3种光学异构体杂质进行有效控制。为此,本研究建立了同时测定帕罗醇中4种光学异构体的含量方法,报道如下。
1 材料
1.1 仪器
UV-2201紫外-可见分光光度计(日本岛津公司);1200高效液相色谱(HPLC)仪(美国Agilent公司)。
1.2 药品与试剂
帕罗醇4种异构体对照品(包括A、B、C、D,批号分别为:111201、111202、111203、111204,纯度分别为:97.68%、97.19%、98.66%、96.39%)均为石药集团中奇制药技术(石家庄)有限公司拆分、精制、标定;A原料药[石药集团中奇制药技术(石家庄)有限公司自制,批号:120101、120102、120103,含量:99.56%、99.69%、99.91%];正己烷、异丙醇均为色谱纯,其他试剂均为分析纯。
2 方法与结果
2.1 溶液配制
对照品溶液:分别精密称取A、B、C、D 4种异构体对照品各10.0 mg,各置于100 ml量瓶中,用流动相溶解并稀释至刻度,摇匀,即得质量浓度分别为100 μg/ml的对照品溶液;将4种异构体对照品溶液按1∶1∶1∶1混合,即得4种异构体的混合对照溶液。
供试品溶液:分别精密称取3批A原料药各10.0 mg,分别置于100 ml量瓶中,用流动相溶解并稀释至刻度,摇匀,即得供试品溶液。
2.2 测定波长的选择
分别以流动相为溶剂将A、B、C、D 4种异构体对照品配制成一定质量浓度的溶液,在190~400 nm波长内进行扫描。结果表明,各异构体在267 nm波长处均有较强的吸收,故选择其作为检测波长。
2.3 色谱条件
色谱柱为CHIRALPAK®IC-3(250 mm×4.6 mm,5 μm),以硅胶表面共价键合有纤维素-三(3,5-二氯苯基氨基)甲酸酯为填料;流动相为正己烷-异丙醇-二乙胺(65∶35∶0.1),流速为1.0 ml/min;检测波长为267 nm;柱温为25 ℃;进样量为10 μl。
2.4 方法专属性考察
分别精密量取A、B、C、D 4种异构体的对照品溶液及其混合对照溶液各10 μl,进样测定,记录色谱图。结果,A、B、C、D的保留时间分别为6.856、7.635、14.103、28.319 min,理论板数分别为12696、8186、9295、8029,两两间分离度分别为2.1、3.6、5.1,拖尾因子均小于1.15,空白溶剂不干扰测定。色谱图见图1。
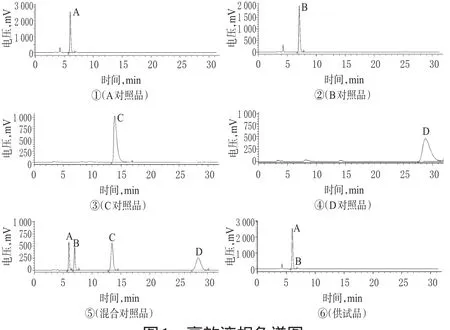
图1 高效液相色谱图Fig 1 HPLC chromatograms
2.5 线性关系试验
分别精密称取4种异构体A、B、C、D对照品各适量,用流动相依次稀释制成含每个手性单体质量浓度约为5.0、10、20、50、80、100、120 μg/ml的溶液,进样测定,以峰面积(A)对质量浓度(c)进行线性回归,得4种异构体的线性方程,见表1,结果表明4种异构体检测质量浓度线性范围均为5~120 μg/ml。
2.6 检测限试验
取上述对照品溶液,逐级稀释至信噪比≥3时,4种异构体的检测限均为10 ng。
2.7 回收率试验
按“2.1”项下方法称取已知4种异构体含量的供试品各9份,分别加入含4种异构体为高、中、低3个质量浓度的对照品溶液各3份,进样测定,计算各个异构体的回收率。4种异构体A、B、C、D的回收率试验结果见表2。
2.8 溶液稳定性试验
分别取各异构体对照品溶液于室温下放置,于0、2、4、6、8 h进样测定。结果各异构体的峰面积在8 h内RSD均小于0.4%(n=5),表明供试品溶液在8 h内稳定。
2.9 重复性试验
称取批号为120101的样品6份,分别配制成供试品溶液,进样测定,结果表明本方法重复性良好,详见表3。
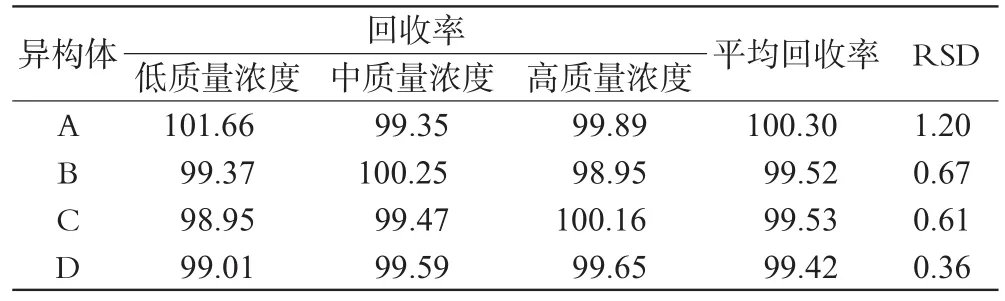
表2 回收率试验结果(%%,n=3)Tab 2Results of recovery test(%%,n=3)
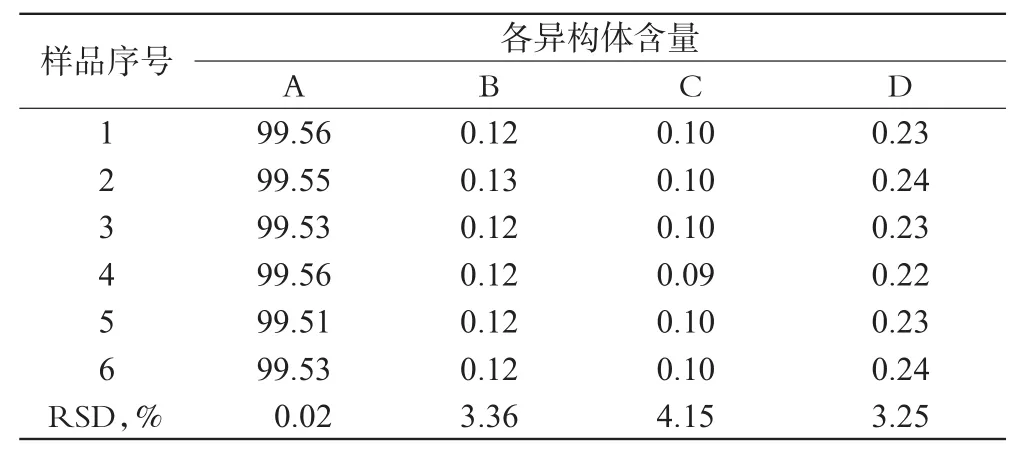
表3 重复性试验结果(%%,n=6)Tab 3Results of repeatability test(%%,n=6)
2.10 样品中异构体含量测定
分别称取3批样品配制成供试品溶液后进样测定,结果见表4,色谱见图1⑥(批号:120103)。
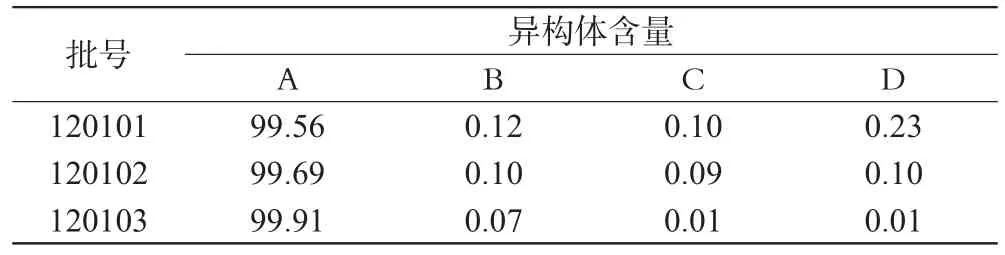
表4 3批样品中异构体含量测定结果(%%)Tab 4 Results of content determination of enantiomers in 3 batches of samples(%%)
3 讨论
3.1 色谱柱的选择
本研究前期试验中分别以蛋白质型、多糖衍生物型、硅胶表面共价键合有纤维素-三(3,5-二氯苯基氨基)甲酸酯等为填料的手性色谱柱进行4种异构体检测方法的摸索。结果表明,以蛋白质型为填料的色谱柱的色谱峰形较差,无法有效分离4种手性异构体;以多糖衍生物型为填料的色谱柱虽然能够分离4种异构体,但要异构体A和B达到分离度大于1.5以上的理想分离,异构体D的保留时间将在90 min以上,且柱效较差,不适合含量测定使用。故本研究最终选择了以硅胶表面共价键合有纤维素-三(3,5-二氯苯基氨基)甲酸酯为填料的色谱柱,结果4种异构体均达到基线分离,分析时间为30 min,4种手性异构体色谱峰的理论板数均在8000以上,适合于快速、准确测定4种异构体含量的要求。
3.2 流动相的选择
以硅胶表面共价键合有纤维素-三(3,5-二氯苯基氨基)甲酸酯为填料的色谱柱,选用正己烷-异丙醇为流动相时,由于帕罗醇为含醇羟基的化合物,故在流动相中加入碱性改性剂二乙胺可以显著地改善色谱峰的保留行为、分离度及柱效。通过对正己烷-异丙醇-二乙胺比例分别为66∶34∶0.1、65∶35∶0.1、64∶36∶0.1的流动相进行筛选,最终选择以正己烷-异丙醇-二乙胺(65∶35∶0.1)为流动相。试验表明此流动相下4种异构体在较短的时间内达到基线分离。
本研究另对流速及柱温进行了考察,结果发现流速的改变对异构体的分离影响不大,为减少分析运行时间,选择流速为1.0 ml/min;柱温由15℃升高到40℃,虽然保留时间由60 min减少到35 min,但异构体A和B的分离度由2.9降低到1.45,综合比较,选择柱温为25℃。
综上,本研究经采用不同手性色谱柱、不同流动相体系、不同流动相调节剂(二乙胺、三氟乙酸、甲酸等)对4种异构体进行色谱条件与系统适用性试验,优化确定了同时测定4种异构体含量的准确、快速的HPLC法条件。本研究成功地实现了对反式左旋帕罗醇光学异构体(A)杂质的有效控制,对提高用其作为原料合成的药品帕罗西汀的安全性、有效性、质量可控性具有促进作用。
[1]黄晓龙.美国FDA关于开发立体异构体新药的政策简介[J].中国新药杂志,2000,9(9):650.
[2]郭文敏,白晓雪,梁亚丽,等.HPLC法同时测定帕罗醇中反式帕罗醇和顺式帕罗醇的含量[J].中国药师,2011,14(11):1570.
