一种慢性植入式微丝电极性能的改进
2014-12-03陈建威王松伟
师 黎 ,陈建威,王松伟
(郑州大学 电 气工程学院,河南 郑 州450001)
0 引言
大脑是生物体内最复杂的系统[1].研究大脑复杂的信息处理机制,往往需要获得足够数目的神经元电活动信息.植入式微电极阵列可以同时获得多个神经元的电活动信息,是大脑相关神经机制研究的重要手段[2].微丝电极阵列是电生理实验中的易耗品.目前高性能的电极阵列主要依赖进口,价格昂贵;而微丝电极阵列是植入式微电极阵列中低端类型的一种,具有成本低,品种多样,适用范围广等优点[3]
前期制备的电极,采用手工排列得到微丝阵列,最后使用手术剪刀进行前端切割.这是一种在国内电生理实验室广泛采用的微丝电极制备方案[4-5].电极植入活体后,随着时间增加,其记录性能会逐渐变差直至失效[6].因此,需要对影响电极记录的因素进行分析,涉及电极周围的组织、电极材料和电极—组织界面三个方面.当电极植入到脑组织中,会引起急性反应[7]和慢性反应.慢性反应会降低电极长期记录性能[8].
2001年P.JRousche等[9]认为电极的尺寸和横截面都会对组织反应产生影响.Jonas Thelin等[10]于2011年的研究表明电极的尺寸将会强烈影响神经系统的组织反应,指出较小的尺寸引起较小的组织反应.2013年Suozhuwo等[11]提出一种简易的电极制备方案,并使用剪刀切割电极尖端.因此,需改进电极的制备工艺,采用微切割工艺提高电极尖端表面的光滑度.对于电极—组织界面的研究已久,1968年David就提出了电极—组织界面的等效模型,指出电极—组织界面影响电极的记录性能[12].2010 年 SCOTT FRANCIS LEMPKA指出记录电极的长期性能依赖于电极—组织界面的组分,并建立了更完善的电极—组织界面模型[13].2012年Abhishek等通过非生物的和生物的指标分析了电极失效的原因,指出电极—组织界面是影响电极长期记录性能的重要因素[14].以上研究均忽略了对电极尖端进行表面修饰.
利用微加工模具进行电极制备工艺的改进;采用微切割工艺进行电极尖端切割;采用导电聚合物对切割后的电极尖端进行表面修饰.建立尖端修饰后电极—导电聚合物—电解液的阻抗模型,并对电极的属性、信号采集能力和生物相容性进行系统地评价.
1 实验设计
1.1 电极制备
微丝电极原制备工艺:①对实验台和所用器械消毒;②剪丝;③取电路板,固定,涂胶;④排丝,穿孔,焊接;⑤反面,重复③和④;⑥焊接后端接口;⑦采用手术剪刀将电极裁剪.
改进后电极的制备工艺:①将实验台和所用器械消毒;②微组装;③微焊接;④反面,重复②;⑤微切割.电极材料为镍镉合金丝.如图1所示为16个记录通道电极阵列.

图1 电极图Fig.1 The electrode pattern
电极尖端的阻抗和形态直接影响电极的性能.由于电极丝的直径为39μm,因此,需在扫描电子显微镜(Scanning Electron Microscopes,SEM)下对电极尖端进行观测.图2为电极尖端在SEM下的照片.
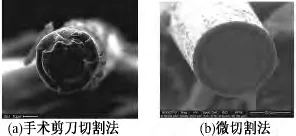
图2 电极尖端照片Fig.2 The electrode tip photos
从图2可以看出,剪刀剪切的时候会出现粘连现象.而微切割截面平滑整齐且电极尖端周围绝缘层形态完好.微切割能够更好地提高电极的电化学性能;更好地提高电极的生物相容性.
1.2 电极尖端修饰与阻抗模型的建立
导电聚合物(Conductive Polymer,CP)聚吡咯具有导电性能和生物相容性良好等优点,采用NeuroNexus的niPOD对电极尖端进行修饰,使其尖端附着聚吡咯,进而改进电极的性能.当金属置于电解液中后,金属和电解液的界面就会发生化学反应,并在该界面形成双电层的电荷分布.镀膜修饰后,电极尖端被聚吡咯包裹,呈现疏松多孔结构.建立修饰电极—导电聚合物—电解液阻抗模型[15]如图3 所示.
该电路元件有:容液电阻Rs;镀层电容CC;孔电阻RPore;双电层界面电容ZCPE;电荷转移电阻Rt和有限扩散阻抗ZT(包括CT和RT).
由图3可得电极—导电聚合物—电解液的阻抗用公式表示为
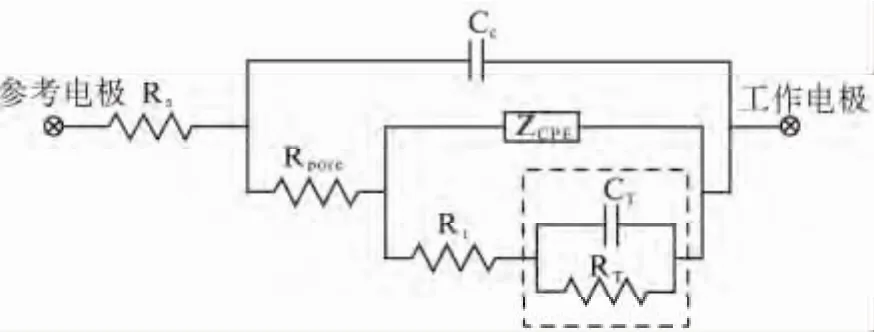
图3 电极—导电聚合物—电解液界面的等效电路模型Fig.3 The equivalent circuitmodel of electrode-CP-electrolyte interface

式中:ρ是溶液的电阻率(生理盐水的电阻率为72 Ω·cm);r是半径.

式中:ε0是真空中电介质的介电常数(也叫做电容率,8.854 19 ×10-12F/m);εr是两个极板间介质的相对介电常数;d是它们之间的距离.
界面电容:界面电容由双电层电容和扩散电容串联组成[15].用公式表示如下

式中:dOHP是双电层的厚度;ε0是真空的介电常数;εr是双电层的介电常数;z是溶液中离子携带的电荷;V0外加电极的电位;Vt是热电压.LD由下面的公式给出
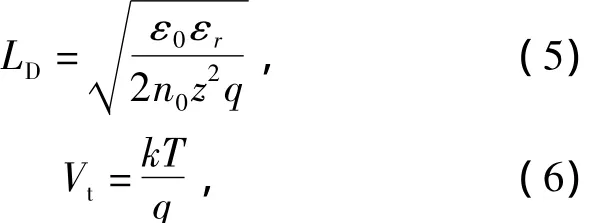
式中:n0是溶液中离子的体积浓度;q是基本电荷;k是Boltzmann常数.
电荷转移电阻:电荷转移电阻Rt可以计算为

这些电流的大小被称为平衡交换电流密度J0(单位为A/cm2)和热电压Vt=kT/q=0.025 9 V.
循环伏安法被用来测定J0.假设电荷转移来自H2O的电解和O2的还原根据2H2O↔O2+4H++4e-,z的值设为4, (8)

有限扩散元件ZT可以用扩散时间常数τT(τT=RTCT),扩散的虚拟电容CT和扩散电阻RT来描述[15],
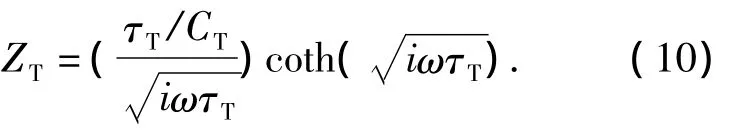
对未修饰电极和修饰电极进行多次体外电化学阻抗谱测量,并计算理论上的阻抗谱.得到图4中等效模型的电化学阻抗谱与测量的阻抗谱如图4所示.图4(a)灰色区域表示测量的阻抗谱的范围,黑线是理论计算的阻抗谱;(b)灰色区域表示测量的相位谱的范围,黑线是理论计算的相位谱,由图4可知,电极—导电聚合物—电解液的等效电路模型对于评价电极的电化学性能是有意义的.

图4 电化学阻抗谱Fig.4 Electrochem istry impedance spectrum
未修饰电极和修饰电极的材料、制备工艺和切割方法相同.随机选取修饰电极和未修饰电极各5个,阻抗测试实验在标准生理盐水中进行,未修饰电极和修饰电极在1 kHz下阻抗值如表1所示.
修饰后阻抗降低率平均为56.1%.未修饰电极和修饰电极的电化学阻抗谱如图5所示.

表1 未修饰电极和修饰电极在1 kHz下的阻抗Tab.1 The im pedance value of unmodified electrode and modified electrode at 1 kHz MΩ
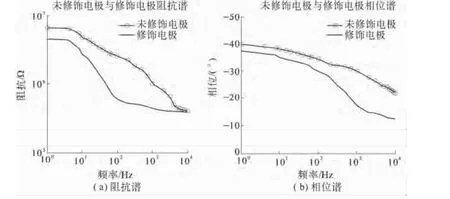
图5 未修饰电极和修饰电极的电化学阻抗谱Fig.5 Electrochem ical im pedance spectrum of unm odified electrode and modified electrode
从图5可以看出,随着频率的增加,电极的阻抗逐渐减小,电极呈现高通特性.在整个频域(100~104Hz)修饰电极的阻抗都比未修饰电极的阻抗低,相位延迟小,有利于电极有效地工作.
1.3 慢性植入手术
选取体重为200~300 g的LE(Long Evans)大鼠作为实验对象.将未修饰电极和修饰电极总共10个电极分别植入到10只大鼠初级视觉皮层.大鼠性别相同、状态相近.
2 实验结果
2.1 信号采集与分析
采用信噪比和记录寿命2个指标评价电极的信号采集能力.植入手术结束后,待大鼠身体状态恢复(约1周)以后,定期采集信号.
信噪比指出了电极从随机的背景噪声中辨别实际神经元动作电位的可用的动态范围,信噪比计算为动作电位的峰峰值除以噪声基底值均方根[16].未修饰电极和修饰电极信噪比如图 6所示.
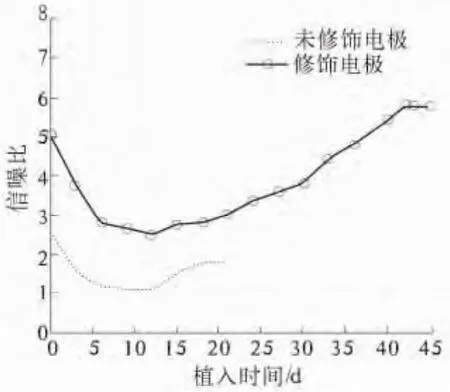
图6 未修饰电极与修饰电极信噪比随时间变化图Fig.6 The SNR of unmodified electrode and modified electrode during duration
从图6可以看出,随着植入时间的增加,信噪比的变化趋势是先下降然后再上升,最后基本保持不变,并且,修饰电极信号的信噪比要比未修饰电极信号的信噪比高,说明修饰电极的信号采集能力要优于未修饰电极的信号采集能力.
电极的记录寿命是指电极能够记录到大量动作电位的持续天数[17].未修饰电极的记录寿命较短,平均为17 d,修饰电极记录寿命较长,最长为45 d,平均为40 d,修饰电极的平均记录寿命比未修饰电极的平均记录寿命约提高了1.4倍.
2.2 生物相容性分析
神经胶质纤维酸性蛋白(Glial Fibrillary Acidic Protein,GFAP)是星形胶质细胞活化的标记物.当电极植入脑区后,会引起星形胶质细胞的增殖和聚集[18].对修饰电极大鼠和未修饰电极大鼠脑组织分别做GFAP标记.在荧光显微镜下观察,如图7所示.
从图7可以看出,未修饰电极测点周围星形胶质细胞聚集程度高于修饰电极测点星形胶质细胞聚集程度.说明未修饰电极对组织的伤害大于修饰电极对组织的伤害.表明修饰电极生物相容性优于未修饰电极的生物相容性.
3 讨论
从电极制备和电极尖端表面修饰两个方面对现有制备工艺进行改进,并对其属性、信号采集能力和生物相容性进行系统地评价.结果表明,电极尖端表面光滑度提高;尖端修饰电极的阻抗平均降低56.1%,提高了记录信号的信噪比;验证了修饰电极的阻抗模型的有效性,说明修饰电极具有良好的电化学性能;修饰电极记录寿命达到45 d,比未修饰电极约提高1.4倍;修饰电极植入脑区后,组织反应更小,说明它的生物相容性更好,能够满足一般电生理实验的要求.进一步优化电极设计、提高电极植入水平,进而改进电极的性能,提高电极的记录寿命是下一步的研究方向.
[1] 梁培基,陈爱华.神经元活动的多电极同步记录及神经信息处理[M].北京:北京工业大学出版社,2003,1-3.
[2] 封洲燕,王静.微电极阵列大脑电信号检测技术的进展[J].电子学报,2009,37(1):153-157.
[3] BRENT DW,PATRICK A T.Quantitative analysis of the tissue response to chronically implanted microwire electrodes in rat cortex[J].Biomaterials,2010,31(7):1558-1567.
[4] TSAIML,YEN C T.A simplemethod for fabricating horizontal and verticalmicrowire arrays[J].Journal of Neuroscience Methods,2003,131(1):107-110.
[5] 曹征,李天翱,隋晓红,等.多层视网膜上假体柔性薄膜微电极阵列的研究[J].中国医疗器械杂志,2010,34(6):399-402.
[6] ABHISHEK P,JUSTIN C S.Quantifying long-term microelectrode array functionality using chronic in vivo impedance testing[J].Journal of Neural Engineering,2012,9(2):1-11.
[7] KOZAIT D,KIPKE D R.Insertion shuttle with carboxyl terminated self-assembled monolayer coatings for implanting flexible polymer neural probes in the brain[J].Neurosci.Methods,2009,184(2):199-205.
[8] BIRAN R,MARTIN D C,TRESCO P A.Neuronal cell loss accompanies the brain tissue response to chronically implanted silicon microelectrode arrays[J].Exp.Neurol,2005,195(1):115-126.
[9] ROUSCHE P J,PELLINEN D S,PIVIN D P,et al.Flexible polyimide-based intracortical electrode arrays with bioactive capability[J].IEEE Trans Biomed Eng 2001,48(3):361-371.
[10]JONAST,JO H,PSOUNIE,et al.Implant size and fixationmode strongly influence tissue reactions in the CNS[J].PLoSONE ,2011,6(1):1-9.
[11] WU Suo-zhu,BIN Su.A simple approach for fabrication ofmicroring electrodes[J].Journal of Electroanalytical Chemistry,2013,694(1):12-16.
[12] DAVID A R.The electrical properties ofmetalmicroelectrodes[J].Proceedings of The IEEE,1968,56(6):1065-1067.
[13] SCOTT F L.The electrode-tissue interface during and stimulation in the central nervous system[D].Cleaveland:Case Western Reserve University Department of Biomediacl Engineering,2010.
[14] ABHISHEK P,XUEQING-shan,VISWANATH S,et al.Comprehensive characterization and failure modes of tungsten microwire arrays in chronic neural implants[J].Journal of Neural Engineering,2012,9(5):1-16.
[15]GYTISB,EMMA M,ELISA C,et al.Carbon nanotube composite coating of neuralmicroelectrodes preferentially improves the multiunit signal-to-noise ratio[J].Journal of Neural Engineering,2011,8(6):1-13.
[16] HUIGEN E,PEPER A,GRIMBERGEN CA.Investigation into the origin of the noise of surface electrodes[J].Med.Biol.Eng.Comput.,2002,40(3):332-338.
[17] LIU Xin-dong,DOUGLAS B,M.Stability of the interface between neural tissue and chronically implanted intracortical microelectrodes[J].IEEE Transactions on Rehabilitation Engineering,1999,7(3):315-325.
[18] POLIKOV V S,TRESCO P A,REICHERT,W M.Response of brain tissue to chronically implanted neural electrodes[J].Neurosci.Methods,2005,148(1):1-18.
