左旋布比卡因与布比卡因鞘内注射对犬脊髓及神经根超微结构的影响
2014-12-02郭建荣金孝岠苏永俊
吕 娜,郭建荣,金孝岠,苏永俊,刘 洋
(1皖南医学院,安徽芜湖241000;2上海市浦东新区公利医院)
蛛网膜下腔阻滞后有部分病例会发生局麻药脊髓神经毒性,临床表现为短暂性神经功能障碍(TNS)[1]、马尾综合征(CES)[2]、延迟性骶神经感觉障碍和格林—巴利综合症(GBS)等,尤其以TNS更为多见。TNS出现在椎管内麻醉作用消失、神经功能完全恢复后的24 h内,通常在5 d内自然消失。CES发病率虽较TNS低,但预后多为永久性神经运动与感觉功能障碍,给患者造成终身痛苦。国内外目前已有将左旋布比卡因用于蛛网膜下腔阻滞的临床报道[3],但尚缺乏这方面的基础理论研究。我们将不同浓度和剂量的盐酸布比卡因和盐酸左旋布比卡因分别注入犬蛛网膜下腔,观察在不同浓度和剂量下局麻药物对犬脊髓、神经根超微结构和脑脊液(CSF)生化方面的影响,为临床合理用药提供理论依据。
1 材料与方法
1.1 主要仪器与药品 原子吸收分光光度计(日本)、JEM-1200EX透射电镜(日本)、IL1620血气分析仪(意大利)、AVL9130离子分析仪(美国)、超声细胞破碎机(德国UP200H)、电动组织匀浆机(德国DIAX-900)、可见分光光度计(法国S500-P)。盐酸左旋布比卡因注射液(产品批号:04121032,江苏恒瑞医药股份有限公司生产),盐酸布比卡因注射液(产品批号:H31022839,上海禾丰制药有限公司生产)。
1.2 动物处理 健康杂种犬30只,雌雄不限,犬龄4~6个月,体质量10~15 kg,由公利医院实验动物中心提供。将动物随机分为5组,各6例。动物实验前禁食水12 h。采用肌注氯胺酮20 mg/kg、阿托品0.05 mg/kg基础麻醉,开放前肢静脉,输注乳酸林格氏液维持体液平衡,气管插管后接Drager Julia麻醉机行机械控制呼吸,吸入氧浓度100%,调节呼吸参数,维持PETCO2在30~40 mmHg。实验全程持续泵注芬太尼、维库溴铵、间断吸入低浓度异氟醚维持麻醉。动物置仰卧位固定,颈部切开分离右颈内动脉置入20 G套管针,接美国PHILIPS MP60多功能监护仪监测血液动力学指标的变化。犬背部除毛、消毒铺巾,侧卧下于L3~L4间隙切开,切除棘上、棘间韧带,屈曲位下用尼龙针行蛛网膜下腔穿刺,见清亮CSF流出后,在20 s内,C组注入生理盐水2 mL、L1组注入0.5%左旋布比卡因2 mL、L2组注入0.75%左旋布比卡因2 mL、B1组注入0.5%布比卡因2 mL、B2组注入0.75%布比卡因2 mL。观察并记录各组注药前及注药后 10、20、30、60、120、180 min 时血液动力学指标(SBP、DBP、MAP、HR)的变化;检测注药前与注药后1、2、3 h动脉血气、电解质的变化。
1.3 各组CSF中氧分压(PO2)、乳酸值(Lac)检测及脊髓、神经根组织早期超微结构观察 观察注药前与注药后1、2、3 h CSF中PO2和Lac的变化;注药后3 h动脉注射空气处死动物,暴露椎管切取L1~L2脊髓及马尾神经组织,用去离子水清洗3次,滤纸吸干水分,置于-70℃低温冰箱保存备检。采用原子吸收分光光度法测定脊髓组织中Ca2+含量,用黄嘌呤氧化酶法测定脊髓组织中SOD活力,用硫代巴比妥酸法(TBA)法测定脊髓组织中MDA的含量。每组随机取L1~L2脊髓后角和马尾神经组织,置于3%戊二醛磷酸缓冲液中固定,用透射电镜观察脊髓及神经根组织超微结构的变化。对神经元胞质、灰质、髓鞘、内外轴膜及神经根超微结构改变视觉评分,评分标准:0分=无异常改变;1分=非常轻度的改变;2分=轻微的改变;3分=中等程度的改变;4分=有显著的改变。
1.4 统计学方法 采用SPSS11.0统计软件。计量资料以±s表示,采用t检验或单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
各组动物麻醉时间、术中输液和尿量组间比较,P均>0.05。C组麻醉后血流动力学比较稳定;实验组有少量动物注药后5~10 min出现BP降低、HR增快,经快速输液和(或)静注麻黄碱10~15 mg后BP基本恢复至基础值。
椎管内注药后不同时点各组PaO2、PaCO2和pH值比较P均 >0.05。各组血浆中 K+、Na+、Cl-注药前、后组间比较P均>0.05。
2.1 各组CSF中PO2和Lac值的变化 见表1、2。
表1 各组CSF中Lac的变化(mmol/L,±s)
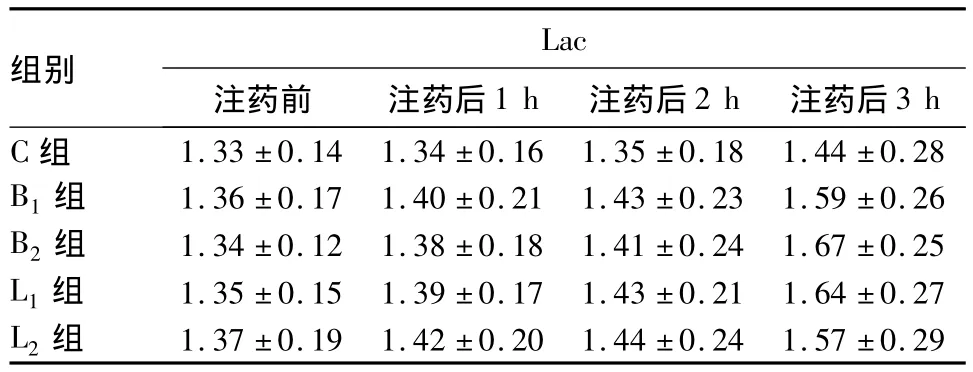
表1 各组CSF中Lac的变化(mmol/L,±s)
组别3 h C组Lac注药前 注药后1 h 注药后2 h 注药后1.33 ±0.14 1.34 ±0.16 1.35 ±0.18 1.44 ±0.28 B1组 1.36 ±0.17 1.40 ±0.21 1.43 ±0.23 1.59 ±0.26 B2组 1.34 ±0.12 1.38 ±0.18 1.41 ±0.24 1.67 ±0.25 L1组 1.35 ±0.15 1.39 ±0.17 1.43 ±0.21 1.64 ±0.27 L2组1.37 ±0.19 1.42 ±0.20 1.44 ±0.24 1.57 ±0.29
表2 各组CSF中PO2的变化(mmHg,±s)
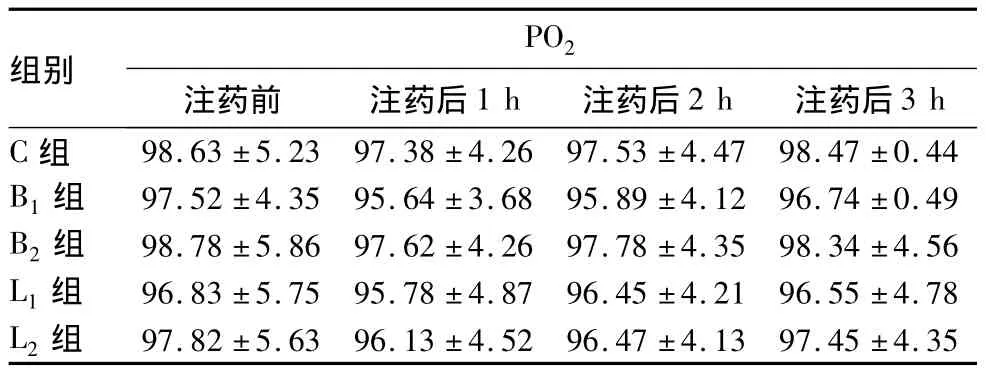
表2 各组CSF中PO2的变化(mmHg,±s)
PO2组别3 h C 组 98.63 ±5.23 97.38 ±4.26 97.53 ±4.47 98.47 ±0.44注药前 注药后1 h 注药后2 h 注药后B1 组 97.52 ±4.35 95.64 ±3.68 95.89 ±4.12 96.74 ±0.49 B2 组 98.78 ±5.86 97.62 ±4.26 97.78 ±4.35 98.34 ±4.56 L1 组 96.83 ±5.75 95.78 ±4.87 96.45 ±4.21 96.55 ±4.78 L2 组 97.82 ±5.63 96.13 ±4.52 96.47 ±4.13 97.45 ±4.35
2.2 脊髓组织中Ca2+、MDA含量和SOD活力的变化 注药后3 h各组动物脊髓组织中Ca2+、MDA含量及SOD活力变化组间比较P均>0.05,见表3。
表3 脊髓组织中Ca2+、MDA含量及SOD 活力的变化(±s)
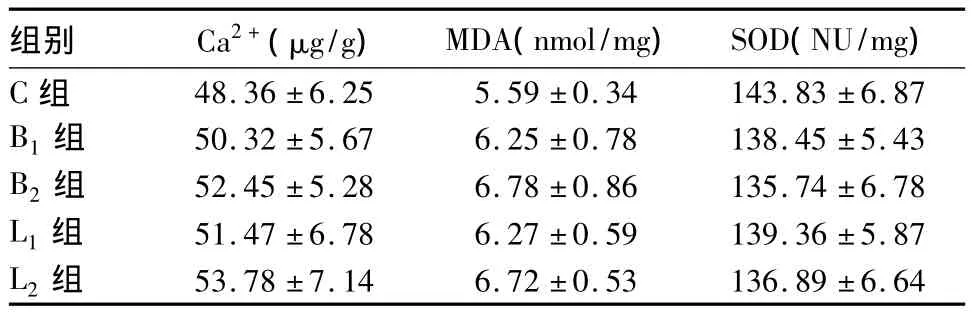
表3 脊髓组织中Ca2+、MDA含量及SOD 活力的变化(±s)
组别 Ca2+(μg/g) MDA(nmol/mg) SOD(NU/mg)C组48.36 ±6.25 5.59 ±0.34 143.83 ±6.87 B1 组 50.32 ±5.67 6.25 ±0.78 138.45 ±5.43 B2 组 52.45 ±5.28 6.78 ±0.86 135.74 ±6.78 L1 组 51.47 ±6.78 6.27 ±0.59 139.36 ±5.87 L2组53.78 ±7.14 6.72 ±0.53 136.89 ±6.64
2.3 脊髓及神经根组织超微结构的变化 C组脊髓组织超微结构基本正常,神经元胞质内可见结构正常的多个线粒体和粗面内质网,线粒体包膜完整,嵴清晰可见,有髓神经纤维的髓鞘完整清晰。B1、L1组脊髓组织神经元胞质基本接近正常,多数线粒体、内质网结构完整,有髓神经纤维的板层结构基本正常。B2、L2组神经元胞质内绝大多数神经元结构清楚,胞质内可见少量线粒体空泡变性,结构基本正常;神经组织有局灶性的轻度水肿,有髓神经纤维的板层结构及雪旺氏细胞基本正常,部分有髓神经纤维的板层结构疏松。神经元胞质、灰质、髓鞘、内外轴膜及神经根超微结构改变视觉评分情况如下:①神经元胞质空泡形成或变性:C、B1、L1组为0分,B2组为2分,L2组为1分;②灰质内空泡形成:C组为0分,B1、L1、L2组为 1分,B2组为 3分;③髓鞘丢失、断裂:C、B1、L1组为 0 分,B2、L2组为1 分;④内外轴膜清晰程度:C、B1、L1组为0分,B2组为3分,L2组为1分;⑤神经根空泡变性:C组为0分,B1、L1组为1分,B2组为3分,L2组为1分。
3 讨论
左旋布比卡因是长效酰胺类局麻药布比卡因的左旋体,与布比卡因相比,对中枢神经系统和心血管系统的毒性更小,而且麻醉效果更佳平稳。左旋布比卡因已成功应用于硬膜外和外周神经阻滞,在腰硬联合麻醉方面的应用也越来越广泛,而且获得了满意的临床效果[4]。近年来,对局麻药毒性的研究越来越多,发现几乎所有的局部麻醉药均存在细胞毒性作用[5],低浓度时可引起细胞凋亡,而高浓度时以细胞坏死为主要表现。
局麻药的脊髓神经毒性与硬膜外及蛛网膜下腔都存在“易损区”有关。硬膜外的易损区为脊神经根硬脊膜处,药物易于在此区积聚、沉淀,是发挥神经阻滞的主要部位。而鞘内易损区奥—雷二氏区为脊神经后根入脊髓处,该处神经纤维无髓鞘,局麻药注入蛛网膜下腔后在此处向脊神经后根相邻的脊髓白质浅层扩散,而药物很少或不向远心端扩散[6]。另外,局麻药的神经毒性也受局麻药的化学结构和种类、剂量和浓度、作用时间、比重、局麻药的 pH值、储存方式[7]及辅助药物应用等的影响。
局麻药应用于蛛网膜下腔所引起的神经系统毒性表现主要以神经纤维和脊髓初级神经元的损伤为主,其所引起脊髓神经毒性的机制仍不是十分清楚,可能有以下几方面机制:①神经细胞凋亡学说。细胞凋亡包括信号传导、基因调控和凋亡效应执行三个阶段。信号传导的激活是启动凋亡的前提,丝裂原激活蛋白激酶(MAPK)是凋亡信号传导的重要通路之一,而c-Jun氨基末端激酶(JNK)属于MAPK家族成员,在脑缺血缺氧致神经细胞凋亡中起重要调控作用[8]。②线粒体介导的细胞凋亡。线粒体释放细胞色素C(Cyt C)触发caspase级联反应,启动内源性凋亡途径是线粒体介导内源性凋亡通路的重要环节。Onizuka等[9]发现线粒体跨膜电势衰减是触发Cyt C释放,诱导凋亡的重要因素,其受胞内质子电化学梯度即胞内pH值得影响。③局麻药自身神经毒性学说。局麻药可直接作用于细胞膜,Kitagawa等发现,局麻药与一种常见的表面活性物质即十二烷基三甲基氯化铵类似,具有分子聚集作用。这种类去污剂的特性在一定浓度时具有的增溶作用,即在细胞外液渗透压力尚不足以影响神经元细胞膜时,可提高局麻药表面活性物质聚集比例,导致神经细胞膜结构不可逆性破坏。④神经局部缺血和血—神经屏障破坏。局麻药本身具有对神经血管张力调节的能力,局麻药的神经毒性与脊神经局部缺血相关[10]。长时间暴露于高浓度局麻药可引起血供减少,同时加入肾上腺素等缩血管药物可进一步延长脊神经与局麻药的接触时间,使血流进一步减少。⑤谷氨酸浓度、AMPA受体和NMDA受体活性改变。局麻药导致脊髓神经系统兴奋性氨基酸谷氨酸的释放增加,过度激活NMDA受体,使细胞内Ca2+浓度增加,引起神经细胞损害。研究[11]发现,小鼠鞘内注射利多卡因后,CSF中谷氨酸含量呈浓度依赖性增加,过度活化的谷氨酸受体介导神经损伤。⑥有研究发现,局麻药可干扰亲神经因子的轴突传递,使细胞体中缺乏亲神经因子,引起延迟性神经损害。这种情况被认为是在细胞核断裂过程中酶作用所致,可能是神经延迟损伤的作用机制。⑦此外,局麻药诱导的神经毒性与p53基因的活化、蛋白激酶B(PKB)表达上调[12]、炎性反应等有关。
CSF中Lac水平的升高是严重脊髓损伤的可靠指标,CSF中Lac浓度可以反映脊髓的代谢平衡。此外,Ishizaki等在动物实验中研究发现,CSF中PO2与脊髓组织中的PO2有良好的相关性,故此CSF中PO2可作为脊髓组织缺血程度的监测指标。本研究从CSF中Lac值、PO2检测结果来推测脊髓及神经根组织损伤的程度,结果显示,临床常用浓度的布比卡因、左旋布比卡因对脊髓及神经根组织未造成明显的缺血缺氧性损害。
细胞内钙超载是许多细胞损伤的主要原因,具有去污性质的局麻药可能增加了神经细胞轴浆内的Ca2+含量而损伤神经细胞。局麻药神经毒性大小与细胞内Ca2+含量呈依赖关系[13]。邓小明等报道显示增加的Ca2+主要集聚在线粒体内,引起线粒体损伤及功能障碍。细胞内钙超载激活了各种酶,破坏细胞结构,最终引起细胞死亡。本研究结果显示,各组动物脊髓组织中Ca2+含量无显著差异,提示蛛网膜下腔注入临床相关浓度和剂量的布比卡因、左旋布比卡因对脊髓组织损伤轻微。
目前多数研究认为,神经损伤后神经元变性坏死是由于在缺氧条件下自由基介导的脂质过氧化反应所致。因此,检测MDA常可反映机体内脂质过氧化的程度,间接地反映出神经细胞损伤的程度。SOD是体内重要的抗氧化酶,是清除自由基的主要途径。结果证实,实验各组MDA、SOD水平与生理盐水对照组无显著性差异,说明各组氧化与抗氧化程度相似,从一个侧面也可说明临床常用浓度的布比卡因、左旋布比卡因并未对脊髓组织造成直接的氧化损伤。
既往的研究显示,不同浓度和剂量的重比重布比卡因注入蛛网膜下腔后,72 h的脊髓组织病理切片显示,随着浓度和剂量增加,布比卡因使脊髓组织坏死的发生率也随之增加。本研究电镜结果显示,浓度为0.5%和0.75%的布比卡因、左旋布比卡因组,其脊髓组织神经元胞质和有髓神经纤维的板层结构多数都基本接近正常,提示常用浓度和剂量的布比卡因、左旋布比卡因鞘内注射对犬脊髓、神经根组织超微结构无显著影响,但也显示出随着局麻药浓度升高,神经元胞质内线粒体和内质网以及神经根有髓神经纤维髓鞘的板层结构均发生不同程度的改变,提示随着局麻药浓度增加,其对脊髓神经系统的毒性作用有增强趋势。
综上所述,局麻药诱导的神经毒性并非是简单的一元论,而是多通路或多途径共同介导的结果,在神经阻滞麻醉中局麻药的安全性十分重要。与布比卡因比较,相同浓度和剂量的左旋布比卡因对犬脊髓和神经根超微结构的影响更加轻微。但在高浓度、大剂量情况下是否可造成不可逆的脊髓神经功能损害,尚有待于进一步研究证实。
[1]吴黄辉,陈国忠,王玉同.局麻药神经毒性的研究进展[J].神经解剖学杂志,2013,29(2):214-220.
[2]Aguilar JL,Peláez R.Transient neurological syndrome:does it really exist[J].Curr Opin Anaesthesiol,2004,17(5):423-426.
[3]Camorcia M,Capogna G,Berritta C,et al.The relative potencies for motor block after intrathecal ropivacaine,levobupivacaine,and bupivacaine[J].Anesth Analg,2007,104(4):904-907.
[4]周勤,彭黎,曾冬莲.蛛网膜下腔阻滞麻醉应用左旋布比卡因的临床分析[J].中外医学研究,2012,10(28):1-2.
[5]Werdehausen R,Braun S,Fazeli S,et al.Lipophilicity but not stereospecificity is a major determinant of local anaesthetic-induced cytotoxicity in human T-lymphoma cells[J].Eur J Anaesthesiol,2012,29(1):35-41.
[6]Kaneko S,Matsumoto M,Tsuruta S,et al.The nerve root entry zone is highly vulnerable to intrathecal tetracaine in rabbits[J].Anesth Analg,2005,101(1):107-114.
[7]Berto LA,Groppo FC,Ramacciato JC,et al.The influence of local anesthetic solutions storage on tissue inflammatory reaction[J].Med Oral Patol Oral Cir Bucal,2011,16(1):e83-88.
[8]崔翔,陈彦青,刘荣国,等.二氮嗪预处理对大鼠海马神经细胞缺氧复氧时c-Jun氨基末端激酶表达的影响[J].中华麻醉学杂志,2009,29(4):368-371.
[9]Onizuka S,Yonaha T,Tamura R,et al.Lidocaine depolarizes the mitochondrial membrane potential by intracellular alkalization in rat dorsal root ganglion neurons[J].J Anesth,2011,25(2):229-239.
[10]Becker DE,Reed KL.Local anesthetics:review of pharmacological considerations[J].Anesth Prog,2012,59(2):90-101.
[11]Wu CT,Wen LL,Wong CS,et al.Temporal changes in glutamate,glutamate transporters,basilar arteries wall thickness,and neuronal variability in an experimental rat model of subarachnoid hemorrhage[J].Anesth Analg,2011,112(3):666-673.
[12]Sun ZH,Xu XP,Song ZB,et al.Repeated intrathecal administration of ropivacaine causes neurotoxicity in rats[J].Anaesth Intensive Care,2012,40(5):825-831.
[13]郭建荣,李顺,岳云.局部麻醉药脊髓神经毒性及其防治研究进展[J].中国临床药学杂志,2008,17(6):385-388.
