黄芪注射液对大鼠皮层神经细胞缺氧性凋亡的影响
2014-12-02孟传萍张淑华赵姣姣
孟传萍,刘 东,张淑华,赵姣姣
(1宁津县人民医院,山东德州253400;2青岛大学医学院附属医院)
黄芪作为一种传统中药,生用可益卫固表、破血逐瘀、托毒生肌,灸用可补中益气[1]。近年研究发现,黄芪对缺血再灌注损伤有保护作用,其可通过减少自由基生成、增加脑血流量,进一步减轻细胞损伤[2,3]。缺血缺氧导致的神经细胞凋亡是脑梗死和脑出血等疾病重要的病理基础[4]。2013年6月~2013年12月,我们观察了黄芪对大鼠神经细胞缺氧性凋亡的影响,现分析结果,并探讨其可能的作用机制,旨在为黄芪注射液在脑缺氧缺血性疾病治疗中的应用提供依据。
1 材料与方法
1.1 大鼠神经细胞分离与培养 出生20 h内雌性SD大鼠24只,体质量2~8 g。脱臼法处死大鼠,眼科剪剪取大鼠大脑,取出大脑皮质,分成1 mm3的小块,室温下消化20 min,用10%FBS终止其反应,用培养基清洗2次,滴加完全培养基吹打,静置10 min,吸取上清细胞悬液过70 μm尼龙网筛,血计数板计数细胞,以3×105/mL密度接种于96孔培养板,每孔分别加入0.1 mL,培养板置培养箱中培养4 h,后吸取培养基,继续加入2%B27Neurobasal培养液培养,3 d后半量换液。
1.2 缺氧性凋亡细胞模型制备与分组处理 将细胞分为对照组、模型组、黄芪组,对照组及模型组每组4个复孔,黄芪组12个复孔。对照组常规饲养,模型组、黄芪组参照文献[4]制作缺氧性凋亡细胞模型:将神经细胞置于缺氧罐中,通入95%N2和5%CO2的混合气体,流量为 2.0 L/min,持续20 min,封闭的缺氧罐置培养箱中培养,12 h后将细胞从缺氧罐中取出,放入培养箱中复氧后继续培养。制模后黄芪组分别加入1、10、100 μg/mL的黄芪注射液(每浓度4个复孔);模型组及对照组不加入药物。
1.3 相关指标观察
1.3.1 细胞形态学变化 处理后6 h吸去板内培养基,将100 μg/mL 丫碇橙(AO)和 100 μg/mL 嗅乙啶(EB)等量混匀,每孔分别加入10 μL后静置10 min,荧光显微镜下观察细胞形态学变化。
1.3.2 细胞超微结构改变 处理后6 h收取细胞,离心机富集后弃上清,4℃预冷,戊二醛固定,2 h后PBS洗涤,锇酸固定,梯度乙醇丙酮脱水,常规包埋、聚合、超薄切片、铅染,透射电镜下观察凋亡细胞超微结构变化。
1.3.3 细胞凋亡情况 处理后12、24 h取各组细胞冷PBS液清洗2次,加入70%的乙醇4℃固定过夜。离心机离心,弃去上清,加入 TritonX-100及RNaseA 各200 μL,15 min 后加入 PI染料 1 mL,室温下避光静置15 min,于流式细胞仪进行荧光检测(激发波长490 nm,发射波长670 nm),计算细胞凋亡率。
1.3.4 Bcl-2、Caspase-8蛋白表达 采用 Western blot法检测。各组处理后6 h取各组细胞,RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度,PBS调整蛋白终浓度为1 μg/μL,用12%聚丙烯酰胺凝胶电泳,电转移至PVDF膜,脱脂奶粉封闭,2 h后放入兔抗人Bcl-2、Caspase-8单克隆抗体,4℃孵育过夜,加入碱性磷酸酶标记的二抗(羊抗兔)室温孵育2 h,滴加ECL液显色,最后进行曝光拍照。各组蛋白表达与内参GAPDH相比,计算相对表达量。
1.4 统计学方法 采用SPSS17.0软件进行统计学分析。计量资料用±s表示,重复测量数据比较采用多因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 细胞形态与超微结构 荧光显微镜下,AO染色的细胞核呈黄绿色光,可浓聚成颗粒状,多位于细胞一侧,EB染色的晚期凋亡细胞核呈桔红色,浓聚或偏向,还可见少数细胞核碎裂成块状。10 μg/mL黄芪处理的细胞少量颗粒聚集在细胞一侧,核呈淡黄绿色;100 μg/mL黄芪处理的细胞凋亡数明显减少,核呈淡黄色,几乎看不到核碎裂象。电镜下,模型组大鼠皮层神经细胞可见细胞边缘起泡出芽、膨出,部分凋亡细胞内观察到凋亡小体;黄芪组中100 μg/mL黄芪处理的细胞呈卵圆型,边缘有少量微绒毛,胞质内线粒体可观察到线粒体峭,核糖体存在于粗面内质网表面,细胞核内可见核仁,细胞染色质正常。
2.2 神经细胞凋亡情况 各组神经细胞凋亡率见表1。黄芪组、模型组细胞凋亡率高于对照组(P均<0.05),但黄芪组神经细胞凋亡率低于模型组,且凋亡率随黄芪浓度的增加而减少(P均<0.05)。
表1 各组神经细胞凋亡率比较(n=4,%,±s)
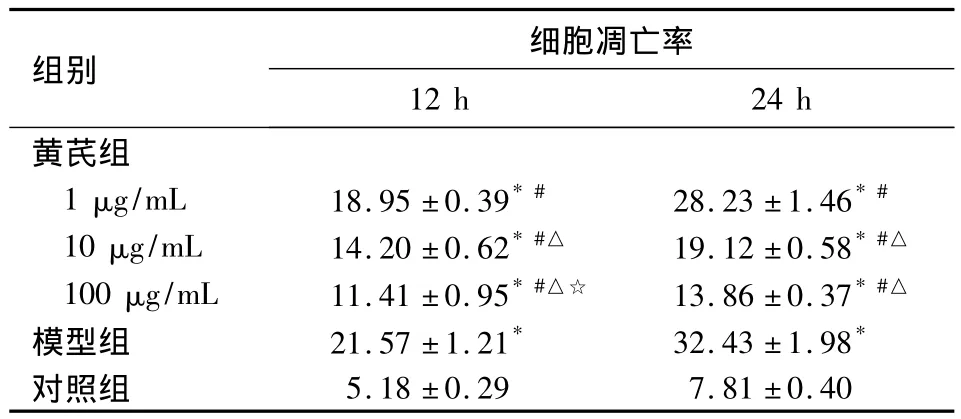
表1 各组神经细胞凋亡率比较(n=4,%,±s)
注:与对照组相比,*P <0.05;与模型组相比,#P <0.05;与黄芪组1 μg/mL 相比,△P <0.05;与黄芪组10 μg/mL 相比,☆P <0.05
组别 细胞凋亡率12 h 24 h 5.18 ±0.29 7.81 ±0.40黄芪组1 μg/mL 18.95 ±0.39*# 28.23 ±1.46*#10 μg/mL 14.20 ±0.62*#△ 19.12 ±0.58*#△100 μg/mL 11.41 ±0.95*#△☆ 13.86 ±0.37*#△模型组 21.57 ±1.21* 32.43 ±1.98*对照组
2.3 细胞Bcl-2、Caspase-8表达 黄芪组、模型组Bcl-2表达均低于对照组,但黄芪组高于模型组,且Bcl-2表达随黄芪浓度的增加而增加(P均<0.05)。黄芪组、模型组Caspase-8表达高于对照组,但黄芪组低于模型组,且Caspase-8表达随黄芪浓度增加而降低(P均<0.05)。见表2。
表2 各组细胞Bcl-2、Caspase-8表达比较(n=4,±s)
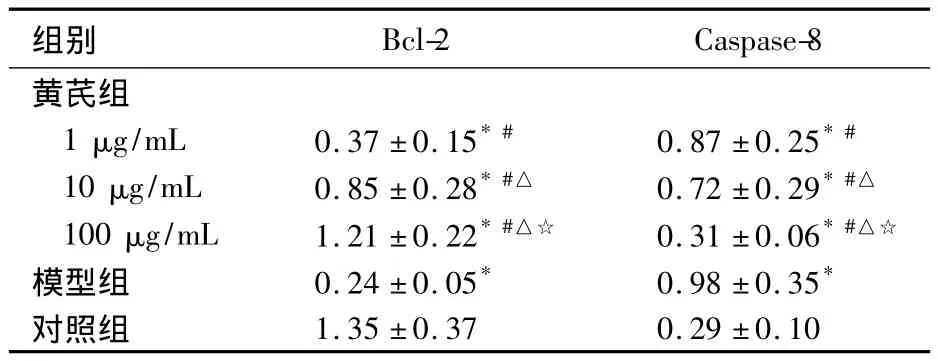
表2 各组细胞Bcl-2、Caspase-8表达比较(n=4,±s)
注:与对照组相比,*P <0.05;与模型组相比,#P <0.05;与黄芪组1 μg/mL 相比,△P <0.05;与黄芪组10 μg/mL 相比,☆P <0.05
组别Bcl-2 Caspase-8 1.35 ±0.37 0.29 ±0.10黄芪组1 μg/mL 0.37 ±0.15*# 0.87 ±0.25*#10 μg/mL 0.85 ±0.28*#△ 0.72 ±0.29*#△100 μg/mL 1.21 ±0.22*#△☆ 0.31 ±0.06*#△☆模型组 0.24 ±0.05* 0.98 ±0.35*对照组
3 讨论
脑缺血缺氧性疾病临床常见,神经细胞缺氧性凋亡是其重要病理学改变[5],逆转凋亡为该类疾病重要的治疗原则[6]。现代药理学研究表明,黄芪可使减少的血细胞恢复正常,扩张冠状动脉,改善心脏功能,加强抗缺氧能力,防止脂质过氧化,改善肾脏功能,防止肝糖原减少,还有抗衰老的功能[7]。近年来研究表明,黄芪有抗缺血再灌注损伤的作用,可改善缺血缺氧后脑血流量、减少自由基的生成、降低兴奋性氨基酸毒性,从而减轻细胞损伤[8,9]。
本研究采用对缺血缺氧十分敏感的大鼠皮层神经细胞进行原代培养,构建缺氧性凋亡模型。结果显示模型组细胞活性均明显下降,可见大量凋亡细胞。各黄芪干预组细胞凋亡率均低于模型组,且细胞凋亡率随黄芪浓度增加而降低,100 μg/mL的黄芪作用最明显。这表明黄芪注射液可抑制缺氧神经细胞凋亡,对缺氧后神经系统康复有一定帮助。
研究发现细胞凋亡与多种基因调控有关,其中Bcl-2蛋白家族在细胞凋亡中发挥重要作用[10,11]。Bcl-2蛋白可通过调控Ca2+浓度,保持其动态平衡[12]。细胞凋亡依赖于对天冬氨酸特异的Caspase,进而产生级联反应,而Caspase-8是死亡受体介导的凋亡途径中关键的启动因子[13,14]。其通过寡聚而自身切割活化,进一步激活下游半胱氨酸蛋白酶,产生凋亡效应[15,16]。本研究发现黄芪能使缺氧神经细胞中Bcl-2表达增加,Caspase-8表达降低,且高浓度黄芪组作用更为明显,提示黄芪的抗神经细胞凋亡作用可能与调控Bcl-2、Caspase-8表达有关。本研究结果可为临床上使用黄芪提取物治疗等缺氧性脑病提供理论依据。
[1]Kim MH,Kim SH,Yang WM.Beneficial Effects of Astragaloside IV for Hair Loss via Inhibition of Fas/Fas L-Mediated Apoptotic Signaling[J].PLoS One,2014,9(3):278-288.
[2]Yuan C,Pan X,Gong Y,et al.Effects of Astragalus polysaccharides(APS)on the expression of immune response genes in head kidney,gill and spleen of the common carp,Cyprinus carpio L[J].Int Immunopharmacol,2008,8(1):51-58.
[3]Luo Y,Qin Z,Hung Z,et al.Astraguloside IV protects against ischemie brain injury in a murine model of transient focal ischemia[J].Neurosci Lett,2004,363(3):218-223.
[4]Yadovlev AG,Faden AI.Mechanisms of neural cell death:impfications for development of neuroprotective treatment strategies[J].Neuro Rx,2004,1(1):5-16.
[5]Matsiukevich D,Randis TM,Utkina-Sosunova I,et al.The state of systemic circulation,collapsed or preserved defines the need for hyperoxic or normoxic resuscitation in neonatal mice with hypoxiaischemia[J].Resuscitation,2010,81(2):224-229.
[6]Li D,Shao Z,Vanden Hoek TL.Reperfusion accelerates acute neuronal death induced by simulated ischemia[J].Exp Neural,2007,206(2):280-287.
[7]Liu Y,Sereombe R,Xie D.Inhibition of caspase-9 activiatiou and apoptosis is involved in ischemie preconditioning-induced neuroprotection in rat brain[J].Neurol Res,2007,29(8):855-861.
[8] Sun Y,Jin L,Wang T,et al.Polysaccharides from astragalus membranaceus promote phagocytosis and superoxide anion(O2-)production by coelomocytes from sea cucumber apostichopus japonicus in vitro[J].Comp Biochem Physiol C Toxicol Pharmacol,2008,147:293-298.
[9]Hu Q,Wu C,Chen JY,et al.The relationship between hypoxiainducible factor-1α expression and apoptosis in early brain injury after subarachnoid hemorrhage[J].Zhejiang Da Xue Xue Bao Yi Xue Bao,2014,43(1):58-65.
[10]Zhang X,Weng C,Li Y,et al.Human Bop is a novel BH3-only member of the Bcl-2 protein family[J].Protein Cell,2012,3(10):790-801.
[11] Javier Miguel-Hidalgo J,Paul IA,Wanzo V,et al.Memantine prevents cognitive impairment and reduces Bcl-2 and caspase 8 immunoreactivity in rats injected with amyloid β(1-40)[J].Eur J Pharmacol,2012,692(1-3):38-45.
[12]Yamasaki Y,Yamasaki M,Tachibana H,et al.Important role of β1-integrin in fucoidan-induced apoptosis via caspase-8 activation[J].Biosci Biotechnol Biochem,2012,76(6):1242-1244.
[13]Chung H,Kim E,Lee DH,et al.Ghrelin inhibits apoptosis in hypothalamie neuroual cells during oxygen-slacose deprivation[J].Endocdnology,2007,148(1):148-159.
[14]Cap G,Xing J,Xiao X,et al.Critical role of ealpain J in mitochondrial release of apoptosis inducing factor in ischemic neuronal injury[J].J Neurosci,2007,27(35):9278-9293.
[15]Kemie SG,Parent JM.Forebrain neurogenesis after ischemic and traumtic brain injury[J].Neurobiol Dis,2010,37(2):267-274.
[16]Aizawa K,Ageyama N,Terao K,et al.Primate-specific alterations in neural stem/progenitor cells in the aged hippocampus[J].Neurobiol Aging,2011,32(1):140-150.
