CAR siRNA对睾丸支持细胞上皮屏障通透性的影响及机制
2014-12-02李兴旺赵艳玲
李兴旺,赵艳玲
(温州医科大学附属第二医院育英儿童医院,浙江温州325027)
睾丸支持细胞位于曲细精管内基底膜附近,不仅为生精细胞的持续发育和分化提供结构上的支持和营养的供给,而且形成了一种非常重要的生理结构——血睾屏障,从而确保精子发生的顺利进行[1,2]。血睾屏障的构成和功能受到精密调控。如Occludin蛋白是一种紧密连接膜蛋白[3],其磷酸化参与调节了精母细胞穿过血睾屏障过程中屏障功能的变化[4,5]。柯萨奇病毒—腺病毒受体(CAR)属于免疫球蛋白超家族,是广泛存在于上皮和内皮组织的一种紧密连接跨膜蛋白[6~8]。在大鼠生精上皮,CAR表达于支持细胞和处于迁移过程中的生精细胞[6,9],但其生理作用目前尚不明了。本研究采用体外血睾屏障模型(支持细胞上皮屏障模型),观察CAR小干扰RNA(si RNA)对支持细胞上皮屏障通透性的影响,并探讨其机制。
1 材料与方法
1.1 主要试剂及仪器 DMEM/F12培养基、胰蛋白酶、表皮生长因子(EGF)、大豆胰蛋白酶抑制剂、Ⅱ型胶原酶、透明质酸酶S-Ⅰ型、DNA酶Ⅰ购自美国Sigma公司;24孔细胞培养板由美国Corning公司提供;MillicellOR-PCF型插入小室(膜面积为0.6 cm2)和MillicellOR-ERS(electrical resistance system)购自美国Millipore公司。单克隆兔抗Occludin抗体和FITC-山羊抗兔IgG分别购自美国Zymed Laboratories公司和英国Abcam公司。BX53荧光显微镜购自日本Olympus公司;Macprobe 5.1处理软件。凝胶成像系统购自美国Bio Rad公司;siRNA购自美国Ambion公司。
1.2 体外血睾屏障模型制备及分组 采用睾丸支持细胞原代双室培养方法[10,11]制备睾丸支持细胞上皮屏障,即体外血睾屏障模型。大鼠睾丸原代支持细胞经分离、接种、培养、纯化、鉴定而获得。将制备好的支持细胞混悬液按照每毫升2.5×106(按膜面积计算为1.67×106/cm2)细胞密度接种于双室模型的插入小室内。培养条件为5%CO2、35℃恒温恒湿培养。将细胞分为CAR siRNA组、对照组。CAR siRNA组细胞培养3 d后,采用100 nmol/L的CAR siRNA(5'-CCUGAACAGAGGAUCGAAATT-3')和RiboJuice siRNA转染试剂进行转染24 h;对照组采用100 nmol/L无同源性非靶向双链RNA及RiboJuice siRNA转染试剂进行转染。两组均按照说明书严格操作。
1.3 支持细胞中CAR mRNA检测 采用RT-PCR法。转染后第2天,收集细胞,按照TRIzol试剂盒说明书抽提细胞总RNA,反转录成cDNA,以此cDNA为模板进行PCR扩增。CAR基因的上游引物5'-CGCTCCTACTGTGCTTC-3',下游引物 5'-CTTTCTGGTTATCGGACGG-3'。内参基因 S-16的上游引物5'-TCCGCTGCAGTCCGTTCAAGTCTT-3',5'-GCCAAACTTCTTGGTTTCGCAGCG-3'。PCR产物经1.5%琼脂糖凝胶电泳,之后经凝胶成像系统成像分析。
1.4 睾丸支持细胞中CAR、Occludin蛋白检测 采用蛋白印迹法。转染结束后第2天,收集细胞,提取两组细胞总蛋白。蛋白经定量后,进行12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,之后通过电转膜法将蛋白转至硝酸纤维素膜上,封闭1 h后,加入相应的一抗(CAR、Occludin)及二抗,孵育反应、洗膜、ECL曝光、显影、洗片、拍照。以GAPDH为内参照,目的蛋白相对含量以目的蛋白灰度值与GAPDH灰度值的比值表示。
1.5 跨上皮电阻(TER)测定 大鼠睾丸支持细胞原代双室培养模型建立后,采用Millicell-ERS电阻系统测量双室模型内外室的电位差。具体方法参照Janecki等[11]的研究报道。TER值的计算公式:TER=(测定值-空白本底值)/膜的有效生长面积。
1.6 睾丸支持细胞的Occludin蛋白检测及分布观察 参照文献[12]方法,采用免疫荧光细胞化学染色法检测Occludin蛋白。从插入小室中吸出培养液,PBS(含 1 mmol/L CaCl2,1 mmol/L MgCl2)润洗2次,去除残留的培养液;加入足量含2.5%多聚甲醛的PBS,室温下孵育15 min,吸去多聚甲醛;加入含50 mmol/L NH4Cl的PBS,充分洗去剩余甲醛;加入含0.5%Triton的PBS,进行细胞膜打孔,室温下放置10 min;PBS润洗后,加入1%BSA室温下封闭30 min;加入50 μL 1~2 μg/mL单克隆兔抗 Occludin抗体,37℃放置30 min,PBS润洗;加入FITC-山羊抗兔IgG抗体,37℃放置30 min,PBS润洗3~4次,晾干后,在荧光显微镜观察Occludin分布情况。
1.7 睾丸支持细胞中与早期内涵体抗原1(EEA1)抗体结合的Occludin蛋白检测 将2 μg正常兔IgG加入含有300 μg蛋白的支持细胞裂解液,孵育1 h;然后加入10 μL蛋白A/G琼脂糖珠,孵育1 h,4℃离心后取上清液。在上清液中加入2 μg正常兔IgG(阴性对照)或EEA1抗体,室温过夜。然后加入20 μL蛋白A/G琼脂糖珠,孵育1 h。糖珠—抗原抗体复合物经裂解液洗涤,在SDS-PAGE加样缓冲液中100℃煮沸5 min,离心吸取上清液。Western blotting法检测免疫沉淀后特异性结合的Occludin蛋白量。
1.8 统计学方法 采用SPSS17.0统计软件。计量数据以±s表示,组间比较采用t检验或秩和检验。P≤0.05为差异有统计学意义。
2 结果
CAR siRNA组与对照组CAR mRNA相对表达量分别为 0.122 ±0.013、0.429 ±0.039,CAR 蛋白相对表达量分别为 0.142 ±0.041、0.532 ±0.022,两组比较,P均<0.05。睾丸支持细胞的TER在转染前3 d逐渐升高;3 d后稳定。转染结束后第2天CAR siRNA组与对照组TER分别为(37±2.5)、(50±3.0)ohm·cm2,转染后第 3 天分别为(38 ±2.4)、(47 ±2.9)ohm·cm2,两组比较,P <0.05。见图1。

图1 睾丸支持细胞培养不同时间点TER的变化
CAR siRNA组与对照组Occludin蛋白相对表达量分别为 0.164 ±0.025、0.143 ±0.031,两组比较,P>0.05。对照组细胞Occludin呈蜂巢样沿细胞膜线状分布;而CAR siRNA组分布较紊乱,细胞膜处减少,线性分布破坏,在细胞质内增多(图2)。与EEA1结合的Occludin蛋白量CAR siRNA组、对照组分别为 1.332 ±0.018、1.000 ±0.015,两组比较,P <0.05。
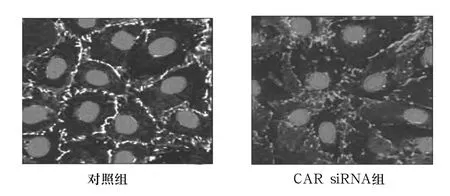
图2 两组睾丸支持细胞Occludin表达
3 讨论
血睾屏障是机体最有效的保护屏障之一,可阻止某些大分子物质经血液或淋巴途径进入曲细精管管腔,能调节生物活性物质在生精上皮内的浓度,同时具有免疫屏障作用,创造稳定生精内环境[2]。本实验培养的原代支持细胞之间逐渐形成屏障,电子显微镜下观察到血睾屏障的紧密连接、基底细胞外质特化、间隙连接和桥粒等超微结构,因此支持细胞上皮屏障模型是体外常用的模拟血睾屏障模型[10,11]。
TER由离子经细胞旁间隙流动形成,是检测细胞旁通透性的常用指标,可以反映支持细胞上皮屏障的通透性(完整性)[13]。对照组细胞在培养过程中,TER值逐渐升高,波峰形成于培养后3~4 d(屏障形成),然后在4~7 d维持稳定的TER值,同Lie等[9]的研究结果一致。
CAR作为柯萨奇病毒和腺病毒的特异受体,是Ⅰ型跨膜糖蛋白,因其在病毒感染宿主细胞过程中的重要介导作用而被广泛研究。在病毒攻击宿主细胞过程中,病毒纤维蛋白突竞争性地抑制宿主细胞之间原有的CAR-CAR连接,代之以病毒-CAR连接,从而破坏原有的连接复合体,病毒得以穿越上皮。现有研究提示CAR在不同组织的分布不同,且作用多样,需进一步阐明。在生精上皮周期第八阶段,生精细胞穿过血睾屏障的行为非常类似柯萨奇病毒和腺病毒侵染宿主细胞的行为,因此生精细胞很可能采用同种“策略”穿越血睾屏障,即支持细胞—生精细胞之间的CAR-CAR连接,竞争性地取代了血睾屏障处原有的支持细胞间的CAR-CAR连接,从而使生精细胞通过血睾屏障进入生精上皮顶部微环境进一步发育成熟[14]。本研究结果显示,CAR siRNA组CAR mRNA、蛋白含量较对照组显著降低,表明siRNA有效干扰了目的基因表达。CAR沉默使TER降低,提示通透性增强,屏障功能降低,表明CAR表达变化的确可以改变支持细胞上皮的完整性,影响血睾屏障的功能,支持了上述推测。
本研究同时观察了CAR基因对支持细胞中Occludin蛋白表达和分布的影响。在血睾屏障,Occludin是构成紧密连接的重要组分之一,其功能的发挥与表达量及分布密切相关[4,5]。Western blotting分析显示,CAR干扰后Occludin表达量没有变化,但其分布发生改变。免疫荧光染色结果显示,正常时Occludin分布于细胞膜、细胞间连接处,呈线性;而CAR siRNA组Occludin分布较紊乱,细胞膜处减少,线性分布破坏,由细胞间连接处向细胞质内移增多。另外,已知EEA1是一内吞膜泡相关蛋白,是内涵体的标志物[15]。CAR siRNA组中与 EEA1结合的Occludin量升高,表明Occludin向细胞质内移增多是通过内吞增加引起的。以上结果提示,CAR沉默后引起支持细胞屏障通透性改变,至少部分是诱导Occludin蛋白内吞增强而分布改变的结果,表明CAR不只是血睾屏障的结构分子,而且对其他分子表达和功能等方面有调控作用。有研究表明,Occludin内吞与其磷酸化变化有关,可能CAR降低表达后导致磷酸酶活性改变,然后使Occludin磷酸化改变,最终导致Occludin分布改变;而参与的磷酸酶可能是非受体酪氨酸激酶c-Src,因为在血睾屏障该酶与CAR可形成蛋白复合物[4],这需进一步研究。
研究证实,血睾屏障对于生精上皮处精子发育至关重要。例如,血睾屏障在生精上皮周期的第Ⅷ至第Ⅸ阶段要经历大量的“打开—闭合”拆解和重建等完整性变化,以使前细线期生精细胞通过屏障进入顶部进一步发育。因此,如果能发现参与这一特定过程的靶分子,通过对靶分子的调控从而控制血睾屏障“开而不闭”或“闭而不开”,那么最终可干扰精子发生。本实验结果提示,CAR是与睾丸支持细胞上皮屏障调控密切相关的分子,因此,它是开发避孕药及探索不孕不育症机制的潜在靶点。
综上所述,CAR siRNA能增加睾丸支持细胞上皮屏障通透性,其机制可能与CAR诱导Occludin蛋白内吞增强而分布改变有关。
[1]Lui WY,Cheng CY.Transcriptional regulation of cell adhesion at the blood-testis barrier and spermatogenesis in the testis[J].Adv Exp Med Biol,2012,763:281-294.
[2]Mok KW,Mruk DD,Cheng CY.Regulation of blood-testis barrier(BTB)dynamics during spermatogenesis via the"Yin"and"Yang"effects of mammalian target of rapamycin complex 1(mTORC1)and mTORC2[J].Int Rev Cell Mol Biol,2013,301:291-358.
[3]马腾,王萍,薛一雪.RhoA参与缓激肽调节紧密连接相关蛋白occludin分布和表达的作用[J].山东医药,2011,51(25):28-29.
[4]Su L,Mruk DD,Lui WY,et al.P-glycoprotein regulates bloodtestis barrier dynamics via its effects on the occludin/zonula occludens 1(ZO-1)protein complex mediated by focal adhesion kinase(FAK)[J].Proc Natl Acad Sci U S A,2011,108(49):19623-19628.
[5]Pérez CV,Sobarzo CM,Jacobo PV,et al.Loss of occludin expression and impairment of blood-testis barrier permeability in rats with autoimmune orchitis:effect of interleukin 6 on Sertoli cell tight junctions[J].Biol Reprod,2012,87(5):122.
[6]Mirza M,Petersen C,Nordqvist K,et al.Coxsackievirus and adenovirus receptor is up-regulated in migratory germ cells during passage of the blood-testis barrier[J].Endocrinology,2007,148(11):5459-5469.
[7]Venkatraman G,Behrens M,Pyrski M,et al.Expression of Coxsackie-Adenovirus receptor(CAR)in the developing mouse olfactory system[J].J Neurocytol,2005,34(3-5):295-305.
[8]Vigl B,Zgraggen C,Rehman N,et al.Coxsackie-and adenovirus receptor(CAR)is expressed in lymphatic vessels in human skin and affects lymphatic endothelial cell function in vitro[J].Exp Cell Res,2009,315(2):336-347.
[9]Lie PP,Cheng CY,Mruk DD.Crosstalk between desmoglein-2/desmocollin-2/Src kinase and coxsackie and adenovirus receptor/ZO-1 protein complexes,regulates blood-testis barrier dynamics[J].Int J Biochem Cell Biol,2010,42(6):975-986.
[10] Mruk DD,Cheng CY.An in vitro system to study Sertoli cell blood-testis barrier dynamics[J].Methods Mol Biol,2011,763:237-252.
[11]Janecki A,Jakubowiak A,Steinberger A.Regulation of transepithelial electrical resistance in two-compartment Sertoli cell cultures:in vitro model of the blood-testis barrier[J].Endocrinology,1991,29(3):1489-1496.
[12]刘玉霞,李学仲,李冬梅,等.胎脑神经干细胞的培养及鉴定[J].山东医药,2007,47(22):24-25.
[13]Chen J,Fok KL,Chen H,et al.Cryptorchidism-induced CFTR down-regulation results in disruption of testicular tight junctions through up-regulation of NF-κB/COX-2/PGE2[J].Hum Reprod,2012,27(9):2585-2597.
[14]Wang CQ,Cheng CY.A seamless trespass:germ cell migration across the seminiferous epithelium during spermatogenesis[J].J Cell Biol,2007,178(4):549-556.
[15]Chua CE,Tang BL.Engagement of the small GTPase Rab31 protein and its effector,early endosome antigen 1,is important for trafficking of the ligand-bound epidermal growth factor receptor from the early to the late endosome[J].J Biol Chem,2014,289(18):12375-12389.
