RNA干扰抑制EZH2基因表达对人胶质瘤细胞凋亡及对卡莫司汀敏感性的影响
2014-12-02周章明楚胜华
周章明,楚胜华
(1成都大学附属都江堰医疗中心,四川都江堰611830;2上海交通大学附属第三医院)
放化疗是目前常见的肿瘤术后治疗手段。逃避凋亡是肿瘤发生、发展和产生药物抵抗的重要机制[1]。诱导肿瘤细胞凋亡并增强其对化疗药物的敏感性是目前肿瘤治疗的研究热点。果蝇zeste基因增强子人类同源物2(EZH2)是多疏基因(PcG)蛋白家族的重要成员,与肿瘤细胞凋亡并在促进癌细胞生长、侵袭、转移中起重要作用[2]。卡莫司汀可以通过血脑屏障,该药物及其代谢物可通过烷化作用与核酸交链,并有可能因改变蛋白质而产生抗肿瘤作用,为胶质瘤化疗的重要药物之一[3-5]。2012年5月~2013年6月,我们用RNA干扰技术抑制人胶质瘤U251细胞中EZH2基因的表达,并检测干扰后U251细胞对卡莫司汀的敏感性。现报告如下。
1 材料与方法
1.1 细胞培养及分组 人胶质瘤U251细胞购于中国科学院细胞所。细胞培养于含有10%新生小牛血清的RPMI-1640培养基中,内加青霉素1×105U/mL,链霉素 100 mg/mL,置于 5%CO2、饱和湿度、37℃恒温培养箱内培养。分为空白对照组、脂质体组、阴性对照组和pRNAT-EZH2组。
1.2 小干扰RNA(siRNA)真核表达载体的构建具有互补序列的能够编码短发卡RNA(shRNA)的双链寡核苷酸模板DNA由上海康成公司合成。其转录产物所形成的siRNA的作用靶点为人EZH2 mRNA。干扰序列为:AAGACTCTGAATGCAGTTGCT;在两端分别悬垂Sal I、Xba I的酶切位点,3'端酶切位点之前加入终止信号TTTT;阴性对照是双链寡核苷酸转录产物所形成的siRNA,此序列不与任何人类基因序列同源。
1.3 细胞转染 用Lipofectin-2000TM(美国Invitrogene公司)介导进行转染。空白对照组不转染。脂质体组转染液中仅含脂质体无siRNA。阴性对照组转染液加入空质粒pRNAT-Negative。pRNAT-EZH2组转染液加入重组pRNAT-EZH2质粒。
1.4 U251细胞中EZH2 mRNA检测方法 收集转染24、48、72 h各组细胞,用 Trizol(美国 Invitrogene公司)提取细胞总RNA,采用RT-PCR法检测EZH2 mRNA,操作按试剂盒说明书进行。EZH2引物序列:上游 5'-GCCAGACTGGGAAGAAATCTG-3',下游3'-TGTGCTGGAAAATCCAAGTCA-5',产物大小为86 bp。β-actin引物序列:上游 5'-ATCTGGCACCAAACACCTTCTACAATGAGCTGCG-3',下游5'-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3',产物为167 bp。以EZH2与β-actin条带的积分吸光度比值表示EZH2 mRNA的相对表达量。
1.5 卡莫司汀处理后各组细胞凋亡检测方法 将转染后48 h的细胞以2×105个/mL的密度接种在6孔培养板中,分别加入含卡莫司汀 10、25、50 μmol/L的完全培养基,每组设3个复孔,培养24、48 h后小心吸去培养液,加入0.5 mL细胞固定液,室温下固定10 min。吸去固定液,用PBS洗两遍,洗涤时用摇床晃动,每次3 min,吸尽液体。加入0.5 mL Hoechst 33258染色液,染色5 min。PBS洗两遍,每次3 min,吸尽液体。滴一滴抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片,尽量避免汽泡,使细胞接触封片液。用激光共聚焦显微镜观察细胞凋亡情况,激发波长352 nm,发射波长461 nm。
1.6 卡莫司汀处理后各组细胞增殖抑制情况检测方法 采用MTT法。取pRNAT-EZH2组、阴性对照组、空白对照组的对数生长期细胞接种于96孔培养板内,每孔加入细胞1×104个,24 h后加入含卡莫司汀10、25、50 μmol/L 的完全培养基,每组设3 个复孔,继续作用24 h,每孔加入20 μL MTT(5 mg/mL)继续培养4 h,吸弃去培养液,加入DMSO 150 μL,酶标仪测定570 nm处吸光度(A)值。取3孔平均A值。计算细胞增殖抑制率。
1.7 Caspase-3检测方法 取 pRNAT-EZH2组、阴性对照组、空白对照组的对数生长期细胞,24 h后加入含卡莫司汀 0、10、25、50μmol/L 的完全培养基,加入细胞裂解液裂解,用分光光度计检测Caspase-3水平。操作按试剂盒说明进行。
1.8 统计学方法 采用SPSS11.5统计软件。计量资料以±s表示,组间比采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 EZH2 mRNA 转染72 h,空白对照组、脂质体组、阴性对照组、pRNAT-EZH2组 U251细胞EZH2 mRNA相对表达量分别为 0.597±0.046、0.603 ±0.031、0.428 ± 0.047、0.151 ± 0.008。pRNAT-EZH2组与空白对照组相比,P<0.05,空白对照组与阴性对照组及脂质体组相比,P均>0.05。pRNAT-EZH2组转染24、48、72h时 EZH2 mRNA 表达抑制率分别为58.19%、73.37%和74.58%。
2.2 细胞凋亡情况 空白对照组及阴性对照组细胞经Hoechst 33258染色后,激光共聚焦显微镜下观察见细胞均匀蓝染,脂质体组和pRNAT-EZH2组细胞则检测出明显的细胞凋亡,细胞核或细胞质内可见浓染致密的颗粒状蓝色荧光及明显的荧光碎片,pRNAT-EZH2组凋亡细胞最多。
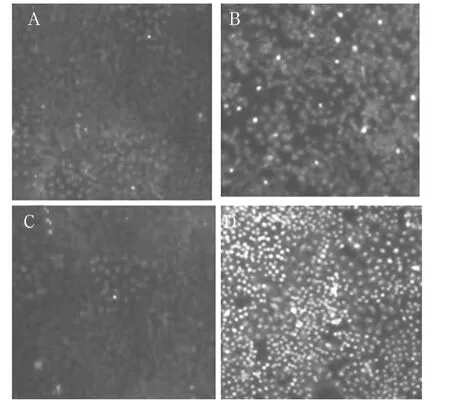
图1 各组细胞凋亡情况激光共聚焦显微镜观察结果
2.3 细胞增殖抑制率和Caspase-3相对表达量pRNAT-EZH2转染后,U251细胞增殖抑制率和Caspase-3相对表达量明显高于空白对照组和阴性对照组(P均<0.01),而空白对照组和阴性对照组的生长抑制率差异无统计学意义(P>0.05)。详见表1。
表1 不同浓度卡莫司汀处理后各组U251细胞增殖抑制率和Caspase-3相对表达量(±s)
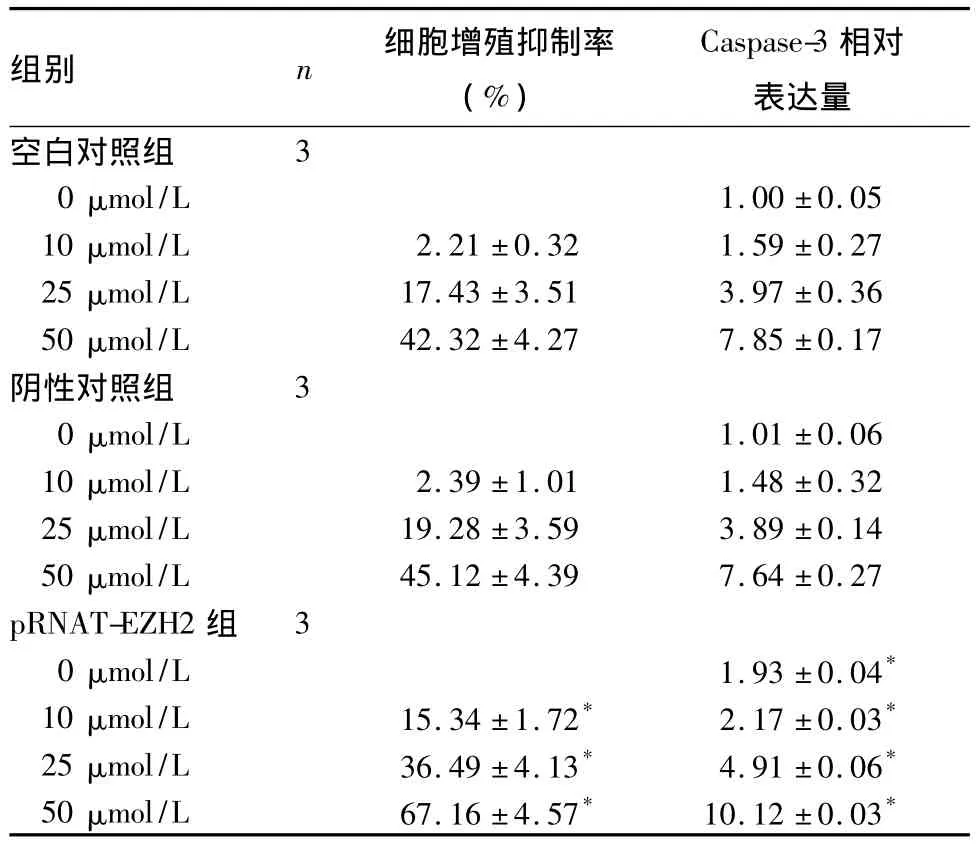
表1 不同浓度卡莫司汀处理后各组U251细胞增殖抑制率和Caspase-3相对表达量(±s)
注:与空白对照组和阴性对照组相比,*P<0.05
组别 n 细胞增殖抑制率(%)Caspase-3相对表达量空白对照组3 0 μmol/L 1.00 ±0.05 10 μmol/L 2.21 ±0.32 1.59 ±0.27 25 μmol/L 17.43 ±3.51 3.97 ±0.36 50 μmol/L 42.32 ±4.27 7.85 ±0.17阴性对照组 3 0 μmol/L 1.01 ±0.06 10 μmol/L 2.39 ±1.01 1.48 ±0.32 25 μmol/L 19.28 ±3.59 3.89 ±0.14 50 μmol/L 45.12 ±4.39 7.64 ±0.27 pRNAT-EZH2组 3 0 μmol/L 1.93 ±0.04*10 μmol/L 15.34 ±1.72* 2.17 ±0.03*25 μmol/L 36.49 ±4.13* 4.91 ±0.06*50 μmol/L 67.16 ±4.57* 10.12 ±0.03*
3 讨论
胶质瘤具有高侵袭性,局部复发转移快,并对已知的化疗药物基本耐药。术后化疗在胶质瘤的综合治疗中占有重要地位,多药耐药是影响治疗效果的重要原因[6,7]。化学药物所致细胞毒作用的终末效应均为诱导细胞凋亡[8],激活细胞凋亡的能力是抗肿瘤药物疗效的主要检测标准[9],由于肿瘤细胞常存在凋亡信号转导途径缺陷,导致许多肿瘤对化疗药物产生耐受[10]。因此通过沉默癌基因及活化凋亡信号关键分子而促进细胞凋亡,为提高肿瘤化疗敏感性提供了新思路。
EZH2是凋亡抑制蛋白家族中一类抑制凋亡、调节细胞分化的细胞因子[2]。目前已有研究发现在前列腺癌、胃腺、直肠癌等高度恶性转移性肿瘤中EZH2 过度表达[2,11~14]。RNA 干扰技术是通过小的双链RNA阻断体内特定基因的表达,促使mRNA降解,诱使细胞表现出特定基因缺失表达的技术,是目前沉默某些致病基因功能的高效及特异性手段。本研究构建了针对EZH2基因的siRNA真核表达载体,并用其转染人胶质瘤U251细胞,结果显示pRNAT-EZH2转染U251细胞后显著抑制了EZH2 mRNA表达,提示本研究构建的siRNA真核表达载体的确能够在细胞内持续地表达siRNA,高效、特异的抑制EZH2基因的表达。
进一步研究发现空白对照组及阴性对照组细胞经Hoechst 33258染色后,激光共聚焦显微镜下呈现的细胞均匀蓝染,而卡莫司汀组及卡莫司汀加pRNAT-EZH2组细胞则检测出明显的细胞凋亡,细胞核或细胞质内可见浓染致密的颗粒状蓝色荧光及明显的荧光碎片,其中可见卡莫司汀加pRNAT-EZH2组细胞凋亡最多。可以证实转染EZH2 siRNA促进了胶质瘤细胞凋亡,在与卡莫司汀联合作用下,凋亡更加明显。
本研究结果显示,稳定转染EZH2 siRNA真核表达载体后卡莫司汀对细胞生长抑制作用增加,pRNAT-EZH2转染U251细胞后增殖抑制率明显高于空白对照组和阴性对照组,卡莫司汀加pRNATEZH2组细胞增殖抑制尤为明显。Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中Caspase-3为关键的执行分子,它在凋亡信号传导的许多途径中发挥功能[15]。稳定转染 EZH2 siRNA载体后Caspase-3活性明显升高,以卡莫司汀加pRNAT-EZH2组细胞升高最为显著,表明用RNA干扰技术抑制EZH2表达造成肿瘤细胞对卡莫司汀的耐受性降低。
过多表达EZH2可能并非激活肿瘤细胞化疗药物的耐受性和抗凋亡能力所必需的因素,但抑制EZH2表达可能作为有效的调控信号,提高肿瘤细胞对卡莫司汀化疗敏感性,导致肿瘤细胞凋亡。本研究中笔者通过应用RNA干扰技术成功增加了人胶质瘤细胞对卡莫司汀的敏感性,应引起重视。
[1]Bradley D,Rees J.Updates in the management of high-grade glioma[J].J Neurol,2014,261(4):651-654.
[2]Yamaguchi H,Hung MC.Regulation and Role of EZH2 in Cancer[J].Cancer Res Treat,2014,46(3):209-222.
[3]Mack F,Schufer N,Kebir S,et al.Carmustine(BCNU)plus Teniposide(VM26)in Recurrent Malignant Glioma[J].Oncology,2014,86(5-6):369-372.
[4]Ishikawa E,Yamamoto T,Satomi K,et al.Intraoperative pathological diagnosis in 205 glioma patients in the pre-BCNU wafer era:retrospective analysis with intraoperative implantation of BCNU wafers in mind[J].Brain Tumor Pathol,2014,31(3):156-161.
[5]Yi N,Oh B,Kim HA,et al.Combined delivery of BCNU and VEGF siRNA using amphiphilic peptides for glioblastoma[J].J Drug Target,2014,22(2):156-164.
[6]Weller M,Pfister SM,Wick W,et al.Molecular neuro-oncology in clinical practice:a new horizon[J].Lancet Oncol,2013,14(9):370-379.
[7]Kim S,Jo S,Lee H,et al.Lobarstin enhances chemosensitivity in human glioblastoma T98G cells[J].Anticancer Res,2013,33(12):5445-5451.
[8]Schmitt CA.Senescence,apoptosis and therapy-cutting the lifelines of cancer[J].Nat Rev Cancer,2003,32:286-295.
[9]Chen N,Chen CC,Lau LF.Adhesion of human skin fibroblasts to EZH2 is mediated through integrin α6β1 and cell surface heparan sulfate proteoglycans[J].J Biol Chem,2000,275(3):24953-24961.
[10]Qiu S,Huang D,Yin D,et al.Suppression of tumorigenicity by microRNA-138 through inhibition of EZH2-CDK4/6-pRb-E2F1 signal loop in glioblastoma multiforme[J].Biochim Biophys Acta,2013,1832(10):1697-1707.
[11]McCabe MT,Creasy CL.EZH2 as a potential target in cancer therapy[J].Epigenomics,2014,6(3):341-51.
[12]Debeb BG,Gong Y,Atkinson RL,et al.EZH2 expression correlates with locoregional recurrence after radiation in inflammatory breast cancer[J].J Exp Clin Cancer Res,2014,33(1):58.
[13]Wee ZN,Li Z,Lee PL,et al.EZH2-mediated inactivation of IFN-γ-JAK-STAT1 signaling is an effective therapeutic target in MYC-driven prostate cancer[J].Cell Rep,2014,8(1):204-16.
[14]Cavalli G.Molecular biology.EZH2 goes solo.Science.2012;338(6113):1430-1431.
[15]Dõörr JR,Yu Y,Milanovic M,Beuster G,et,al.Synthetic lethal metabolic targeting of cellular senescence in cancer therapy[J].Nature,2013,501(7467):421-425.
